3.4E: Cristalización cuantificadora
- Page ID
- 73949
En esta sección, los datos de solubilidad real de los compuestos se utilizan para describir cuantitativamente la purificación de sólidos impuros que contienen una “impureza soluble” o una impureza con solubilidad similar al compuesto de interés.
Con una “Impureza Soluble”
La cristalización más simple en términos de purificación es cuando una impureza es muy soluble en el disolvente frío mientras que el compuesto de interés no lo es (ver secuencia procedimental en la Figura 3.27). En esta situación, la impureza queda atrapada en la matriz cristalina del sólido impuro, y solo necesita ser liberada por disolución. Después de añadir disolvente caliente para disolver el sólido impuro y luego enfriarlo, la impureza soluble permanece disuelta en las aguas madres mientras que el compuesto de interés cristaliza y puede recogerse por filtración por succión.
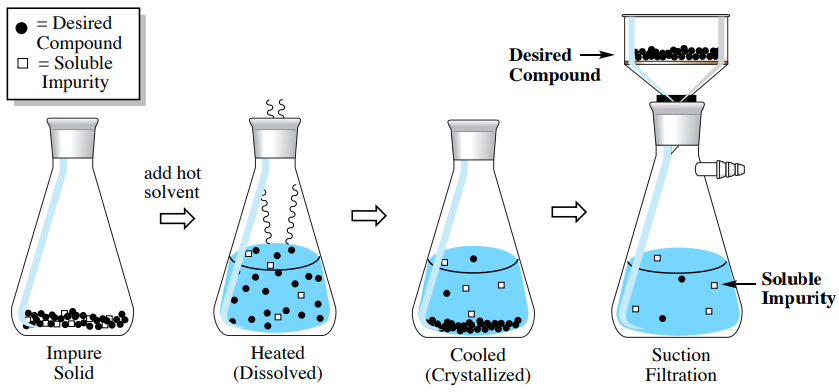
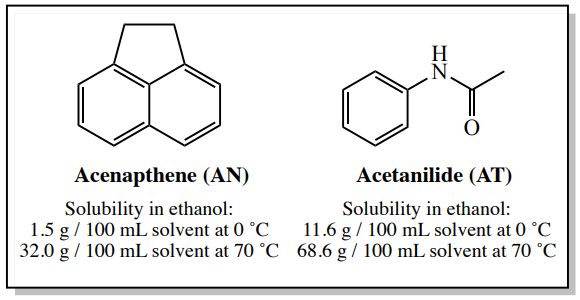
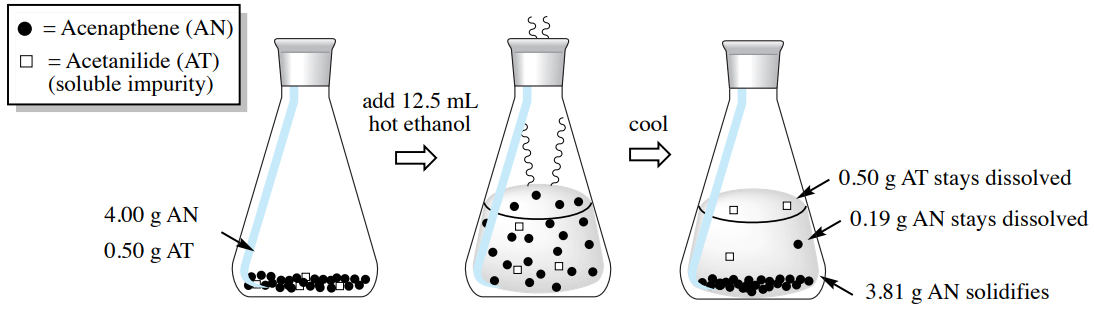
Un ejemplo de este tipo de sistema es una muestra que contiene \(4.00 \: \text{g}\)acenafteno y\(0.50 \: \text{g}\) acetanilida. Según la Purificación de Compuestos Orgánicos de Perrin, el\(^9\) acenafteno puede purificarse por cristalización usando etanol, y aunque esta muestra contiene una cantidad considerable de impureza de acetanilida (\(13 \: \text{mol}\%\)), los cálculos de esta sección mostrarán que este proceso debe trabajar bien.
Los valores de solubilidad de acenafteno y acetanilida en etanol se muestran en la Figura 3.28.
\(4.00 \: \text{g}\)de acenafteno puro (AN) debe disolverse completamente en\(12.5 \: \text{mL}\) (ver cálculo abajo) de etanol casi hirviendo (el punto de ebullición del etanol es\(78^\text{o} \text{C}\)). \(^{11}\)
\[4.00 \: \text{g Acenapthene (AN)} \times \frac{100 \: \text{mL hot ethanol}}{32.0 \: \text{g AN}} = \textbf{12.5 mL hot ethanol} \: \left( 70^\text{o} \text{C} \right) \: \text{to dissolve}\]
Dado que la acetanilida (AT) es más soluble que el acenafteno a esta temperatura (ver Figura 3.28), también debe disolverse completamente en\(12.5 \: \text{mL}\) etanol caliente.
Si la solución etanólica caliente que contiene estos dos componentes se enfría luego en un baño de hielo, el acenafteno debe cristalizar ya que tiene baja solubilidad en etanol frío. El siguiente cálculo muestra cuánto acenafteno quedaría disuelto en el etanol frío\(\left( 0.19 \: \text{g} \right)\). Cualquier cantidad de acenafteno presente mayor a la que\(0.19 \: \text{g}\) formaría un sólido, en este caso\(3.81 \: \text{g}\)\(\left( 4.00 \: \text{g} - 0.19 \: \text{g} \right)\).
\[12.5 \: \text{mL cold ethanol} \times \frac{1.5 \: \text{g acenapthene (AN)}}{100 \: \text{mL cold ethanol}} = \textbf{0.19 g AN} \: \text{remains dissolved in} \: 0^\text{o} \text{C} \: \text{ethanol}\]
La impureza de acetanilida, sin embargo, no debe cristalizar. El siguiente cálculo muestra que\(1.45 \: \text{g}\) de la acetanilida puede disolverse en el etanol frío, y como solo\(0.50 \: \text{g}\) estaba originalmente presente, la porción entera permanecería disuelta.
\[12.5 \: \text{mL cold ethanol} \times \frac{11.6 \: \text{g AT}}{100 \: \text{mL cold ethanol}} = \textbf{1.45 g AT} \: \text{can dissolve in} \: 0^\text{o} \text{C} \: \text{ethanol}\]
Este proceso se resume en la Figura 3.29. Como solo cristaliza el acenafteno, podría recogerse a través de filtración y separarse de la impureza de acetanilida en las aguas madres.
La purificación de esta mezcla funciona bien en teoría porque la acetanilida es mucho más soluble (aproximadamente diez veces más) en el etanol frío que en el acenafteno, y así se puede eliminar. En la práctica, si la cristalización se realiza con demasiada rapidez, aún existe la posibilidad de que la acetanilida se incorpore al sólido en desarrollo.
Con una Impureza de Solubilidad Similar
Si un sólido impuro contiene una impureza que tiene propiedades de solubilidad similares al compuesto deseado, aún es posible purificar la mezcla a través de cristalización si la impureza está presente en una pequeña cantidad. Un ejemplo es una muestra que contiene \(4.00 \: \text{g}\)acenafteno y\(0.30 \: \text{g}\) fenantreno (el fenantreno es\(6 \: \text{mol}\%\) de la muestra). La solubilidad de estos compuestos en etanol se muestra en la Figura 3.30.
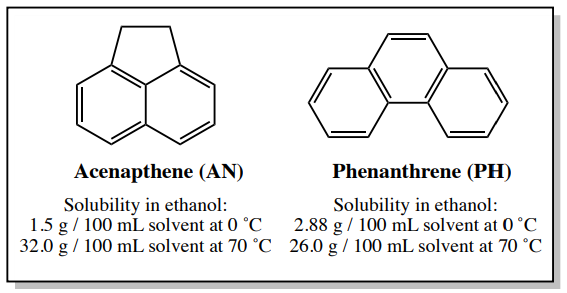
\(4.00 \: \text{g}\)de acenafteno puro (AN) debe disolverse completamente en\(12.5 \: \text{mL}\) (ver cálculo abajo) de etanol casi hirviendo (el punto de ebullición del etanol es\(78^\text{o} \text{C}\). \(0.30 \: \text{g}\)de fenantreno puro (PH) se disolvería en\(1.2 \: \text{mL}\) etanol caliente (ver cálculo abajo), y así también se disolvería en\(12.5 \: \text{mL}\) se utilizaron.
\[4.00 \: \text{g Acenapthene (AN)} \times \frac{100 \: \text{mL hot ethanol}}{32.0 \: \text{g AN}} = \textbf{12.5 mL hot ethanol} \: \left( 70^\text{o} \text{C} \right) \: \text{to dissolve AN}\]
\[0.30 \: \text{g Phenanthrene (PH)} \times \frac{100 \: \text{mL hot ethanol}}{26.0 \: \text{g PH}} = \textbf{1.2 mL hot ethanol} \: \left( 70^\text{o} \text{C} \right) \: \text{to dissolve PH}\]
Si esta solución caliente se enfría luego en un baño de hielo, los cálculos a continuación muestran la cantidad de cada compuesto que permanecería disuelto en el etanol frío.
\[12.5 \: \text{mL cold ethanol} \times \frac{1.5 \: \text{g acenapthene (AN)}}{100 \: \text{mL cold ethanol}} = \textbf{0.19 g AN} \: \text{remains dissolved in} \: 0^\text{o} \text{C} \: \text{ethanol}\]
\[12.5 \: \text{mL cold ethanol} \times \frac{2.88 \: \text{g phenanthrene (PH)}}{100 \: \text{mL cold ethanol}} = \textbf{0.360 g PH} \: \text{remains dissolved in} \: 0^\text{o} \text{C} \: \text{ethanol}\]
Dado que mayor que esta cantidad de acenafteno está presente, la mayor parte cristalizará\(\left( 3.81 \: \text{g} \right)\). Sin embargo, dado que solo\(0.30 \: \text{g}\) de fenantreno está presente, toda la porción debe permanecer en el licor madre. Los dos componentes se pueden separar a través de filtración.
En esencia, las impurezas que tienen una solubilidad similar al compuesto de interés se pueden eliminar como impurezas solubles siempre que estén presentes en cantidades suficientemente pequeñas. Es una guía general que los sólidos que contienen menos\(5 \: \text{mol}\%\) de impureza pueden ser purificados de esta manera. El proceso de cristalización esencialmente “sacrifica” una porción de cada componente a las aguas madres para producir un cristal puro.
\(^9\)D.D. Perrin, W.L.F. Armarego, Purificación de Químicos Orgánicos, Prensa Pergamon, 3\(^\text{rd}\) edición, 1988.
\(^{10}\)Adaptado de los datos encontrados en: A. Seidell, Solubilidades de Sustancias Inorgánicas y Orgánicas, D. Van Nostrand Company, 1907.
\(^{11}\)Es muy posible que la mezcla acenapteno/acetanilida requiera una cantidad ligeramente diferente de etanol caliente para disolverse que las muestras puras, pero los cálculos en esta sección proporcionan una estimación aproximada de los volúmenes de disolvente necesarios.
\(^{12}\)Adaptado de los datos encontrados en: A. Seidell, Solubilidades de Sustancias Inorgánicas y Orgánicas, D. Van Nostrand Company, 1907.


