3.4F: Cristalización de Segundo Cultivo
- Page ID
- 73964
Como se discutió anteriormente, una porción del compuesto de interés siempre permanece disuelta en las aguas madres y se filtra. Esto no quiere decir que esta porción se pierda, ya que es posible recuperar compuesto adicional de las aguas madres. El disolvente se puede concentrar en el recipiente original o en un evaporador rotatorio, y se puede intentar una segunda cristalización. Una segunda cristalización a partir del licor madre de la primera cristalización se denomina "cristalización de segunda cosecha”.
Para demostrar este proceso, se cristalizó una\(1.16 \: \text{g}\) muestra de ácido trans-cinámico a partir de un sistema disolvente mixto metanol/agua (Figura 3.31). \(0.95 \: \text{g}\)de una “primera cosecha” de cristales, lo que representa una\(82\%\) recuperación.

Para recolectar una segunda cosecha de cristales, el filtrado se pipeteó en un matraz Erlenmeyer (Figura 3.32a) y se hirvió para reducir el volumen a la mitad (Figuras 3.32b+c). Cuando esta solución se enfrió, otro\(0.08 \: \text{g}\) de compuesto cristalizó (Figura 3.32d), haciendo la recuperación combinada de ácido trans-cinámico\(1.03 \: \text{g}\), o\(89\%\).

Un sólido de “segunda cosecha” siempre debe mantenerse separado de un sólido de “primera cosecha” hasta que se pueda verificar su pureza. Un cristal de segunda cosecha suele ser más impuro que un cristal de primera cosecha, ya que cristaliza a partir de una solución que contiene un mayor porcentaje de impurezas (la primera cosecha eliminó más compuesto, dejando más impurezas atrás).
Para demostrar la pureza relativa de los cristales de primer y segundo cultivo, se cristalizó una\(1.5 \: \text{g}\) mezcla de 4-bromoacetofenona contaminada con una pequeña cantidad de acetofenona usando etanol. Un espectro GC de la mezcla original (Figura 3.33b) muestra que la muestra tiene aproximadamente impureza de\(7 \: \text{mol}\%\) acetofenona.
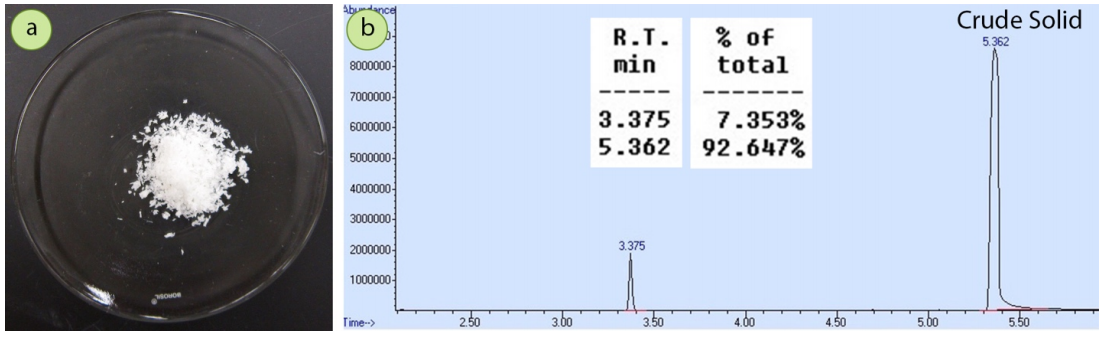
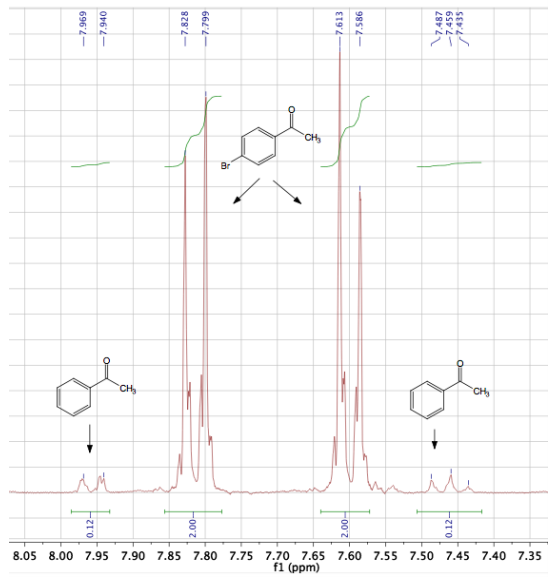
La cuantificación por un instrumento de CG-EM a veces puede ser inexacta, por lo que la composición también se calculó a través de integraciones de\(\ce{^1H}\) RMN. El espectro de\(\ce{^1H}\) RMN parcial de esta muestra se encuentra en la Figura 3.34, y las integraciones indican que la muestra es\(5.6 \: \text{mol}\%\) acetofenona. Hay un buen acuerdo entre los dos métodos cuantitativos.
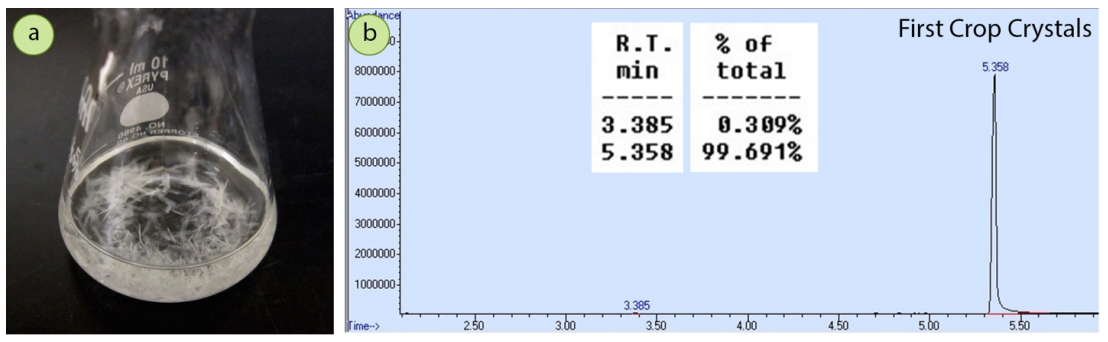
Después de que la mezcla se cristalizó a partir de etanol, un espectro de GC del sólido resultante (\(0.93 \: \text{g}\),\(63\%\) recuperación) mostró una drástica reducción en la impureza de acetofenona, a cantidades casi insignificantes (Figura 3.35b). La cristalización purificó muy bien la 4-bromoacetofenona.
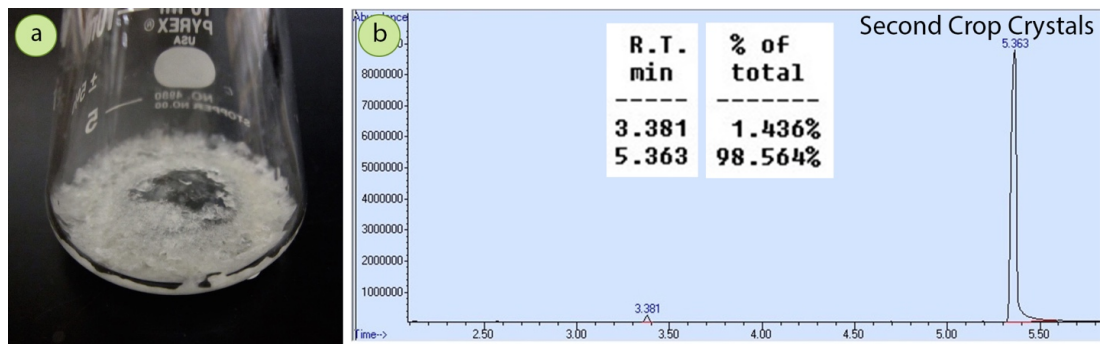
El filtrado de la primera cristalización se hirvió para reducir el nivel de solvente, y se obtuvo una segunda cosecha de cristales (\(0.18 \: \text{g}\), recuperación combinada de\(77\%\)). Los cristales de la segunda cosecha tuvieron un tinte amarillo notable mientras que los cristales de la primera cosecha fueron de color blanco puro. Un espectro GC de los cristales de la segunda cosecha (Figura 3.36b) mostró que la acetofenona se había incorporado algo al sólido cristalino, demostrando que los cristales de segundo cultivo son menos puros que los cristales de primer cultivo.
La recuperación de una segunda cosecha de cristales no se realiza comúnmente en entornos de pregrado ya que la recuperación adicional de una segunda cosecha suele ser modesta (Figura 3.37). Sin embargo, el proceso puede realizarse si el material es bastante caro, o si queda una gran cantidad disuelta en las aguas madres. Por esta última razón, es una buena idea guardar el licor madre hasta que se pueda calcular un rendimiento. Si la recuperación es bastante baja, se podría intentar una segunda cristalización.

\(^{13}\)Método GC:\(100^\text{o} \text{C}\) mantener por 2 min,\(25^\text{o} \text{C}\) rampa por min a\(210^\text{o} \text{C}\) (6.4 min), retardo de solvente 2.00 min.


