4.7: Trabajos de reacción
- Page ID
- 73840
Propósito de un trabajo
Cuando el objetivo de un experimento es realizar una reacción y aislar el producto, la secuencia general de eventos se muestra en la Tabla 4.4.
 |
 |
 |
 |
| a) Llevar a cabo la reacción. | b) Realizar múltiples extracciones y/o lavados para purificar parcialmente el producto deseado. | c) Eliminar las trazas de agua con un agente secante. d) Filtrar o decantar el agente secante. |
e) Retirar el disolvente con un evaporador rotatorio f) Purificar más si es necesario. |
Un paso clave en esta secuencia viene inmediatamente después de que se completa la reacción, y se denomina reacción "elaboración" (paso b) en la Tabla 4.4). El tratamiento se refiere a métodos destinados a purificar el material, y más comúnmente ocurren en un embudo separador. Se agregan soluciones al embudo para extraer o lavar la mezcla, con el objetivo de aislar el producto del exceso de reactivos, catalizadores, productos secundarios, solventes o compuestos formados a partir de reacciones secundarias.
Lavados Comunes
Agua
El lavado más común en los embudos separatorios es probablemente el agua. El agua es barata, no es peligrosa y funciona bien para eliminar las impurezas que se encuentran junto con un producto deseado.
El agua puede eliminar potencialmente las impurezas solubles en agua de una capa orgánica, siempre y cuando estén presentes en cantidades que no excedan su solubilidad en agua. Los siguientes son materiales comunes que se pueden eliminar con un lavado con agua: ácido o base sin consumir, muchas sales iónicas y compuestos que pueden formar enlaces de hidrógeno con agua (tienen un átomo de oxígeno o nitrógeno) y son relativamente pequeños (por ejemplo\(\ce{CH_3CH_2OH}\) o\(\ce{CH_3COCH_3}\)).
Para demostrar la efectividad de un lavado con agua, se realizó una reacción de esterificación de Fischer para producir acetato de isoamilo (Figura 4.38). En esta reacción, se utiliza un exceso de ácido acético para impulsar la reacción a través del principio de Le Chatelier, y el ácido acético tuvo que eliminarse del producto durante el proceso de purificación.
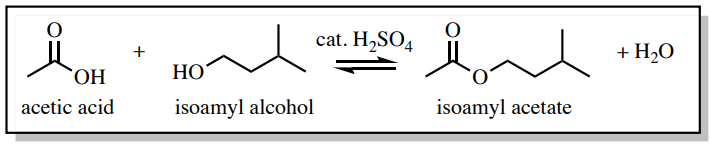
El espectro de\(\ce{^1H}\) RMN en la Figura 4.39a se tomó de la mezcla de reacción inmediatamente después de cesar el calentamiento y antes del tratamiento. Como era de esperar, se observa una señal significativa para el ácido acético en\(2.097 \: \text{ppm}\).
“La reacción se “" procesó "” vertiendo la mezcla de reacción en un embudo separador y lavando la capa orgánica con agua, bicarbonato de sodio y salmuera sucesivamente.” El propósito principal del lavado con agua fue eliminar la mayor parte del ácido sulfúrico catalítico y el exceso de ácido acético, mientras que el lavado con bicarbonato de sodio neutralizó el resto. El espectro de\(\ce{^1H}\) RMN del producto final (Figura 4.39b) mostró que los lavados fueron efectivos ya que la señal de ácido acético a\(2.097 \: \text{ppm}\) está ausente.
El lavado con bicarbonato de sodio en este ejemplo fue necesario (y se discutió en la siguiente sección) porque un lavado con agua solo puede no eliminar completamente el ácido acético. Es importante saber que cuando un compuesto es “soluble en agua” no significa necesariamente que sea “insoluble orgánico”, una idea errónea común que surge del principio de “como se disuelve como”. Por ejemplo, el ácido acético tiene un\(K\) de 0.5 cuando se reparte entre éter dietílico y agua, lo que significa que el ácido acético favorece la capa acuosa solo el doble que la capa orgánica. \(^4\)No se debe ignorar la capacidad del ácido acético y otros compuestos polares para disolverse en la capa orgánica de un embudo separador.
Bicarbonato de sodio y carbonato de sodio
Cómo funcionan
Una parte normal de muchos trabajos incluye la neutralización. Es importante neutralizar cualquier disolvente orgánico que se haya expuesto a una solución ácida o básica ya que el ácido traza o base puede provocar reacciones no deseadas cuando se concentran las soluciones. Además, las muestras destinadas al análisis GC deben ser neutras ya que las soluciones ácidas degradan el recubrimiento polimérico de la columna GC. Además, es preferible manipular materiales neutros en lugar de ácidos o básicos, ya que los derrames son entonces menos peligrosos.
Las soluciones acuosas de bicarbonato de sodio saturado\(\left( \ce{NaHCO_3} \right)\) y carbonato de sodio\(\left( \ce{Na_2CO_3} \right)\) son básicas, y el propósito de estos lavados es neutralizar una capa orgánica que pueda contener componentes ácidos traza. Incluso si una capa orgánica no debería en teoría disolver componentes muy polares como el ácido, el ácido a veces “engancha un paseo” en componentes polares que pueden disolverse en una capa orgánica, como pequeñas cantidades de alcoholes o agua.

Las siguientes reacciones ocurren entre el ion bicarbonato (1), el ion carbonato (2) y\(\left( \ce{H^+} \right)\) el ácido durante un lavado:
\[\ce{HCO_3^-} \left( aq \right) + \ce{H^+} \left( aq \right) \rightarrow \ce{H_2CO_3} \left( aq \right) \rightleftharpoons \ce{H_2O} \left( l \right) + \ce{CO_2} \left( g \right) \tag{1}\]
\[\ce{CO_3^{2-}} \left( aq \right) + \ce{H^+} \left( aq \right) \rightarrow \ce{HCO_3^-} \left( aq \right) \tag{2}\]
El producto inicial de la reacción (1) es el ácido carbónico\(\left( \ce{H_2CO_3} \right)\), el cual está en equilibrio con el agua y el gas dióxido de carbono. Esto significa que las soluciones de bicarbonato a menudo burbujean durante un lavado de neutralización en un embudo separador. El producto de la reacción (2) es el ion bicarbonato, que posteriormente puede someterse a la reacción (1). Esto significa que las soluciones de iones carbonato también suelen burbujear durante las neutralizaciones.
Nota de seguridad: Para evitar que se genere una forma de exceso de presión por la liberación de gas dióxido de carbono en un embudo separador durante la neutralización, las capas deben arremolinarse suavemente juntas antes de colocar el tapón. Deben ventilarse directamente después de la inversión, y con mayor frecuencia de lo habitual. La Figura 4.41 muestra una capa orgánica fuertemente ácida (parte superior) en contacto con una solución acuosa de bicarbonato de\(10\%\) sodio (parte inferior). Se observa una vigorosa corriente de burbujas que se origina en una pequeña porción de capa orgánica atrapada en el fondo del embudo. El burbujeo fue aún más vigoroso cuando las capas se mezclaron entre sí.

Prueba del pH después de un lavado
Para probar si un lavado base con\(\ce{NaHCO_3}\) o\(\ce{Na_2CO_3}\) fue efectivo para eliminar todo el ácido de una capa orgánica, es útil probar el pH. No es posible ensayar el pH de una solución orgánica directamente, sin embargo es posible probar el pH de una solución acuosa con la que la solución orgánica ha estado en contacto. Si la capa acuosa está en la parte superior de un embudo separador, inserte una varilla agitadora de vidrio en la capa superior y toca la varilla húmeda con papel tornasol azul. Una solución ácida vuelve el papel tornasol azul rosado (o rojo), mientras que una solución neutra o básica le da al papel tornasol azul solo un aspecto oscurecido “húmedo” (Figura 4.42d). Si el papel tornasol se vuelve rosado en absoluto\(^5\), el lavado base no ha neutralizado completamente la capa orgánica, y se necesitan lavados de base posteriores.
Si la capa acuosa se encuentra en el fondo del embudo separador, pruebe una "alícuota" de la capa acuosa (o pequeña muestra) sobre papel tornasol mediante el siguiente método:

- Con un dedo colocado encima de una pipeta de vidrio, inserte la pipeta en el embudo separador para que la punta quede colocada en la capa acuosa inferior (Figura 4.42a).
- Retirar el dedo de la pipeta para permitir que una muestra de la capa acuosa entre en la pipeta por acción capilar (Figura 4.42b).
- Con un dedo colocado nuevamente encima de la pipeta de vidrio, retire la pipeta del embudo separador. Debe quedar un poco de líquido en la punta de la pipeta, una alícuota de la capa inferior (Figura 4.42c).
- Toca la alícuota al papel tornasol azul y observa el color (Figura 4.42d).
- Si el papel tornasol se vuelve rosado en absoluto, el lavado base no ha neutralizado completamente la capa orgánica, y se necesitan lavados de base posteriores.
Salmuera (Saturada\(\ce{NaCl}\))
En algunos experimentos, una capa orgánica se puede lavar con salmuera, que es una solución saturada de\(\ce{NaCl} \left( aq \right)\). El propósito de este lavado es eliminar grandes cantidades de agua que pueda disolverse en la capa orgánica. Aunque la capa orgánica siempre debe exponerse posteriormente a un agente secante (por ejemplo, sulfato de sodio anhidro, sulfato de magnesio o cloruro de calcio), estos reactivos en el mejor de los casos eliminan solo pequeñas cantidades de agua.

Los disolventes orgánicos que requieren un lavado con salmuera antes de la exposición a un agente de secado sólido son éter dietílico y acetato de etilo. Estos disolventes disuelven grandes cantidades de agua en comparación con otros solventes (Cuadro 4.5).
| Solvente | Gramos de agua disuelta en 100 mL de disolvente |
|---|---|
| Éter dietílico | 1.24 g |
| Acetato de etilo | 2.92 g |
| Diclorometano (\(CH_2Cl_2\)) | 0.32 g |
| Hexanos | 0.007 g |
La salmuera trabaja para eliminar el agua de una capa orgánica porque está altamente concentrada (ya que\(\ce{NaCl}\) es muy soluble en agua). Una\(\ce{NaCl} \left( aq \right)\) solución saturada está altamente ordenada, lo que provoca una gran motivación para que el agua se introduzca en la solución desde la capa orgánica para aumentar la entropía de la solución salina (para diluir la solución).
La Figura 4.44 muestra una diferencia cualitativa en la cantidad de agua presente en una capa orgánica con y sin el uso de un lavado de salmuera. El acetato de etilo se agitó con agua (Figura 4.44a), luego se secó con una porción de anhidro\(\ce{MgSO_4}\). Los grandes grumos de agente secante en la Figura 4.44b indican que esta capa de acetato de etilo aún está notablemente húmeda. El acetato de etilo se agitó con salmuera (Figura 4.44c) y se secó con la misma cantidad de anhidro\(\ce{MgSO_4}\). Hay poca aglomeración del agente secante en esta capa de acetato de etilo, y se observan partículas finas (Figura 4.44d), lo que significa que esta capa contenía muy poca agua.

Si se usan agentes secantes para eliminar el agua, podría preguntarse “¿Por qué molestarse con la salmuera; ¿por qué no usar mucho agente secante cuando llegue el momento?” La razón principal para limitar la cantidad de agua presente en una solución orgánica antes de la etapa del agente de secado es que el agente de secado a menudo adsorberá el compuesto junto con el agua. Usar lo menos posible maximizará el rendimiento.
Para demostrarlo, la Figura 4.45 muestra una solución de acetato de etilo que tiene un tinte rosado tenue debido a que contiene algún colorante alimentario rojo disuelto. La solución se arremolinó con blanco anhidro\(\ce{MgSO_4}\), y el agente secante se volvió rosado al adsorber el compuesto colorante alimentario rojo (Figura 4.45a). La adición de más anhidro\(\ce{MgSO_4}\) hizo que el agente secante se volviera más rosado (Figura 4.45b), ya que se eliminó más tinte de la solución. En este ejemplo, incluso después de filtrar y enjuagar el agente secante con disolvente adicional, el agente secante permaneció rosado (Figura 4.45c). De esta manera, cuanto más agente secante se utilice, más compuesto se puede perder irrecuperablemente.

Disminución de la solubilidad en agua de compuestos orgánicos (“Salting Out”)
Se pueden usar soluciones iónicas saturadas para disminuir la solubilidad de los compuestos orgánicos en la capa acuosa, permitiendo que más compuesto se disuelva en la capa orgánica. Si un producto deseado puede formar enlaces de hidrógeno con agua y es relativamente pequeño, puede ser difícil mantenerlo en la capa orgánica cuando se reparte con una fase acuosa (\(K\)será <1). Sin embargo, el equilibrio puede favorecer la capa orgánica si todos los lavados acuosos contienen altas concentraciones de iones (por ejemplo\(\ce{NaHCO_3}\), saturados\(\ce{NaCl}\), o\(\ce{NH_4Cl}\)). Al estar tan fuertemente “ocupada” el agua en la disolución de los iones en estas soluciones, son menos capaces de disolver compuestos orgánicos. Adicionalmente, las soluciones iónicas tienen altas constantes dieléctricas, haciéndolas menos compatibles con compuestos orgánicos.
La Figura 4.47 muestra cómo la salmuera afecta la partición del colorante alimentario rojo en acetato de etilo y soluciones acuosas. La Figura 4.47a muestra la adición de una gota de colorante alimentario rojo a una capa de agua en un embudo separador, y el tinte se disuelve fácilmente incluso sin arremolinar. La Figura 4.47b muestra la capa acuosa que contiene el colorante después de agitar con una porción de acetato de etilo. La capa orgánica tiene sólo un color rosa muy tenue, lo que significa que poco tinte se ha disuelto. El colorante obviamente se ha dividido hacia la capa acuosa, lo que es consistente con su estructura muy polar (Figura 4.46).
La Figura 4.47c muestra la adición de una gota de colorante alimentario rojo a una solución de salmuera, y el colorante no parece mezclarse con la salmuera en absoluto. La Figura 4.47d muestra la capa de salmuera que contiene el colorante después de agitar con una porción de acetato de etilo. La capa orgánica es más rosada, lo que significa que ahora se ha dividido más tinte hacia la capa orgánica. las moléculas de tinte polar son mucho menos solubles en la solución de salmuera que en agua pura (han sido "saladas"”). De hecho, parte del colorante precipitó en el embudo (Figura 4.47d) ya que tenía una solubilidad tan baja tanto en salmuera como en acetato de etilo.

Agentes Secantes
Por qué se utilizan
Una capa orgánica se trata siempre con un agente secante después de haber sido expuesta al agua en un embudo separador (etapa c) en la Tabla 4.4). Los agentes secantes son materiales inorgánicos anhidros que forman favorablemente “hidratos”, que incorporan moléculas de agua en su estructura reticular sólida (por ejemplo,\(\ce{Na_2SO_4} \cdot 7 \ce{H_2O}\)). Un agente secante se arremolina con una solución orgánica para eliminar trazas de agua.
Muchos disolventes orgánicos disuelven una porción significativa de agua (Cuadro 4.6) que debe eliminarse antes de la evaporación rotatoria, o bien se encontrará agua en el producto concentrado. Después de la eliminación del solvente usando un evaporador rotatorio, ocasionalmente sucede que hay tanta agua que se ve gotitas o una segunda capa entre el líquido oleoso en un matraz de fondo redondo. La presencia de agua con el producto hace que el rendimiento sea inexacto, y el agua también debe eliminarse antes del análisis GC-MS, ya que el agua es incompatible con los detectores de espectrómetro de masas.
| Solvente | Gramos de agua disuelta en 100 mL de disolvente |
|---|---|
| Éter dietílico | 1.24 g |
| Acetato de etilo | 2.92 g |
| Diclorometano (\(CH_2Cl_2\)) | 0.32 g |
| Hexanos | 0.007 g |
Los agentes secantes deben usarse incluso con solventes orgánicos relativamente no polares que teóricamente no disuelven mucha agua, ya que el agua puede adherirse a los lados del embudo separador y viajar inadvertidamente con la capa orgánica mientras drena. Adicionalmente, los solutos disueltos en una capa orgánica con grupos funcionales polares (por ejemplo, alcoholes, ácidos carboxílicos) pueden formar enlaces de hidrógeno con agua y aumentar la probabilidad de que el agua se disuelva en la capa orgánica.
Tipos de Agentes Secantes

Los agentes secantes (Figura 4.48) eliminan trazas de agua de las soluciones orgánicas formando hidratos. Los agentes secantes más útiles indican cuándo han absorbido completamente toda el agua de la solución. \(\left( \ce{MgSO_4} \right)\)El sulfato de magnesio anhidro es un polvo fino y suelto (Figura 4.49a), pero su hidrato es grumoso y a menudo se adhiere al vidrio (Figura 4.49b). Un procedimiento de secado típico es agregar anhidro\(\ce{MgSO_4}\) a una solución orgánica hasta que deje de aglutinarse y se vean partículas finas, lo que indica que ya no hay agua disponible para formar los hidratos grumosos.

Sulfato de calcio anhidro\(\left( \ce{CaSO_4} \right)\), se puede adquirir conteniendo un compuesto de cobalto que es azul cuando está seco y rosado cuando está mojado (éste luego se vende bajo el nombre Drierite, Figura 4.49c+d). De esta manera, la Drierita azul puede ser utilizada como indicador visual de la presencia de agua. \(^8\)
Los agentes secantes más comunes utilizados para eliminar el agua de las soluciones orgánicas son el sulfato de sodio anhidro\(\left( \ce{Na_2SO_4} \right)\) y el sulfato de magnesio anhidro\(\left( \ce{MgSO_4} \right)\). Muchos químicos consideran\(\ce{MgSO_4}\) el agente de secado “de referencia”, ya que funciona rápidamente, retiene mucha agua para su masa y los hidratos son notablemente más gruesos en comparación con la forma anhidra, lo que facilita ver cuando se ha agregado suficiente. Un inconveniente de usar\(\ce{MgSO_4}\) es que se trata de un polvo fino, por lo que las soluciones deben filtrarse posteriormente para eliminar el agente secante. Otro inconveniente\(\ce{MgSO_4}\) es que todos los polvos finos adsorben fuertemente el producto en su superficie (razón por la cual deben enjuagarse con disolvente después de la filtración), y en ocasiones se utilizan agentes secantes más granulares para minimizar la pérdida de producto por adsorción.
En algunos procedimientos\(\ce{Na_2SO_4}\) o se\(\ce{CaCl_2}\) utilizan si parecen funcionar igual de bien\(\ce{MgSO_4}\), o si la solución es incompatible con\(\ce{MgSO_4}\) (ver Cuadro 4.8). Una ventaja procesal de estos agentes secantes es que sus gránulos no se dispersan fácilmente, permitiendo que las soluciones sean fácilmente decantadas (vertidas). En muchas situaciones, los agentes secantes son intercambiables (ver Cuadro 4.8 para un estudio de los agentes secantes). Sin embargo, es más común que los desecadores y tubos de secado utilicen\(\ce{CaSO_4}\) o\(\ce{CaCl_2}\) (Figura 4.50), ya que pueden manipularse fácilmente en sus formas de pellets o rocas.

| Agente Secante | Fórmula (s) de hidrato | Comentarios Prácticos | Otros comentarios |
|---|---|---|---|
| Sulfato de magnesio | \(\ce{MgSO_4} \cdot 7 \ce{H_2O}\) | Elimina rápidamente la mayor parte del agua y puede contener mucho por su masa (\(0.15\)-\(0.75 \: \text{g}\) agua por\(\text{g}\) desecante). \(^9\)Es un polvo fino, por lo que debe ser filtrado por gravedad. Su alta superficie significa que adsorberá un poco el compuesto: asegúrese de enjuagar después de filtrar. | \(\ce{Mg(H_2O)_4^{2+}}\)es algo ácido, por lo que es incompatible con grupos altamente sensibles a los ácidos. |
| Sulfato de sodio |
\(\ce{Na_2SO_4} \cdot 7 \ce{H_2O}\) \(\ce{Na_2SO_4} \cdot 10 \ce{H_2O}\) |
Elimina el agua a una velocidad moderada, por lo que la solución debe dejarse reposar con el agente secante durante algún tiempo. Puede contener mucha agua por su masa (\(1.25 \: \text{g}\)agua por\(\text{g}\) desecante), pero puede dejar pequeñas cantidades de agua restante. Las soluciones con\(\ce{Na_2SO_4}\) generalmente se pueden decantar. | No puede secar bien el éter dietílico a menos que se use un lavado con salmuera. |
| Cloruro de calcio |
\(\ce{CaCl_2} \cdot 2 \ce{H_2O}\) \(\ce{CaCl_2} \cdot 6 \ce{H_2O}\) |
Elimina rápidamente bien el agua, aunque se necesitan cantidades mayores que otros agentes secantes (retiene\(0.30 \: \text{g}\) agua por\(\text{g}\) desecante). Si se usa un polvo fino, la solución debe filtrarse por gravedad y enjuagarse con el agente secante. Si se usan pellets, la solución debe dejarse reposar durante unos minutos, luego decantarse. | Absorbe agua así como metanol y etanol. |
| Sulfato de calcio (Drierita) |
\(\ce{CaSO_4} \cdot \frac{1}{2} \ce{H_2O}\) \(\ce{CaSO_4} \cdot 2 \ce{H_2O}\) |
Elimina rápidamente el agua, pero necesita grandes cantidades ya que contiene poca agua por gramo. Se utilizan con mayor frecuencia en desecadores y tubos de secado, no con soluciones. |
Procedimiento de Agentes Secantes

- La solución orgánica a secar debe estar en un matraz Erlenmeyer, ya que las soluciones pueden salpicar fácilmente de los vasos de precipitados cuando se arremolinan.
- Primero inspeccione la solución para ver si es homogénea, o si hay una segunda capa de líquido (típicamente un charco en el fondo). Si se nota una segunda capa, esta probablemente sea agua y la mayor parte de ella se debe pipetear antes de continuar (Figura 4.51a). Puede ser difícil eliminar completamente una capa de agua con una pipeta, por lo que dejar un poquito es aceptable.
- Agregue una pequeña porción de agente secante al matraz, del tamaño de un guisante para el trabajo a macroscale (Figura 4.51b), y arremoline la solución (Figura 4.51c). Asegúrese de cerrar el frasco de agente secante cuando no esté en uso, ya que los reactivos son higroscópicos. Después de un corto periodo de tiempo, inspeccione la mezcla de cerca.
- Si todo el agente secante se agrupa en trozos que son mucho más grandes que el tamaño original (Figura 4.52b+c), aún queda agua en el matraz. Agregue otra porción de agente secante y arremolínelo.
- Una solución se acerca a la sequedad cuando se notan partículas finas que no se adhieren a otras partículas (Figura 4.52a+c) o al vidrio cuando se arremolinan (Figura 4.53a). Una solución orgánica húmeda puede ser turbia, y una seca siempre es transparente.
- Si se usa anhidra\(\ce{Na_2SO_4}\), deje que la solución se asiente durante al menos 5 minutos antes de declararla seca, ya que este reactivo tarda tiempo en funcionar.


- Cuando la solución esté seca, separe el agente secante de la solución:
- Si usa\(\ce{Na_2SO_4}\),\(\ce{CaCl_2}\) pellets o\(\ce{CaSO_4}\) rocas, decanta cuidadosamente la solución en un matraz de fondo redondo de tamaño apropiado (Figura 4.53b), asegurándose de llenar el matraz no más de la mitad. Recordatorio: se debe obtener una masa del matraz vacío si el disolvente se evaporará en el evaporador rotatorio.
- Si se usa\(\ce{MgSO_4}\), filtre por gravedad la solución en un matraz de fondo redondo de tamaño apropiado (Figura 4.53c). Al verter, deje atrás el sólido el mayor tiempo posible (esencialmente decantar la solución, pero en el embudo forrado con papel de filtro). El sólido puede ralentizar el drenaje en el papel de filtro.
- Con todos los agentes secantes, enjuague el agente secante (en el matraz y en el embudo de filtro) con un poco\(\text{mL}\) de disolvente orgánico fresco, y agregue el enjuague al matraz de fondo redondo (Figura 4.53d). Retirar el disolvente usando un evaporador rotatorio.
\(^4\)A. Seidell, Solubilidades de Sustancias Inorgánicas y Orgánicas, D. Van Nostrand Company, 1907.
\(^5\)Al evaluar el resultado de una prueba de papel tornasol, observe el centro de la gota. El centro es el punto más concentrado, y es posible que no se vea un cambio de color en el exterior donde la solución se haya esparcido y diluido. Cualquier rosa que se vea en papel tornasol azul significa que la solución es ácida.
\(^6\)De: Fsensiden, Fsensiden, Feist, Técnicas de Laboratorio Orgánico, 3\(^\text{th}\) ed., Brooks-Cole, 2001.
\(^7\)De: Fsensiden, Fsensiden, Feist, Técnicas de Laboratorio Orgánico, 3\(^\text{th}\) ed., Brooks-Cole, 2001.
\(^8\)La Drierita Azul es cara, por lo que se usa comúnmente mezclándola junto con Drierita blanca (\(\ce{CaSO_4}\)sin el indicador de cobalto). La drierita rosa (húmeda) se puede secar extendiéndola sobre una copa de reloj y secándola en un\(110^\text{o} \text{C}\) horno durante la noche.
\(^9\)Gramos de agua por gramo de valores de desecante son de: J. A. Dean, Langie's Handbook of Chemistry, 15\(^\text{th}\) ed., McGraw-Hill, 1999, Secc. 11.2. \(\ce{CaCl_2}\)valor se cotiza para la formación de\(\ce{CaCl_2} \cdot 2 \ce{H_2O}\).


