20.4: Aminas y amidas
- Page ID
- 75194
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Describir la estructura y propiedades de una amina
- Describir la estructura y propiedades de una amida
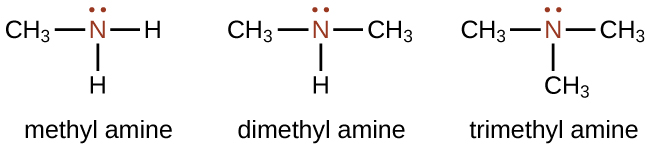
Las aminas son moléculas que contienen enlaces carbono-nitrógeno. El átomo de nitrógeno en una amina tiene un par solitario de electrones y tres enlaces a otros átomos, ya sea carbono o hidrógeno. Se utilizan varias nomenclaturas para derivar nombres para aminas, pero todas involucran el sufijo de identificación de clases —ine como se ilustra aquí para algunos ejemplos simples:
El material genético para todos los seres vivos es un polímero de cuatro moléculas diferentes, que en sí mismas son una combinación de tres subunidades. La información genética, el código para desarrollar un organismo, está contenida en la secuencia específica de las cuatro moléculas, similar a la forma en que se pueden secuenciar las letras del alfabeto para formar palabras que transmiten información. La información en una secuencia de ADN se utiliza para formar otros dos tipos de polímeros, uno de los cuales son proteínas. Las proteínas interactúan para formar un tipo específico de organismo con características individuales.
Una molécula genética se llama ADN, que significa ácido desoxirribonucleico. Las cuatro moléculas que componen el ADN se llaman nucleótidos. Cada nucleótido consiste en una molécula de anillo simple o doble que contiene nitrógeno, carbono, oxígeno e hidrógeno llamada base nitrogenada. Cada base está unida a un azúcar de cinco carbonos llamado desoxirribosa. El azúcar a su vez se une a un grupo fosfato\(\ce{(−PO4^3- )}\) Cuando se elabora nuevo ADN, se produce una reacción de polimerización que une el grupo fosfato de un nucleótido al grupo azúcar de un segundo nucleótido. Las bases nitrogenadas de cada nucleótido sobresalgan de esta cadena principal de azúcar-fosfato. En realidad, el ADN se forma a partir de dos de estos polímeros enrollados uno alrededor del otro y mantenidos unidos por enlaces de hidrógeno entre las bases nitrogenadas. Así, las dos cadenas principales están en el exterior del par de hebras enrolladas, y las bases están en el interior. La forma de los dos hilos enrollados uno alrededor del otro se llama doble hélice (Figura\(\PageIndex{2}\)).
Probablemente tenga sentido que la secuencia de nucleótidos en el ADN de un gato difiera de las de un perro. Pero también es cierto que las secuencias del ADN en las células de dos pugs individuales difieren. De igual manera, las secuencias de ADN en usted y un hermano difieren (a menos que su hermano sea un gemelo idéntico), al igual que las que existen entre usted y un individuo no relacionado. Sin embargo, las secuencias de ADN de dos individuos relacionados son más similares que las secuencias de dos individuos no relacionados, y estas similitudes en la secuencia se pueden observar de diversas maneras. Este es el principio detrás de la toma de huellas de ADN, que es un método utilizado para determinar si dos muestras de ADN provinieron de individuos relacionados (o iguales) o de individuos no relacionados.
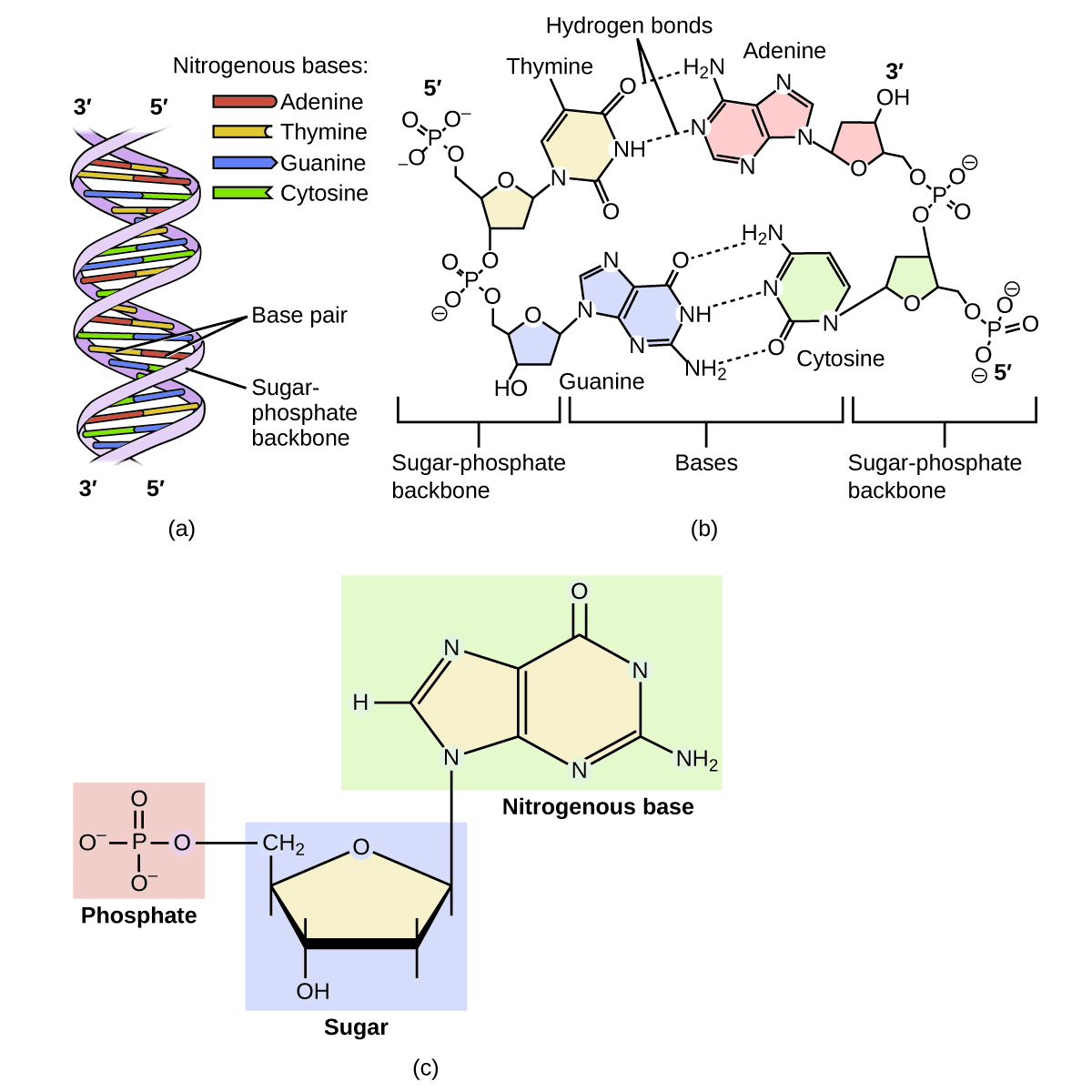
Utilizando similitudes en secuencias, los técnicos pueden determinar si un hombre es padre de un niño (la identidad de la madre rara vez está en duda, excepto en el caso de un hijo adoptado y una posible madre biológica). De igual manera, los genetistas forenses pueden determinar si una muestra de tejido humano en la escena del crimen, como sangre o células de la piel, contiene ADN que coincide exactamente con el ADN de un sospechoso.
Al igual que el amoníaco, las aminas son bases débiles debido al único par de electrones en sus átomos de nitrógeno:
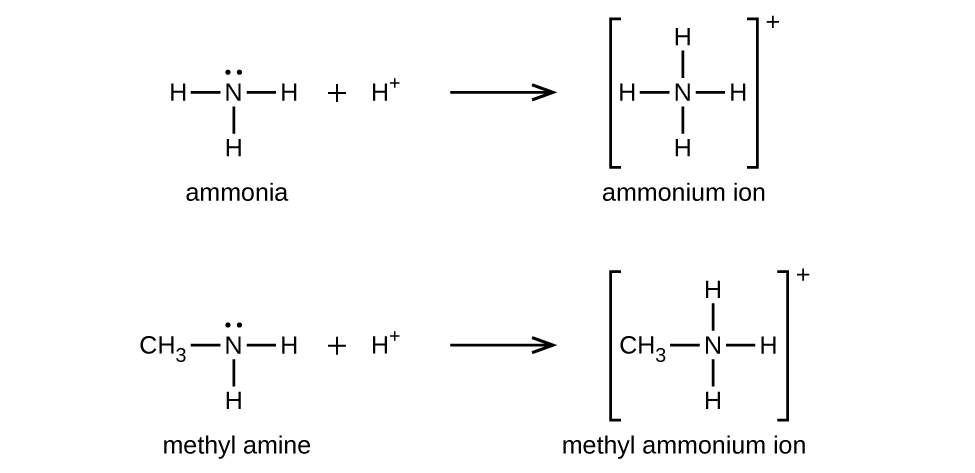
La basicidad del átomo de nitrógeno de una amina juega un papel importante en gran parte de la química del compuesto. Los grupos funcionales amina se encuentran en una amplia variedad de compuestos, incluyendo tintes naturales y sintéticos, polímeros, vitaminas y medicamentos como la penicilina y la codeína. También se encuentran en muchas moléculas esenciales para la vida, como aminoácidos, hormonas, neurotransmisores y ADN.
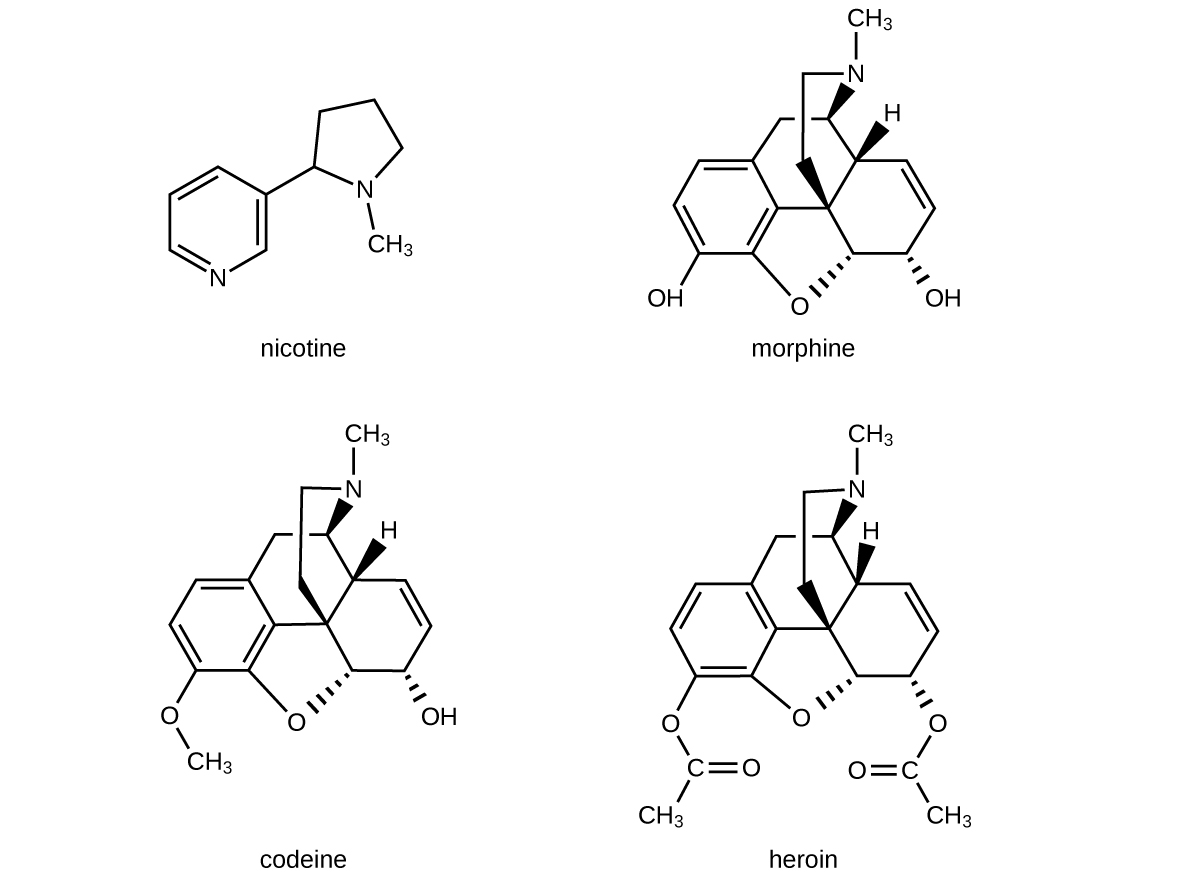
Alcaloides Adictivos
Desde la antigüedad, las plantas se han utilizado con fines medicinales. Se ha aislado una clase de sustancias, llamadas alcaloides, que se encuentran en muchas de estas plantas y se ha encontrado que contienen moléculas cíclicas con un grupo funcional amina. Estas aminas son bases. Pueden reaccionar con H 3 O + en un ácido diluido para formar una sal de amonio, y esta propiedad se utiliza para extraerlos de la planta:
\[\ce{R3N + H3O+ + Cl- ⟶[R3NH+]Cl- + H2O} \nonumber \]
El nombre alcaloide significa “como un álcali”. Así, un alcaloide reacciona con el ácido. El compuesto libre se puede recuperar después de la extracción por reacción con una base:
\[\ce{[R3NH+]Cl- + OH- ⟶R3N + H2O + Cl-} \nonumber \]
Las estructuras de muchos alcaloides naturales tienen profundos efectos fisiológicos y psicotrópicos en humanos. Ejemplos de estos fármacos incluyen nicotina, morfina, codeína y heroína. La planta produce estas sustancias, llamadas colectivamente compuestos vegetales secundarios, como defensas químicas contra las numerosas plagas que intentan alimentarse de la planta:

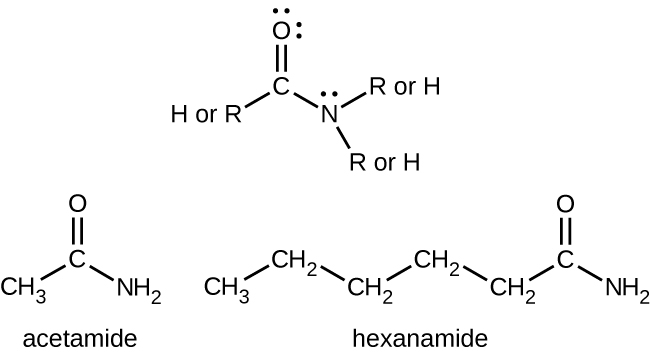
Las amidas son moléculas que contienen átomos de nitrógeno conectados al átomo de carbono de un grupo carbonilo. Al igual que las aminas, se pueden usar varias reglas de nomenclatura para nombrar amidas, pero todas incluyen el uso del sufijo específico de clase -amida:
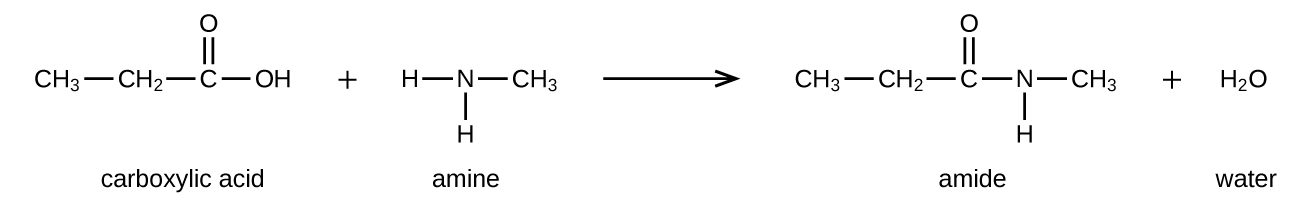
Las amidas se pueden producir cuando los ácidos carboxílicos reaccionan con aminas o amoníaco en un proceso llamado amidación. Se elimina una molécula de agua de la reacción, y la amida se forma a partir de los trozos restantes del ácido carboxílico y la amina (nótese la similitud con la formación de un éster a partir de un ácido carboxílico y un alcohol discutidos en la sección anterior):
La reacción entre aminas y ácidos carboxílicos para formar amidas es biológicamente importante. Es a través de esta reacción que los aminoácidos (moléculas que contienen sustituyentes amina y ácido carboxílico) se unen en un polímero para formar proteínas.
Proteínas y enzimas
Las proteínas son moléculas biológicas grandes compuestas por cadenas largas de moléculas más pequeñas llamadas aminoácidos. Los organismos dependen de las proteínas para una variedad de funciones: las proteínas transportan moléculas a través de las membranas celulares, replican el ADN y catalizan reacciones metabólicas, por nombrar solo algunas de sus funciones. Las propiedades de las proteínas son funciones de la combinación de aminoácidos que las componen y pueden variar mucho. Las interacciones entre secuencias de aminoácidos en las cadenas de proteínas dan como resultado el plegamiento de la cadena en estructuras tridimensionales específicas que determinan la actividad de la proteína.
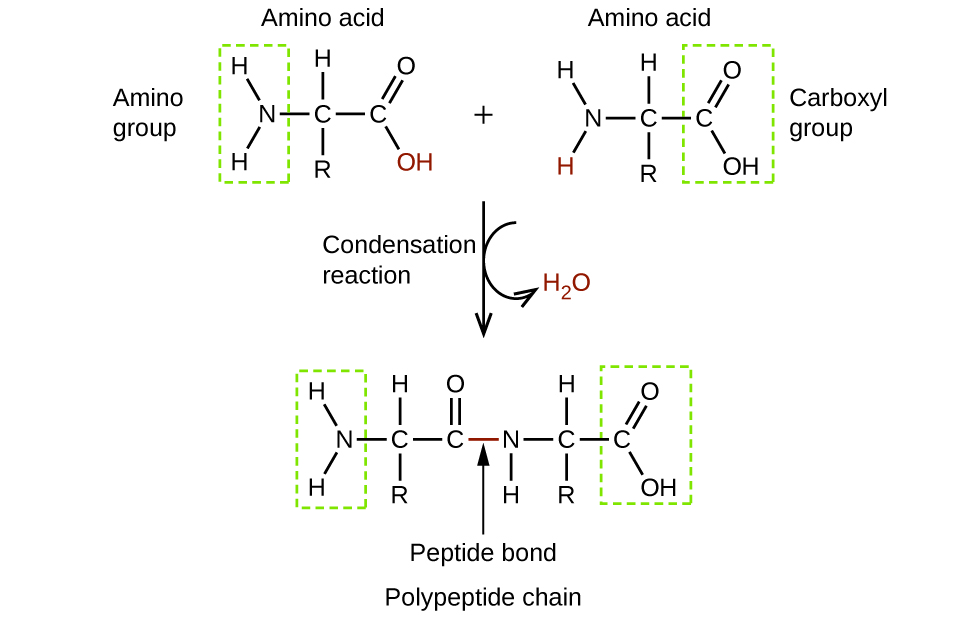
Los aminoácidos son moléculas orgánicas que contienen un grupo funcional amina (-NH 2), un grupo funcional ácido carboxílico (—COOH) y una cadena lateral (que es específica para cada aminoácido individual). La mayoría de los seres vivos construyen proteínas a partir de los mismos 20 aminoácidos diferentes. Los aminoácidos se conectan por la formación de un enlace peptídico, que es un enlace covalente formado entre dos aminoácidos cuando el grupo ácido carboxílico de un aminoácido reacciona con el grupo amina del otro aminoácido. La formación del enlace da como resultado la producción de una molécula de agua (en general, las reacciones que resultan en la producción de agua cuando otras dos moléculas se combinan se denominan reacciones de condensación). El enlace resultante entre el átomo de carbono del grupo carbonilo y el átomo de nitrógeno de la amina se denomina enlace peptídico o enlace peptídico. Dado que cada uno de los aminoácidos originales tiene un grupo sin reaccionar (uno tiene una amina sin reaccionar y el otro un ácido carboxílico sin reaccionar), se pueden formar más enlaces peptídicos a otros aminoácidos, extendiendo la estructura. (Figura\(\PageIndex{4}\)) Una cadena de aminoácidos conectados se denomina polipéptido. Las proteínas contienen al menos una cadena polipeptídica larga.
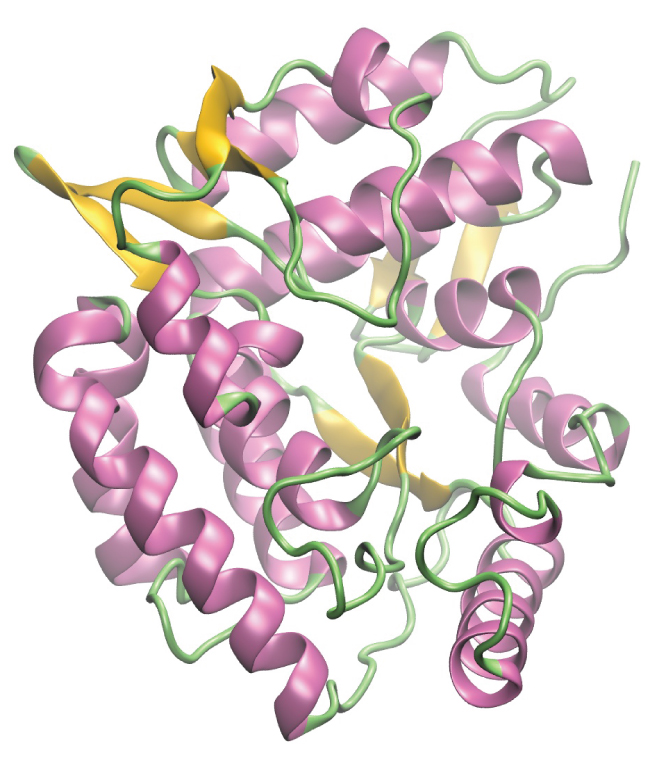
Las enzimas son grandes moléculas biológicas, en su mayoría compuestas por proteínas, las cuales son responsables de los miles de procesos metabólicos que ocurren en los organismos vivos. Las enzimas son catalizadores altamente específicos; aceleran las tasas de ciertas reacciones. Las enzimas funcionan disminuyendo la energía de activación de la reacción que están catalizando, lo que puede aumentar drásticamente la velocidad de la reacción. La mayoría de las reacciones catalizadas por enzimas tienen tasas que son millones de veces más rápidas que la versión no catalizada. Como todos los catalizadores, las enzimas no se consumen durante las reacciones que catalizan. Las enzimas sí difieren de otros catalizadores en lo específicas que son para sus sustratos (las moléculas que una enzima convertirá en un producto diferente). Cada enzima sólo es capaz de acelerar una o unas pocas reacciones o tipos de reacciones muy específicas. Dado que la función de las enzimas es tan específica, la falta o mal funcionamiento de una enzima puede llevar a graves consecuencias para la salud. Una enfermedad que es resultado de un mal funcionamiento enzimático es la fenilcetonuria. En esta enfermedad, la enzima que cataliza el primer paso en la degradación del aminoácido fenilalanina no es funcional (Figura\(\PageIndex{5}\)). Sin tratar, esto puede llevar a una acumulación de fenilalanina, lo que puede conducir a discapacidades intelectuales.
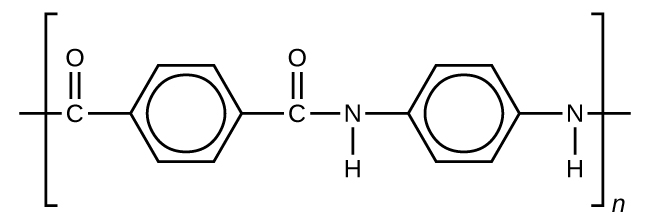
Kevlar
Kevlar (Figura\(\PageIndex{6}\)) es un polímero sintético hecho de dos monómeros 1,4-fenileno-diamina y cloruro de tereftaloilo (Kevlar es una marca registrada de DuPont). El primer uso comercial de Kevlar fue como reemplazo del acero en llantas de carreras. El kevlar es típicamente hilado en cuerdas o fibras. El material tiene una alta relación resistencia/peso a la tracción (es aproximadamente 5 veces más fuerte que un peso igual de acero), lo que lo hace útil para muchas aplicaciones, desde llantas de bicicleta hasta velas y armaduras corporales.
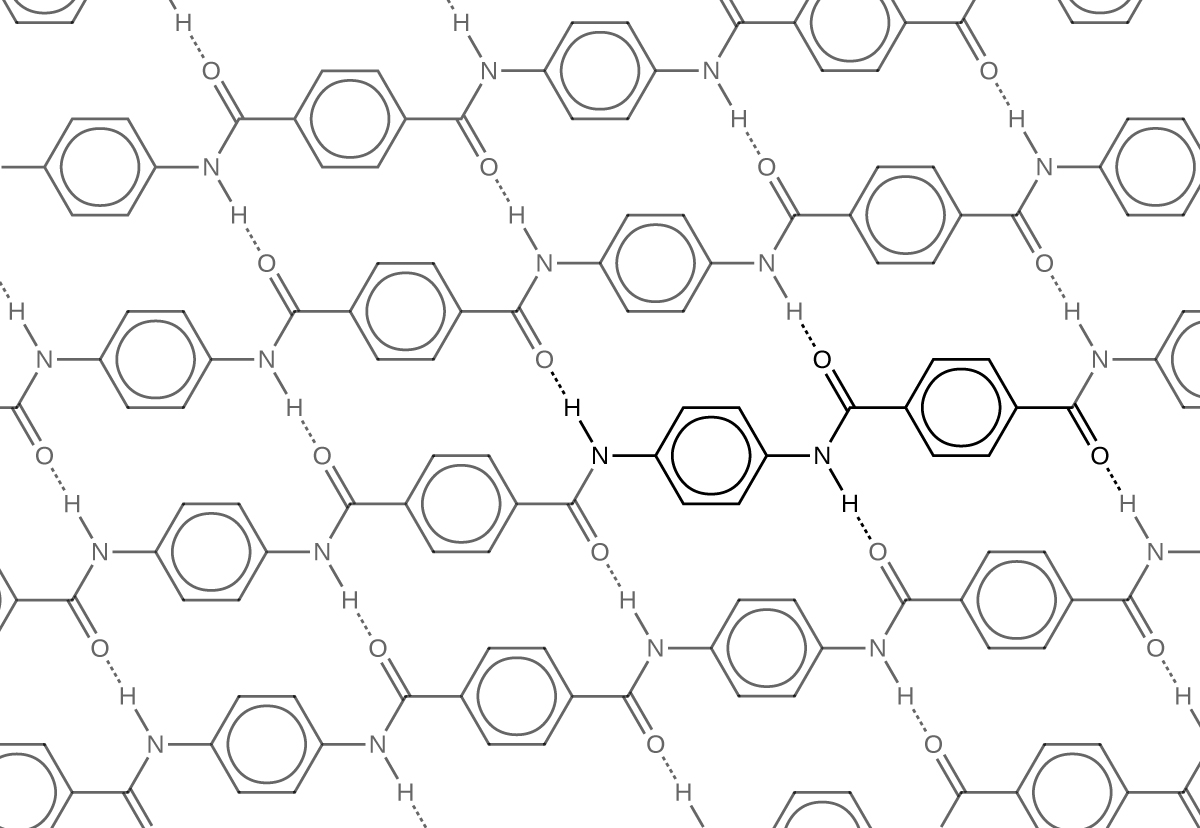
El material debe gran parte de su fuerza a los enlaces de hidrógeno entre cadenas poliméricas (refiérase al capítulo sobre interacciones intermoleculares). Estos enlaces se forman entre el átomo de oxígeno del grupo carbonilo (que tiene una carga negativa parcial debido a la electronegatividad del oxígeno) en un monómero y el átomo de hidrógeno parcialmente cargado positivamente en el enlace N-H de un monómero adyacente en la estructura polimérica (líneas discontinuas en la Figura\(\PageIndex{7}\)). Hay fuerza adicional derivada de la interacción entre los orbitales p no hibridados en los anillos de seis miembros, llamado apilamiento aromático.
El kevlar puede ser mejor conocido como un componente de la armadura corporal, los cascos de combate y las máscaras faciales. Desde la década de 1980, el ejército estadounidense ha utilizado el Kevlar como componente del casco y chaleco PASGT (sistema de armadura personal para tropas terrestres). El kevlar también se utiliza para proteger vehículos blindados de combate y portaaviones. Las aplicaciones civiles incluyen equipo de protección para el personal del servicio de emergencia, como blindaje corporal para oficiales de policía y ropa resistente al calor para bomberos. La ropa a base de kevlar es considerablemente más liviana y delgada que el equipo equivalente hecho de otros materiales (Figura\(\PageIndex{8}\)).

Además de sus usos más conocidos, el Kevlar también se usa a menudo en criogénicos por su muy baja conductividad térmica (junto con su alta resistencia). El Kevlar mantiene su alta resistencia cuando se enfría a la temperatura del nitrógeno líquido (—196 °C).
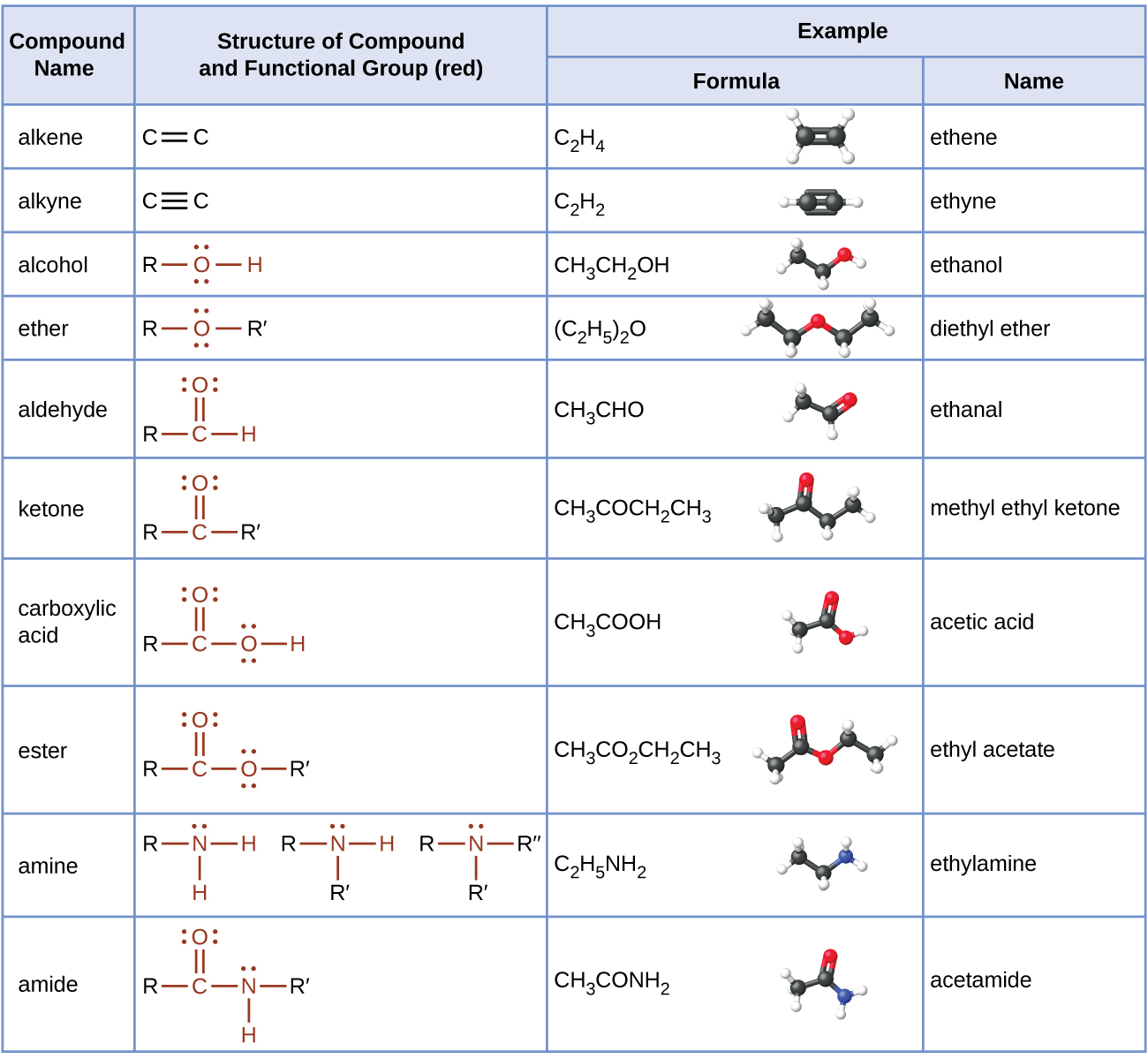
La tabla aquí resume las estructuras discutidas en este capítulo:
Resumen
La adición de nitrógeno a una estructura orgánica conduce a dos familias de moléculas. Los compuestos que contienen un átomo de nitrógeno unido en una estructura hidrocarbonada se clasifican como aminas. Los compuestos que tienen un átomo de nitrógeno unido a un lado de un grupo carbonilo se clasifican como amidas. Las aminas son un grupo funcional básico. Las aminas y los ácidos carboxílicos se pueden combinar en una reacción de condensación para formar amidas.
Glosario
- amina
- molécula orgánica en la que un átomo de nitrógeno está unido a uno o más grupos alquilo
- amida
- molécula orgánica que presenta un átomo de nitrógeno conectado al átomo de carbono en un grupo carbonilo


