3.3: Adhesión química
- Page ID
- 55731
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Cuando piensas en unir, puede que no pienses en iones. Como la mayoría de nosotros, probablemente pienses en la vinculación entre las personas. Al igual que las personas, las moléculas se unen —y algunos vínculos son más fuertes que otros. ¡Es difícil romper una madre y un bebé, o una molécula compuesta por un oxígeno y dos átomos de hidrógeno! Un enlace químico es una fuerza de atracción entre átomos o iones. Los enlaces se forman cuando los átomos comparten o transfieren electrones de valencia. Los electrones de valencia son los electrones en el nivel de energía externa de un átomo que pueden estar involucrados en interacciones químicas. Los electrones de valencia son la base de todos los enlaces químicos.

Por qué se forman los bonos
Para entender por qué se forman los enlaces químicos, considere el compuesto común conocido como agua, o H 2 O. Consta de dos átomos de hidrógeno (H) y un átomo de oxígeno (O). Como se puede ver en el lado izquierdo de la Figura de\(\PageIndex{2}\) abajo, cada átomo de hidrógeno tiene sólo un electrón, que es también su único electrón de valencia. El átomo de oxígeno tiene seis electrones de valencia. Estos son los electrones en el nivel de energía exterior del átomo de oxígeno.

En la molécula de agua de la derecha en la Figura\(\PageIndex{2}\), cada átomo de hidrógeno comparte un par de electrones con el átomo de oxígeno. Al compartir electrones, cada átomo tiene electrones disponibles para llenar su nivel de energía único o externo. Los átomos de hidrógeno tienen cada uno un par de electrones compartidos, por lo que su primer y único nivel de energía está lleno. El átomo de oxígeno tiene un total de ocho electrones de valencia, por lo que su nivel de energía exterior está lleno. Un nivel de energía exterior completo es la disposición de electrones más estable posible. Explica por qué los elementos forman enlaces químicos entre sí.
Tipos de enlaces químicos
No todos los enlaces químicos se forman de la misma manera que los enlaces en el agua. En realidad, hay cuatro tipos diferentes de enlaces químicos que discutiremos aquí son covalentes no polares, covalentes polares, hidrógeno y enlaces iónicos. A continuación se describe cada tipo de enlace.
Enlaces covalentes no polares
Para el metano (CH 4) en la Figura\(\PageIndex{3}\), el átomo de carbono (con cuatro electrones en su capa de energía de valencia más externa) comparte un solo electrón de cada uno de los cuatro hidrógenos. El hidrógeno tiene un electrón de valencia en su primera capa de energía. El enlace covalente es prevalente en compuestos orgánicos. De hecho, ¡tu cuerpo se mantiene unido por electrones compartidos por carbonos e hidrógenos! Los electrones son igualmente compartidos en todas las direcciones; por lo tanto, este tipo de enlace covalente se denomina no polar.
Enlaces covalentes polares y enlaces de hidrógeno
Un enlace covalente es la fuerza de atracción que mantiene unidos dos átomos no metálicos que comparten un par de electrones. Un electrón es proporcionado por cada átomo, y el par de electrones es atraído por los núcleos positivos de ambos átomos. La molécula de agua representada en la Figura\(\PageIndex{4}\) contiene enlaces covalentes polares.
La fuerza de atracción entre las moléculas de agua es una interacción dipolo. Los átomos de hidrógeno están unidos al átomo de oxígeno altamente electronegativo (que también posee dos conjuntos de electrones de pares solitarios, lo que crea un enlace muy polar. El átomo de hidrógeno parcialmente positivo de una molécula es entonces atraído hacia el átomo de oxígeno parcialmente negativo de una molécula de agua cercana como se muestra en la Figura\(\PageIndex{4}\)).
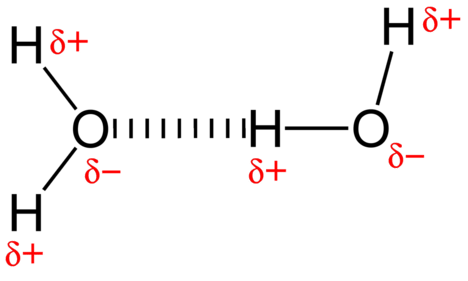
Un enlace de hidrógeno es una fuerza de atracción intermolecular e intramolecular en la que un átomo de hidrógeno que está unido covalentemente a un átomo altamente electronegativo es atraído a un par solitario de electrones en un átomo o un átomo parcialmente negativo en una molécula polar vecina. Los enlaces de hidrógeno también se encuentran intramolecularmente en las estructuras terciarias y cuaternarias de las cadenas de proteínas y ADN.
Los enlaces de hidrógeno se producen solo en moléculas donde el hidrógeno está unido covalentemente a uno de tres elementos: flúor, oxígeno o nitrógeno. Estos tres elementos son tan electronegativos que retiran la mayor parte de la densidad electrónica en el enlace covalente con hidrógeno, dejando al átomo de H muy deficiente en electrones. El átomo H casi actúa como un protón desnudo, dejándolo muy atraído por electrones de pares solitarios en un átomo cercano.
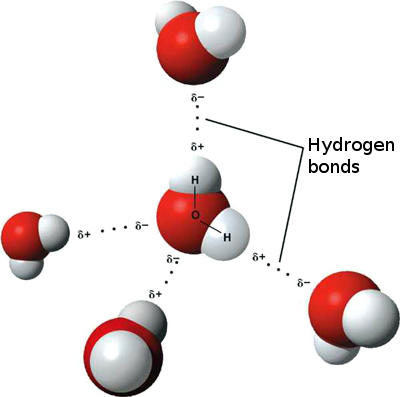
El enlace de hidrógeno que se produce en el agua conduce a algunas propiedades inusuales, pero muy importantes. La mayoría de los compuestos moleculares que tienen una masa similar al agua son gases a temperatura ambiente. Debido a los fuertes enlaces de hidrógeno, las moléculas de agua pueden permanecer condensadas en estado líquido. La figura\(\PageIndex{5}\) muestra cómo la forma doblada y dos átomos de hidrógeno por molécula permiten que cada molécula de agua pueda unirse por hidrógeno a otras dos moléculas.
En estado líquido, los enlaces de hidrógeno del agua pueden romperse y reformarse a medida que las moléculas fluyen de un lugar a otro. Cuando se enfría el agua, las moléculas comienzan a disminuir la velocidad. Eventualmente, cuando el agua se congela en hielo, los enlaces de hidrógeno forman una red muy específica que se muestra en el lado derecho de la Figura\(\PageIndex{6}\). Cuando el agua es líquida, las moléculas son más móviles y no producen esta estructura rígida.

Enlaces iónicos
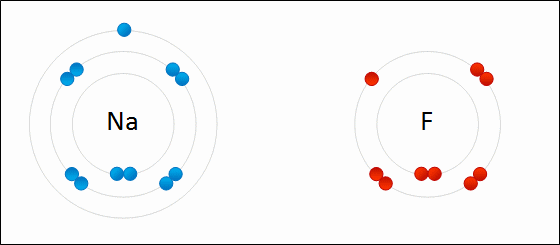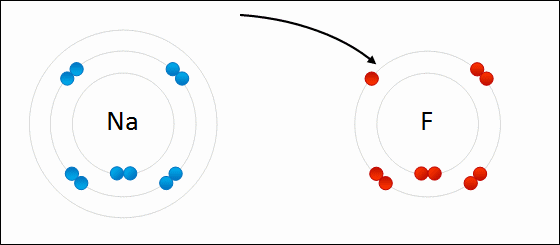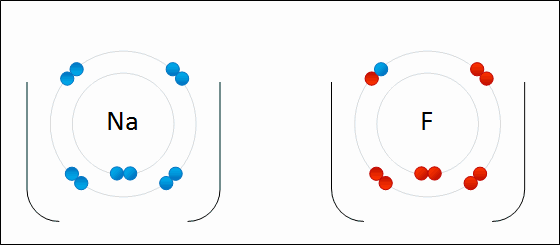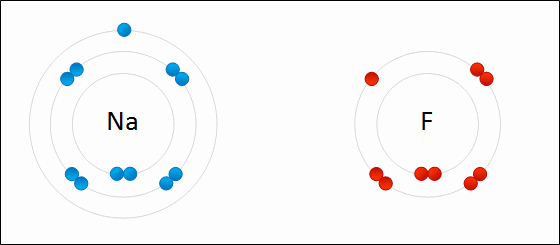
Los electrones se transfieren entre átomos. Un ion dará uno o más electrones a otro ion. La sal de mesa, cloruro de sodio (NaCl), es un ejemplo común de un compuesto iónico. Obsérvese que el sodio está en el lado izquierdo de la tabla periódica y que el cloro está en el lado derecho de la tabla periódica. En la Figura\(\PageIndex{7}\), un átomo de litio dona un electrón a un átomo de flúor para formar un compuesto iónico. Esto sucede para llenar por completo su caparazón de valencia más exterior. La transferencia del electrón da al ion litio una carga neta de +1, y al ion flúor una carga neta de -1. Estos iones se unen porque experimentan una fuerza atractiva debido a la diferencia en señal de sus cargas.
Revisar
- ¿En qué se diferencia un enlace covalente de un enlace iónico?
- ¿Por qué un enlace de hidrógeno es un enlace relativamente débil?
- Diagrama de la polaridad de una molécula de agua.
- ¿Qué es un enlace químico?
- Explique por qué los átomos de hidrógeno y oxígeno son más estables cuando forman enlaces en una molécula de agua.
- ¿Cuántos electrones de valencia tiene el sodio? ¿Cuántos electrones de valencia tiene el cloro? ¿Cómo se une un átomo de cloro con el sodio? ¿Cuál es la carga de un ion de sodio? ¿Qué pasa con el ion cloro?
- ¿Cuándo ocurre el enlace covalente? ¿Cómo funciona?
- ¿Cuántos electrones de valencia tiene el oxígeno?
Atribuciones
- Madre e hija por Lyd235, CC BY-SA 4.0 vía Wikimedia Commons
- Molécula de agua por CNX OpenStax, licencia CC BY 4.0 vía Wikimedia Commons
- Enlace covalente por DynaBlast, con licencia CC BY-SA 2.5 vía Wikimedia Commons
- Enlace de hidrógeno en agua, dominio público vía Wikimedia Commons
- Modelo 3D de enlaces de hidrógeno de Michal Maňas, dominio público vía Wikimedia Commons
- Agua líquida y hielo por P99am, CC BY-SA 3.0 vía Wikimedia Commons
- NaF por Wdcf, CC BY-SA 3.0 vía Wikimedia Commons
- Texto adaptado de Biología Humana por CK-12 licenciado CC BY-NC 3.0


