10.1: Las fuerzas intermoleculares
- Page ID
- 1877
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)habilidades para desarrollar
- Describir los tipos de las fuerzas intermoleculares posibles entre átomos o moléculas en fases condensadas (fuerzas de dispersión, atracciones dipolo-dipolo y enlaces de hidrógeno)
- Identificar los tipos de fuerzas intermoleculares experimentadas por moléculas específicas en función de sus estructuras.
- Explicar la relación entre las fuerzas intermoleculares presentes dentro de una sustancia y las temperaturas asociadas con los cambios en su estado físico.
Como fue en el caso de las sustancias gaseosas, la teoría cinética molecular se puede usar para explicar el comportamiento de los sólidos y los líquidos. En la siguiente descripción, el término partícula se usará para referirse a un átomo, molécula o ion. Tenga en cuenta que usaremos la frase popular "atracción intermolecular" para referirnos a las fuerzas de atracción entre las partículas de una sustancia, independientemente de si estas partículas son moléculas, átomos o iones.
Considere estos dos aspectos de los entornos de nivel molecular en materia sólida, líquida y gaseosa:
- A veces las partículas en un sólido están compactas y dispuestas en un patrón regular; en un líquido, están muy juntos sin disposición regular; en un gas, están muy separados sin un arreglo regular.
- Las partículas en un sólido vibran sobre posiciones fijas y generalmente no se mueven en relación entre sí; en un líquido, se mueven entre sí pero permanecen en contacto esencialmente constante; en un gas, se mueven independientemente uno del otro, excepto cuando chocan.
Las diferencias en las propiedades de un sólido, líquido o gas reflejan las fuerzas de atracción entre los átomos, las moléculas o los iones que forman cada fase. La fase en la que existe una sustancia depende de la extensión relativa de sus fuerzas intermoleculares (IMF) y de las energías cinéticas (KE) de sus moléculas. Los FMI son las diversas fuerzas de atracción que pueden existir entre los átomos y las moléculas de una sustancia debido a los fenómenos electrostáticos, como se detallará en este módulo. Estas fuerzas sirven para mantener las partículas juntas, mientras que el KE de las partículas proporciona la energía necesaria para superar las fuerzas de atracción y, por lo tanto, aumentar la distancia entre las partículas. La Figura \(\PageIndex{1}\) ilustra cómo se pueden inducir cambios en el estado físico al cambiar la temperatura, por lo tanto, el KE promedio de una sustancia dada.

Como ejemplo de los procesos representados en esta figura, considere una muestra de agua. Cuando el agua gaseosa se enfría lo suficiente, las atracciones entre las moléculas de H2O serán capaces de mantener las moléculas juntas cuando entren en contacto entre sí; el gas se condensa, formando H2O líquido. Por ejemplo, se forma el agua líquida en el exterior de un vaso frío a medida que el vapor de agua en el aire es enfriado por el vaso frío, como se ve en la Figura \(\PageIndex{2}\).

También podemos licuar muchos gases por comprimiéndolos, si la temperatura no es demasiado alta. La presión más alta hace que las moléculas de un gas se acercan, de modo que las atracciones entre las moléculas se vuelven fuertes en relación con su KE. En consecuencia, forman líquidos. El butano, C4H10, es el combustible usado en encendedores desechables y es un gas a temperatura y presión estándar. Dentro del compartimiento de combustible del encendedor, el butano se comprime a una presión que resulta en su condensación al estado líquido, como se muestra en la Figura \(\PageIndex{3}\).

Finalmente, si la temperatura de un líquido se vuelve suficientemente baja, o la presión sobre el líquido se vuelve lo suficientemente alta, las moléculas del líquido ya no tienen suficiente KE para superar el FMI entre ellas, y se forma un sólido. En un módulo posterior de este capítulo se proporciona una discusión más exhaustiva de estos y otros cambios de estado o transiciones de fase.
Fuerzas entre moléculas
En condiciones apropiadas, las atracciones entre todas las moléculas de gas harán que formen líquidos o sólidos. Esto se debe a fuerzas intermoleculares, no a fuerzas intramoleculares. Las fuerzas intramoleculares son aquellas dentro de la molécula que mantienen la molécula unida, por ejemplo, los enlaces entre los átomos. Las fuerzas intermoleculares son las atracciones entre las moléculas, que determinan muchas de las propiedades físicas de una sustancia. La figura \(\PageIndex{4}\) ilustra estas diferentes fuerzas moleculares. Estas fuerzas atractivas varían ampliamente, aunque generalmente los FMI entre moléculas pequeñas son débiles en comparación con las fuerzas intramoleculares que unen átomos dentro de una molécula. Por ejemplo, para superar los FMI en un mol de HCl líquido y convertirlo en HCl gaseoso, solo se necesitan unos 17 kilojulios. Sin embargo, para romper los enlaces covalentes entre los átomos de hidrógeno y cloro en un mol de HCl se requiere aproximadamente 25 veces más energía: 430 kilojulios.
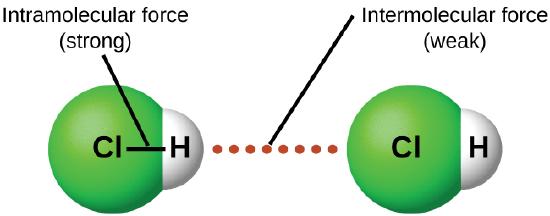
Todas las fuerzas atractivas entre los átomos neutros y las moléculas se conocen como las fuerzas de van der Waals, aunque generalmente se conocen de manera más informal como las atracciones intermoleculares. Consideraremos los diversos tipos de FMI en las próximas tres secciones de este módulo.
Las fuerzas de dispersión
Una de las tres fuerzas de van der Waals está presente en todas las fases condensadas, independientemente del carácter de los átomos o moléculas que componen la sustancia. Esta fuerza atractiva se llama la fuerza de dispersión de Londres en honor del físico estadounidense de origen alemán Fritz London, quien, en 1928, lo explicó por primera vez. A veces, esta fuerza se conoce simplemente como la fuerza de dispersión. Debido a que los electrones de un átomo o molécula están en constante movimiento (o, alternativamente, la ubicación del electrón está sujeta a la variabilidad mecánica cuántica), en cualquier momento, un átomo o molécula puede desarrollar un dipolo instantáneo temporal si sus electrones están distribuidos asimétricamente. La presencia de este dipolo puede distorsionar los electrones de un átomo o molécula que está cerca, produciendo un dipolo inducido. Estos dos dipolos temporales que fluctúan rápidamente dan como resultado una atracción electrostática relativamente débil entre las especies, una fuerza de dispersión como la que se ilustra en la Figura \(\PageIndex{5}\).
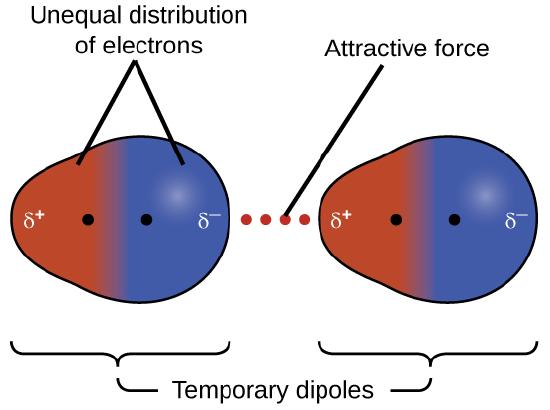
Las fuerzas de dispersión que se desarrollan entre los átomos en diferentes moléculas pueden atraer las dos moléculas entre sí. Sin embargo, las fuerzas son relativamente débiles y se vuelven significativas solo cuando las moléculas están muy cerca. Los átomos y moléculas más grandes y pesadas exhiben fuerzas de dispersión más fuertes que los átomos y moléculas más pequeñas y livianas. F2 y Cl2 son gases a temperatura ambiente (que reflejan fuerzas de atracción más débiles); Br2 es un líquido e I2 es un sólido (que refleja fuerzas de atracción más fuertes). Las tendencias en los puntos de fusión y ebullición observados para los halógenos demuestran claramente este efecto, como se ve en la Tabla \(\PageIndex{1}\).
| Halógeno | Masa Molar | Radio Atómico | Punto de Fusión | Punto de Ebullición |
|---|---|---|---|---|
| flúor, F2 | 38 g/mol | 72 pm | 53 K | 85 K |
| cloro, Cl2 | 71 g/mol | 99 pm | 172 K | 238 K |
| bromo, Br2 | 160 g/mol | 114 pm | 266 K | 332 K |
| yodo, I2 | 254 g/mol | 133 pm | 387 K | 457 K |
| astatine, At2 | 420 g/mol | 150 pm | 575 K | 610 K |
El aumento de los puntos de fusión y ebullición con el aumento del tamaño atómico/molecular se puede racionalizar considerando cómo la fuerza de las fuerzas de dispersión se ve afectada por la estructura electrónica de los átomos o moléculas en la sustancia. En un átomo más grande, los electrones de valencia están, en promedio, más alejados del núcleo que en un átomo más pequeño. Por lo tanto, están menos apretados y pueden formar más fácilmente los dipolos temporales que producen la atracción. La medida de que fácil o difícil es que otra carga electrostática (por ejemplo, un ion cercano o una molécula polar) distorsione la distribución de carga de una molécula (su nube de electrones) se conoce como la polarización. Se dice que una molécula que tiene una nube de carga que se distorsiona fácilmente es muy polarizable y tendrá grandes fuerzas de dispersión; uno con una nube de carga que es difícil de distorsionar no es muy polarizable y tendrá pequeñas fuerzas de dispersión.
Ejemplo \(\PageIndex{1}\): Las FUERZAS DE LONDRES Y SUS EFECTOS
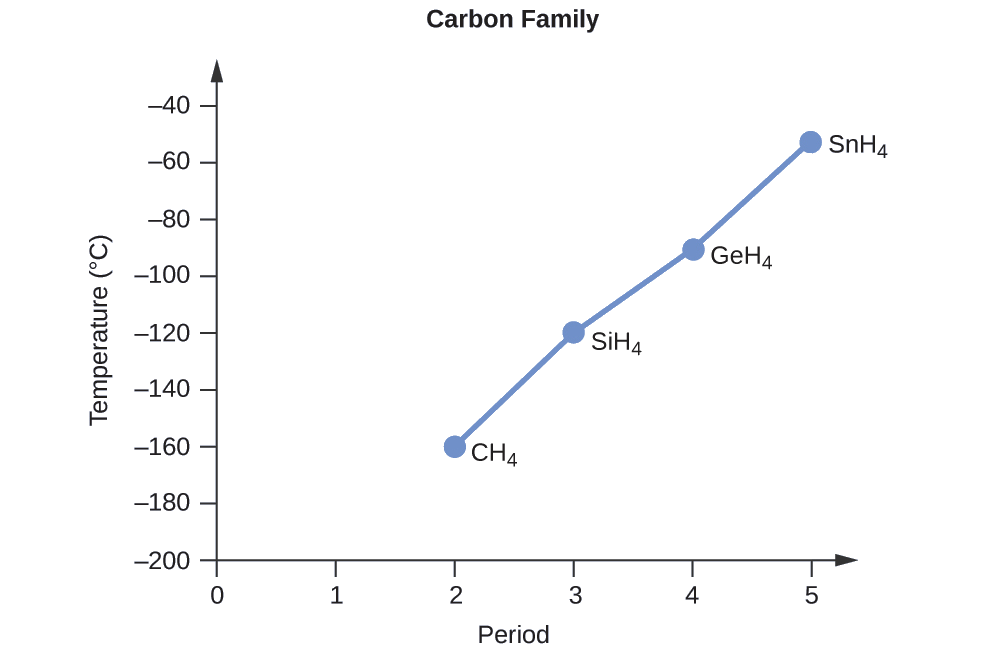
Ordene los siguientes compuestos de un elemento del grupo 14 e hidrógeno del punto de ebullición más bajo al más alto: CH4, SiH4, GeH4, and SnH4. Explique su razonamiento.
Solución
Aplicando las habilidades adquiridas en el capítulo sobre los enlaces químicos y la geometría molecular, se predice que todos estos compuestos son no polares, por lo que pueden experimentar solo fuerzas de dispersión: cuanto más pequeña es la molécula, menos polarizable y más débiles son las fuerzas de dispersión; cuanto mayor es la molécula, mayor es la fuerza de dispersión. Las masas molares de CH4, SiH4, GeH4 y SnH4 son aproximadamente 16 g/mol, 32 g/mol, 77 g/mol y 123 g/mol, respectivamente. Por lo tanto, se espera que CH4 tenga el punto de ebullición más bajo y SnH4 el punto de ebullición más alto. Se espera que el orden del punto de ebullición más bajo al más alto sea
CH4 < SiH4 < GeH4 < SnH4
Una gráfica de los puntos de ebullición real de estos compuestos versus el período de los elementos del grupo 14 muestra que esta predicción es correcta:
Ejercicio \(\PageIndex{1}\)
Ordene los siguientes hidrocarburos del punto de ebullición más bajo al más alto: C2H6, C3H8, y C4H10.
- Respuesta
-
Todos estos compuestos son no polares y solo tienen fuerzas de dispersión de Londres: las moléculas más grandes tienen fuerzas de dispersión mayores y sus puntos de ebullición son más altos. Por lo tanto, el orden del punto de ebullición más bajo al más alto es
C2H6 < C3H8 < C4H10.
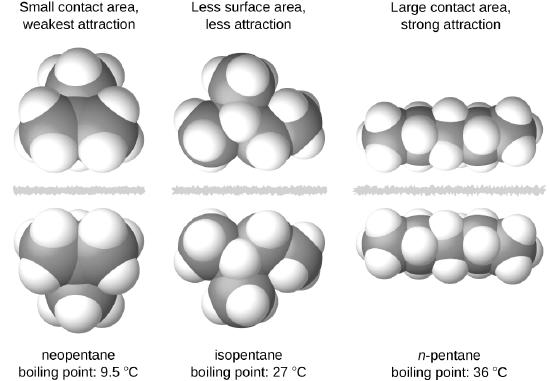
Las formas de las moléculas también afectan las magnitudes de las fuerzas de dispersión entre ellas. Por ejemplo, los puntos de ebullición para los isómeros n-pentano, isopentano y neopentano (que se muestran en la Figura \(\PageIndex{6}\)) son 36 °C, 27 °C y 9.5 °C, respectivamente. Aunque estos compuestos contienen moléculas con la misma fórmula química, C5H12, la diferencia en los puntos de ebullición sugiere que las fuerzas de dispersión en la fase líquida son diferentes, siendo mayores para el n-pentano y menores para el neopentano. La forma alargada del n-pentano proporciona un área de superficie mayor disponible para el contacto entre moléculas, lo que resulta en fuerzas de dispersión correspondientemente más fuertes. La forma más compacta del isopentano ofrece un área superficial más pequeña disponible para el contacto intermolecular y, por lo tanto, fuerzas de dispersión más débiles. Las moléculas del neopentano son las más compactas de las tres y ofrecen la superficie más pequeña disponible para el contacto intermolecular y, por lo tanto, las fuerzas de dispersión más débiles. Este comportamiento es análogo a las conexiones que se pueden formar entre las tiras de los sujetadores de la marca VELCRO: cuanto mayor es el área de contacto de la tira, más fuerte es la conexión.
APLICACIONES: LOS GECOS Y LAS FUERZAS INTERMOLECULARES
Los gecos tienen una sorprendente capacidad de adherirse a la mayoría de las superficies. Pueden atravesar rápidamente a paredes lisas y techos que no tienen topes, y lo hacen sin tener ventosas o una sustancia pegajosa en sus dedos. Un geco puede levantar sus pies fácilmente mientras camina a lo largo de una superficie, si intenta levantarlo, se adhiere a la superficie. ¿Cómo pueden hacer esto los gecos (así como las arañas y algunos otros insectos)? Aunque este fenómeno ha sido investigado durante cientos de años, los científicos descubrieron recientemente los detalles del proceso que permite que las patas de los gecos se comporten de esta manera.

Los dedos de los gecos están cubiertos con cientos de miles de pequeños pelos conocidos como setas, y cada seta, a su vez, se ramifica en cientos de pequeñas puntas triangulares planas llamadas espátulas. El gran número de espátulas en sus setas nos da un geco, que se muestra en la Figura \(\PageIndex{7}\), con una gran área de superficie total para adherirse a una superficie. En 2000, Kellar Autumn, quien guía un equipo de investigación de geckos multiinstitucional, descubrió que los gecos se adhirieron igualmente bien tanto al dióxido de silicio polar como al arseniuro de galio no polar. Esto demostró que los gecos se adhieren a las superficies debido a las fuerzas de dispersión: atracciones intermoleculares débiles que surgen de distribuciones temporales y sincronizadas de carga entre moléculas adyacentes. Aunque las fuerzas de dispersión son muy débiles, la atracción total sobre millones de espátulas es lo suficientemente grande como para soportar muchas veces el peso del geco.
En 2014, dos científicos desarrollaron un modelo para explicar cómo los gecos pueden pasar rápidamente de “pegajosos” a “no pegajosos”. Alex Greaney y Congcong Hu de la Universidad de Oregon State describieron cómo los gecos pueden lograr esto por cambiando el ángulo entre sus espátulas y superficie. Las patas de los gecos, que normalmente no son pegajosas, se vuelven pegajosas cuando se aplica una pequeña fuerza de corte. Al enroscar y desenroscar los dedos de los pies, los gecos pueden alternar entre pegarse y despegarse de una superficie, y así moverse fácilmente a través de ella. Investigaciones adicionales eventualmente pueden conducir al desarrollo de mejores adhesivos y otras aplicaciones.
Mire este vídeo para obtener más información sobre la investigación de Kellar Autumn que determinó que las fuerzas de van der Waals son responsables para la capacidad de un geco para adherirse y escalar.
Atracciones de Dipole-Dipole
Recuerde en el capítulo sobre los enlaces químicos y la geometría molecular que las moléculas polares tienen una carga positiva parcial en un lado y una carga negativa parcial en el otro lado de la molécula, una separación de carga que se llama un dipolo. Considere una molécula polar como el cloruro de hidrógeno, HCl. En la molécula de HCl, el átomo de Cl más electronegativo tiene la carga negativa parcial, mientras que el átomo de H menos electronegativo tiene la carga positiva parcial. Una fuerza atractiva entre las moléculas de HCl resulta de la atracción entre el extremo positivo de una molécula de HCl y el extremo negativo del otra. Esta fuerza atractiva se llama la atracción dipolo-dipolo: la fuerza electrostática entre el extremo parcialmente positivo de una molécula polar y el extremo parcialmente negativo de otra, como se ilustra en la Figura \(\PageIndex{8}\).

El efecto de una atracción dipolo-dipolo es evidente cuando comparamos las propiedades de las moléculas de HCl con las moléculas no polares de F2. Tanto HCl como el F2 consisten en el mismo número de átomos y tienen aproximadamente la misma masa molecular. A una temperatura de 150 K, las moléculas de ambas sustancias tendrían el mismo KE promedio. Sin embargo, las atracciones dipolo-dipolo entre las moléculas de HCl son suficientes para hacer que se "peguen" para formar un líquido, mientras que las fuerzas de dispersión relativamente más débiles entre las moléculas F2 no polares no lo son, por lo que esta sustancia es gaseosa a esta temperatura. El punto de ebullición normal más alto del HCl (188 K) en comparación con F2 (85 K) es un reflejo de la mayor fuerza de las atracciones dipolo-dipolo entre las moléculas de HCl, en comparación con las atracciones entre las moléculas F2 no polares. A menudo usaremos valores como los puntos de ebullición o congelación, o entalpías de vaporización o fusión, como indicadores de las fuerzas relativas de los FMI de atracción presentes en diferentes sustancias.
Ejemplo \(\PageIndex{2}\): FUERZAS DE DIPOLO-DIPOLO Y SUS EFECTOS
Prediga cuál tendrá el punto de ebullición más alto: N2 o CO. Explique su razonamiento.
Solución
El CO y el N2 son moléculas diatómicas con masas de aproximadamente 28 amu, por lo que experimentan fuerzas similares de dispersión de Londres. Debido a que el CO es una molécula polar, experimenta atracciones dipolo-dipolo. Debido a que N2 es no polar, sus moléculas no pueden exhibir atracciones dipolo-dipolo. Las atracciones dipolo-dipolo entre las moléculas de CO son comparativamente más fuertes que las fuerzas de dispersión entre las moléculas de N2 no polares, por lo que se espera que el CO tenga el punto de ebullición más alto.
Un método común para preparar el oxígeno es la descomposición.
Ejercicio \(\PageIndex{2}\)
Prediga cuál tendrá el punto de ebullición más alto: \(\ce{ICl}\) o \(\ce{Br2}\). Explique su razonamiento.
- Respuesta
-
ICl. ICl y Br2 tienen masas similares (~ 160 amu) y, por lo tanto, experimentan fuerzas de dispersión de London similares. ICl es polar y, por lo tanto, también exhibe atracciones dipolo-dipolo; Br2 es no polar y no lo hace. Las atracciones dipolo-dipolo relativamente más fuertes requieren más energía para superar, por lo que ICl tendrá el punto de ebullición más alto.
Enlaces de hidrógeno
El fluoruro de nitrosilo (ONF, masa molecular 49 amu) es un gas a temperatura ambiente. El agua (H2O, masa molecular 18 amu) es un líquido, a pesar de que tiene una masa molecular más baja. Claramente no podemos atribuir esta diferencia entre los dos compuestos a las fuerzas de dispersión. Ambas moléculas tienen aproximadamente la misma forma y ONF es la molécula más pesada y grande. Por lo tanto, se espera que experimente fuerzas de dispersión más significativas. Además, no podemos atribuir esta diferencia en los puntos de ebullición a las diferencias en los momentos dipolares de las moléculas. Ambas moléculas son polares y exhiben momentos dipolares similares. La gran diferencia entre los puntos de ebullición se debe a una atracción dipolo-dipolo particularmente fuerte que puede ocurrir cuando una molécula contiene un átomo de hidrógeno unido a un átomo de flúor, oxígeno o nitrógeno (los tres elementos más electronegativos). La gran diferencia en la electronegatividad entre el átomo de H (2.1) y el átomo al que está unido (4.0 para un átomo de F, 3.5 para un átomo de O, o 3.0 para un átomo de N), combinado con el tamaño muy pequeño de un átomo de H y los tamaños relativamente pequeños de los átomos de F, O o N, lleva a cargas parciales altamente concentradas con estos átomos. Las moléculas con restas de F-H, O-H o N-H se sienten muy atraídas por restos similares en moléculas cercanas, un tipo particularmente fuerte de atracción dipolo-dipolo se llama el enlace de hidrógeno. Los ejemplos de enlaces de hidrógeno incluyen HF ⋯ HF, H2O ⋯ HOH y H3N ⋯ HNH2, en los que los enlaces de hidrógeno se denotan por puntos. La Figura \(\PageIndex{9}\) ilustra los enlaces de hidrógeno entre las moléculas de agua.
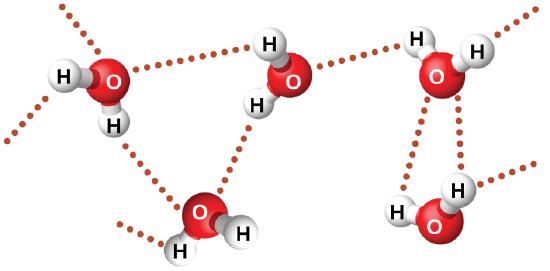
A pesar del uso de la palabra "enlace," tenga en cuenta que los enlaces de hidrógeno son fuerzas de atracción intermoleculares, no fuerzas de atracción intramoleculares (enlaces covalentes). Los enlaces de hidrógeno son mucho más débiles que los enlaces covalentes, solo de 5 a 10% son más fuertes, pero generalmente son mucho más fuertes que otras atracciones dipolo-dipolo y fuerzas de dispersión.
Los enlaces de hidrógeno tienen un efecto pronunciado sobre las propiedades de las fases condensadas (los líquidos y sólidos). Por ejemplo, considere las tendencias en los puntos de ebullición para los hidruros binarios del grupo 15 (NH3, PH3, AsH3 y SbH3), los hidruros del grupo 16 (H2O, H2S, H2Se y H2Te) y los hidruros del grupo 17 (HF, HCl, HBr y HI). Los puntos de ebullición de los tres hidruros más pesados para cada grupo se representan en la Figura \(\PageIndex{10}\). A medida que avanzamos hacia abajo en cualquiera de estos grupos, las polaridades de las moléculas disminuyen un poco, mientras que los tamaños de las moléculas aumentan sustancialmente. El efecto de las fuerzas de dispersión cada vez más fuertes domina el de atracciones dipolo-dipolo cada vez más débiles, y se observa que los puntos de ebullición aumentan constantemente. Para los hidruros del grupo 15, 16 y 17, los puntos de ebullición para cada clase de compuestos aumentan al aumentar la masa molecular de los elementos en los períodos 3, 4 y 5.
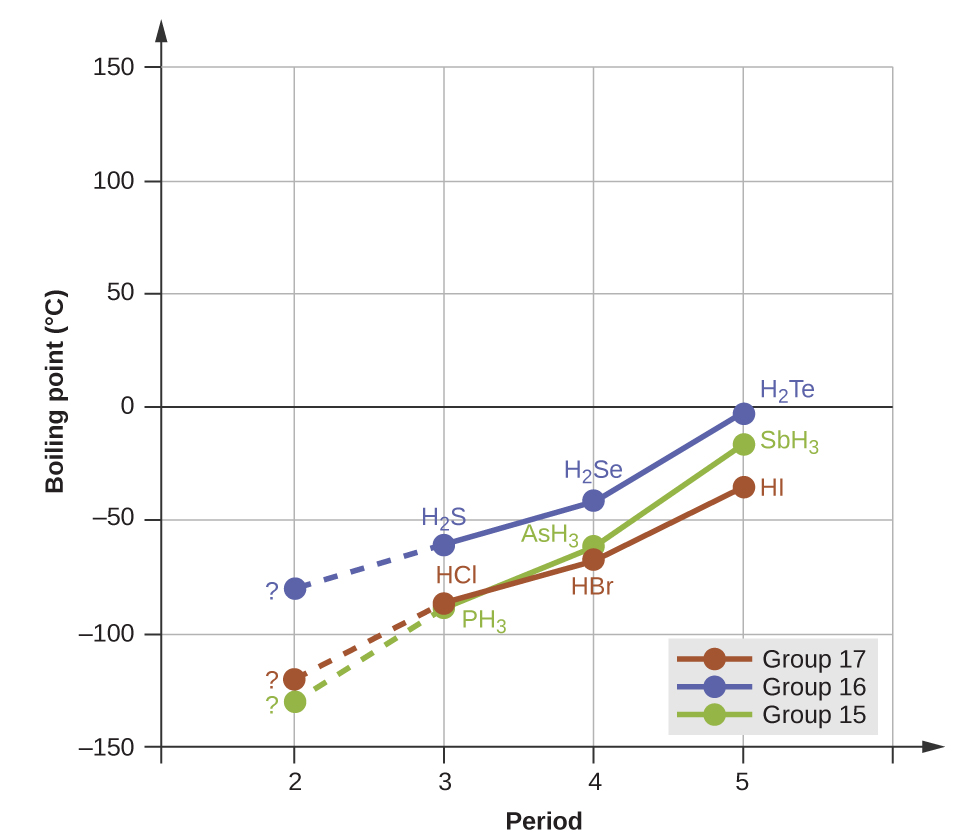
Si usamos esta tendencia para predecir los puntos de ebullición para el hidruro más ligero para cada grupo, esperaríamos que el NH3 hierva a aproximadamente −120 ° C, el H2O hierva a aproximadamente −80 °C y el HF hierva a aproximadamente −110 °C. Sin embargo, cuando medimos los puntos de ebullición de estos compuestos, encontramos que son dramáticamente más altos de lo que predecirían las tendencias, como se muestra en la Figura \(\PageIndex{10}\). El contraste entre nuestras predicciones ingenuas y la realidad proporciona evidencia convincente de la fuerza del enlace de hidrógeno.
Ejemplo \(\PageIndex{3}\): EL EFECTO DEL ENLACE DE HIDRÓGENO EN LOS PUNTOS DE EBULLICIÓN
Considere los compuestos del dimetiléter (CH3OCH3), el etanol (CH3CH2OH) y el propano (CH3CH2CH3). Sus puntos de ebullición, no necesariamente en orden, son −42.1 °C, −24.8 °C y 78.4 °C. Une cada compuesto con su punto de ebullición. Explique su razonamiento.
Solución
Las formas predichas por VSEPR del CH3OCH3, CH3CH2OH y CH3CH2CH3 son similares, al igual que sus masas molares (46 g/mol, 46 g/mol y 44 g/mol, respectivamente), por lo que exhibirán fuerzas de dispersión similares. Como CH3CH2CH3 es no polar, puede exhibir solo fuerzas de dispersión. Debido a que CH3OCH3 es polar, también experimentará atracciones de dipolo-dipolo. Finalmente, CH3CH2OH tiene un grupo −OH, por lo que experimentará la atracción dipolo-dipolo excepcionalmente fuerte conocida como el enlace de hidrógeno. Entonces, el orden en términos de resistencia de los FMI, y por lo tanto los puntos de ebullición, es CH3CH2CH3 <CH3OCH3 <CH3CH2OH. El punto de ebullición del propano es −42.1 ° C, el punto de ebullición del dimetiléter es −24.8 ° C y el punto de ebullición del etanol es 78.5 ° C.
Ejercicio \(\PageIndex{2}\)
El etano (CH3CH3) tiene un punto de fusión de -183 °C y un punto de ebullición de -89 °C. Prediga los puntos de fusión y ebullición de la metilamina (CH3NH2). Explique su razonamiento.
- Respuesta:
-
Se predice que el punto de fusión y el punto de ebullición de la metilamina serán significativamente mayores que los del etano. (CH3CH3) y (CH3NH2) son similares en tamaño y masa, pero la metilamina posee un grupo -NH y, por lo tanto, puede exhibir enlaces de hidrógeno. Esto aumenta en gran medida sus FMI y, por lo tanto, sus puntos de fusión y ebullición. Es difícil predecir valores, pero los valores conocidos son un punto de fusión de −93 °C y un punto de ebullición de −6 °C.
Los enlaces de hidrógeno y el ADN
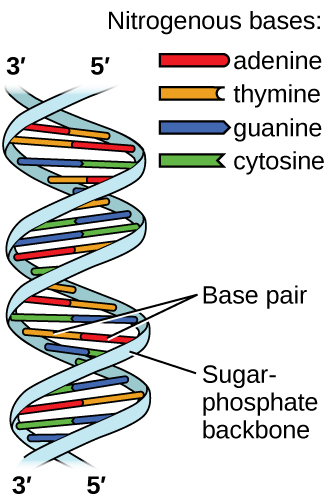
El ácido desoxirribonucleico (ADN) se encuentra en todos los organismos vivos y contiene la información genética que determina las características del organismo, proporciona el plan para producir las proteínas necesarias para la vida y sirve como plantilla para transmitir esta información a la descendencia del organismo. Una molécula de ADN consta de dos cadenas (anti-) paralelas de nucleótidos repetidos, que forman su conocida estructura de doble hélice, como se muestra en la Figura \(\PageIndex{10}\).
Cada nucleótido contiene un azúcar (desoxirribosa) unido a un grupo fosfato en un lado, y una de las cuatro bases nitrogenadas en el otro. Dos de las bases, la citosina (C) y la timina (T), son estructuras de un solo anillo conocidas como los pirimidinas. Los otros dos, la adenina (A) y la guanina (G), son estructuras de doble anillo llamadas las purinas. Estas bases forman pares de bases complementarias que consisten en una purina y una pirimidina, con adenina emparejada con timina y citosina con guanina. Cada par de bases se mantiene unido por enlaces de hidrógeno. A y T comparten dos enlaces de hidrógeno, C y G comparten tres, y ambos pares tienen una forma y estructura similar Figura \(\PageIndex{12}\).
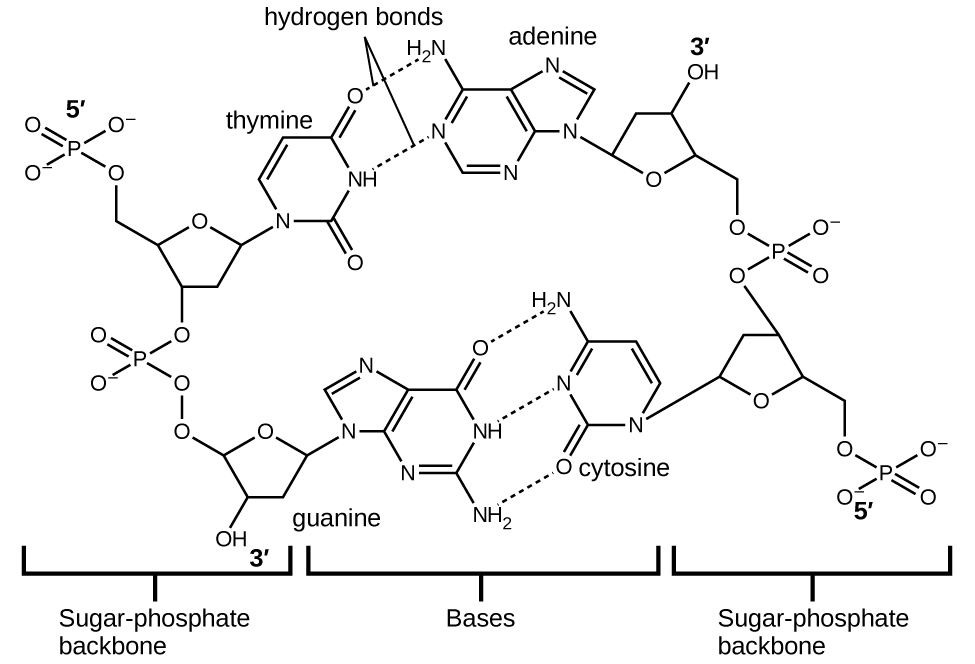
El efecto acumulativo de millones de enlaces de hidrógeno mantiene efectivamente unidas las dos cadenas de ADN. Las dos cadenas de ADN pueden "descomprimirse" relativamente fácilmente por la mitad ya que los enlaces de hidrógeno son relativamente débiles en comparación con los enlaces covalentes que mantienen unidos a los átomos de las moléculas de ADN individuales. Esto permite que ambas cadenas funcionen como una plantilla para la replicación.
Resumen
Las propiedades físicas de la materia condensada (los líquidos y sólidos) se pueden explicar en términos de la teoría cinética molecular. En un líquido, las fuerzas de atracción intermoleculares mantienen a las moléculas en contacto, aunque todavía tienen suficiente energía cinética para pasar una a la otra. Las fuerzas de atracción intermoleculares, llamadas colectivamente las fuerzas de van der Waals, son responsables para el comportamiento de los líquidos y sólidos y son de naturaleza electrostática. Las atracciones de dipolo-dipolo resultan de la atracción electrostática del extremo negativo parcial de una molécula dipolar para el extremo positivo parcial de otra. El dipolo temporal que resulta del movimiento de los electrones en un átomo puede inducir un dipolo en un átomo adyacente y dar lugar a la fuerza de dispersión de Londres. Las fuerzas de Londres aumentan con el aumento del tamaño molecular. Los enlaces de hidrógeno son un tipo especial de atracción dipolo-dipolo que se produce cuando el hidrógeno se une a uno de los tres elementos más electronegativos: F, O o N.
Glosario
- atracción dipolo-dipolo
- Atracción intermolecular entre dos dipolos permanentes
- fuerza de dispersión
- (también, la fuerza de dispersión de Londres) atracción entre dos dipolos temporales que fluctúan rápidamente; significativo solo cuando las partículas están muy juntas
- enlaces de hidrógeno
- ocurre cuando los dipolos excepcionalmente fuertes se atraen; enlace que existe cuando el hidrógeno se une a uno de los tres elementos más electronegativos: F, O, o N
- dipolo inducido
- dipolo temporal formado cuando los electrones de un átomo o molécula están distorsionados por el dipolo instantáneo de un átomo o molécula vecina
- dipolo instantáneo
- dipolo temporal que ocurre por un breve momento en el tiempo cuando los electrones de un átomo o molécula se distribuyen asimétricamente
- Fuerza intermolecular
- fuerza de atracción no covalente entre átomos, moléculas y / o iones
- polarización
- medida de la capacidad de una carga para distorsionar la distribución de carga de una molécula (nube de electrones)
- fuerza de van der Waals
- fuerza atractiva o repulsiva entre moléculas, incluidos dipolo-dipolo, dipolo inducido por dipolo y fuerzas de dispersión de Londres; no incluye fuerzas debidas a enlaces covalentes o iónicos, o la atracción entre iones y moléculas
Contribuyentes
Paul Flowers (University of North Carolina - Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110).
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


