25.2: Instrumentación Voltamétrica
- Page ID
- 79028
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Si bien los métodos voltamétricos tempranos utilizaron solo dos electrodos, un voltámetro moderno hace uso de un potenciostato de tres electrodos, como el que se muestra en la Figura\(\PageIndex{1}\). El potencial del electrodo de trabajo se mide en relación con un electrodo de referencia de potencial constante que se conecta al electrodo de trabajo a través de un potenciómetro de alta impedancia. El electrodo auxiliar generalmente es un alambre de platino y el electrodo de referencia generalmente es un electrodo SCE o un electrodo de Ag/AgCl. Aplicamos una señal de excitación de potencial dependiente del tiempo al electrodo de trabajo, cambiando su potencial en relación con el potencial fijo del electrodo de referencia, y medimos la corriente que fluye entre el electrodo de trabajo y el electrodo auxiliar. Los potenciostatos modernos incluyen generadores de forma de onda que nos permiten aplicar un perfil de potencial dependiente del tiempo, como una serie de pulsos de potencial, al electrodo de trabajo.

Electrodos de Trabajo
Para el electrodo de trabajo podemos elegir entre varios materiales diferentes, incluyendo mercurio, platino, oro, plata y carbono. Las primeras técnicas voltamétricas utilizaron un electrodo de trabajo de mercurio. Debido a que el mercurio es un líquido, el electrodo de trabajo suele ser una gota suspendida del extremo de un tubo capilar. En el electrodo de gota de mercurio colgante, o HMDE, extruimos la gota de Hg girando un tornillo micrómetro que empuja el mercurio desde un depósito a través de un tubo capilar estrecho (Figura\(\PageIndex{2}\) a).
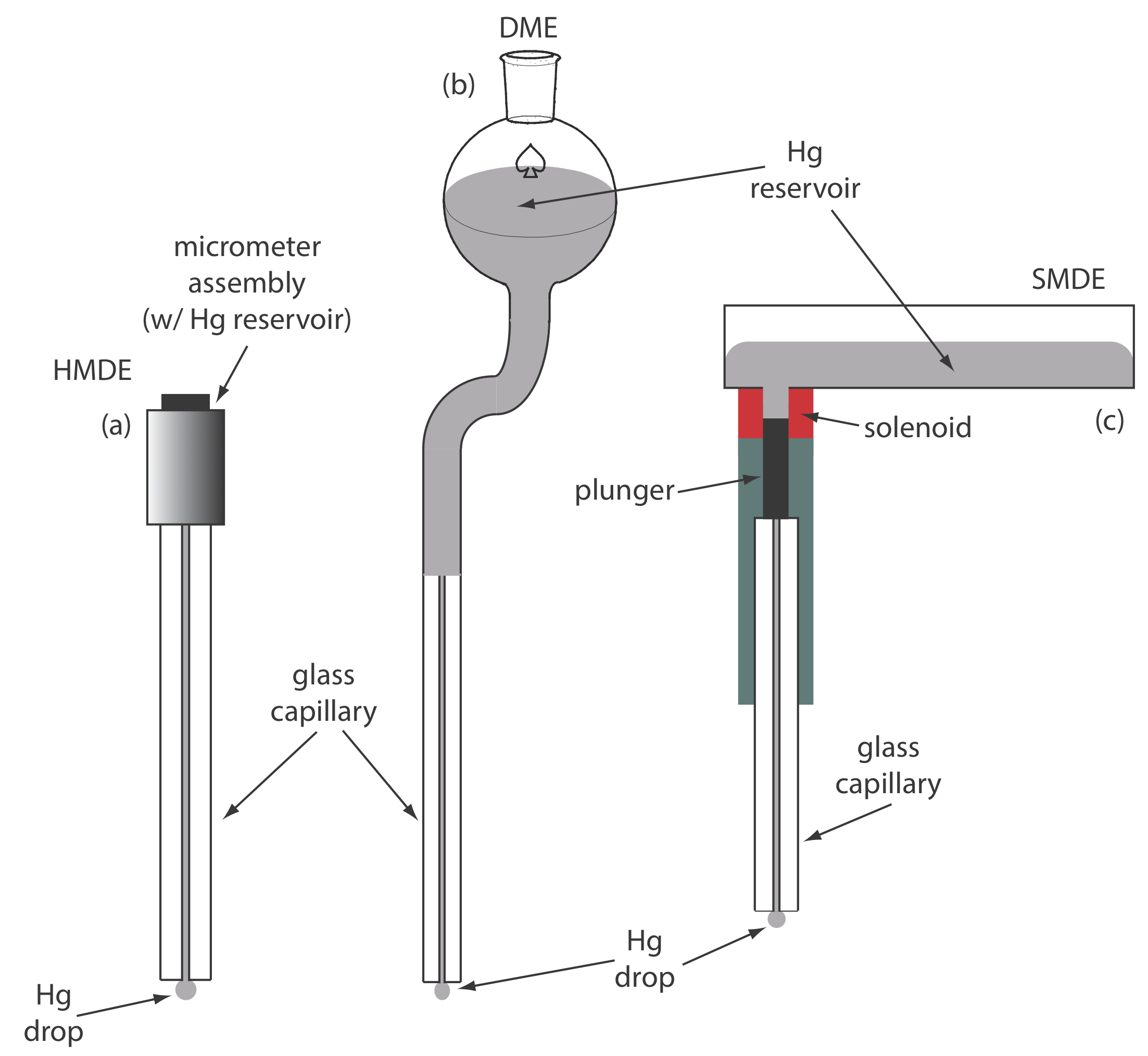
En el electrodo de mercurio que cae, o DME, se forman gotas de mercurio en el extremo del tubo capilar como resultado de la gravedad (Figura\(\PageIndex{2}\) b). A diferencia del HMDE, la gota de mercurio de un DME crece continuamente, a medida que el mercurio fluye del reservorio bajo la influencia de la gravedad, y tiene una vida útil finita de varios segundos. Al final de su vida útil, la gota de mercurio se desaloja, ya sea manualmente o sola, y es reemplazada por una nueva gota. El electrodo estático de gota de mercurio, o SMDE, utiliza un émbolo accionado por solenoide para controlar el flujo de mercurio (Figura\(\PageIndex{2}\) c). La activación del solenoide levanta momentáneamente el émbolo, permitiendo que el mercurio fluya a través del capilar, formando una sola gota de Hg colgante. La activación repetida del solenoide produce una serie de gotas de Hg. De esta manera el SMDE puede ser utilizado ya sea como HMDE o como DME. Hay un tipo adicional de electrodo de mercurio: el electrodo de película de mercurio. Un electrodo sólido, típicamente carbono, platino o oro, se coloca en una solución de Hg 2 + y se mantiene a un potencial donde la reducción de Hg 2 + a Hg es favorable, depositando una película delgada de mercurio sobre la superficie del electrodo sólido.
El mercurio tiene varias ventajas como electrodo de trabajo. Quizás su ventaja más importante es su alto sobrepotencial para la reducción de H 3 O + a H 2, lo que hace potenciales accesibles tan negativos como —1 V versus el SCE en soluciones ácidas y —2 V versus el SCE en soluciones básicas (Figura\(\PageIndex{3}\)). Una especie como Zn 2 +, que es difícil de reducir en otros electrodos sin reducir simultáneamente H 3 O +, es fácil de reducir en un electrodo de trabajo de mercurio. Otras ventajas incluyen la capacidad de los metales para disolverse en mercurio, lo que resulta en la formación de una amalgama, y la capacidad de renovar la superficie del electrodo extruyendo una nueva gota. Una limitación al mercurio como electrodo de trabajo es la facilidad con la que se oxida. Dependiendo del solvente, no se puede usar un electrodo de mercurio a potenciales más positivos que aproximadamente —0.3 V a +0.4 V versus el SCE.
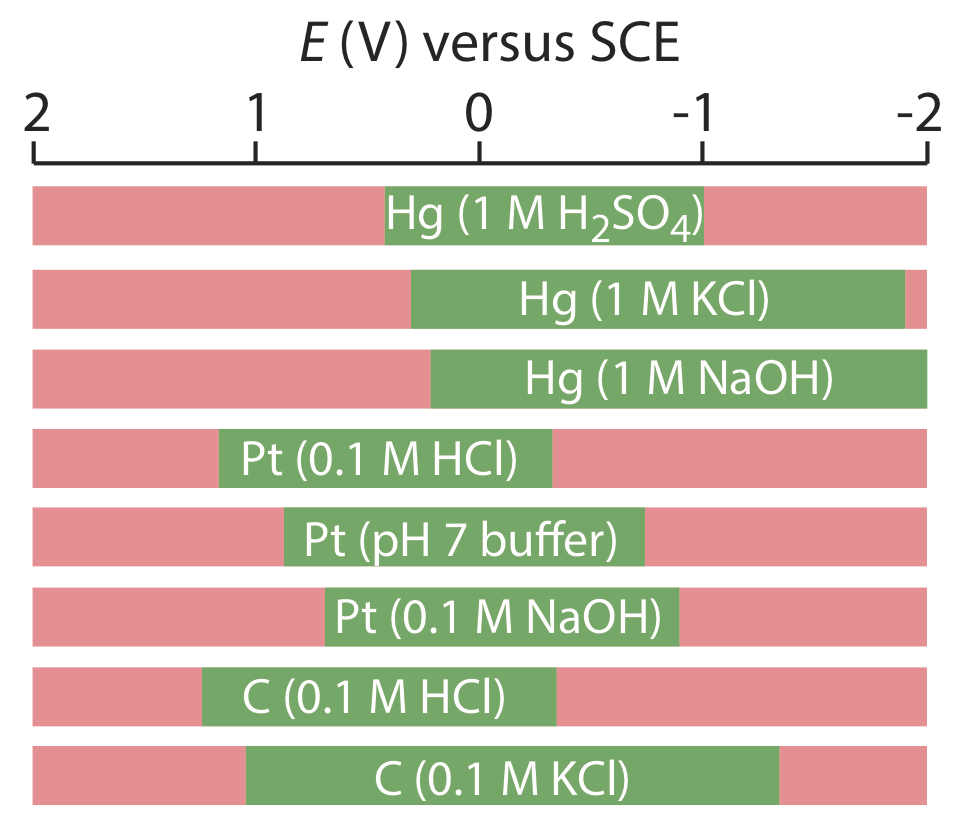
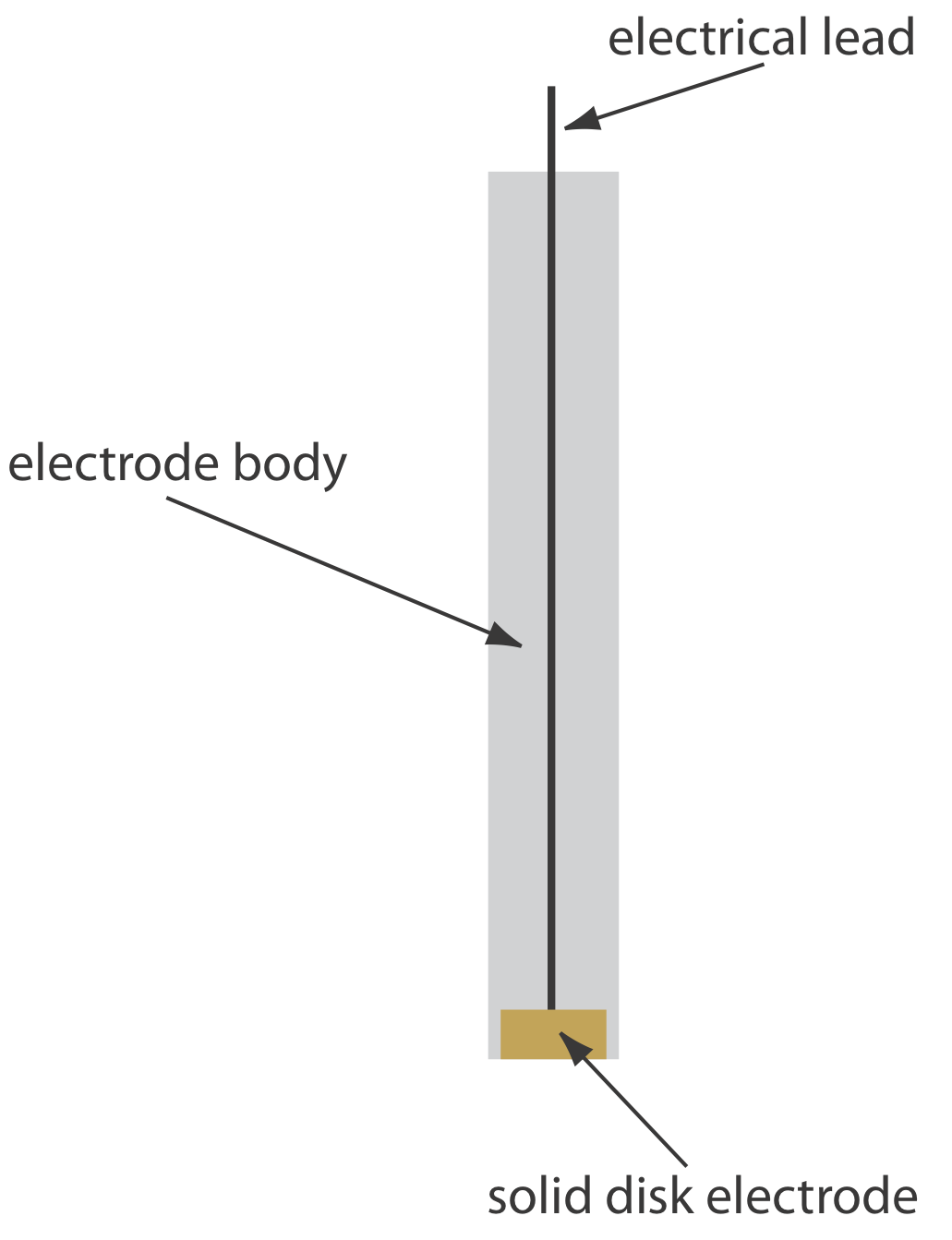
Los electrodos sólidos construidos con platino, oro, plata o carbono se pueden usar en un rango de potenciales, incluyendo potenciales que son negativos y positivos con respecto al SCE (Figura\(\PageIndex{3}\)). Por ejemplo, la ventana de potencial para un electrodo de Pt se extiende de aproximadamente +1.2 V a —0.2 V versus el SCE en soluciones ácidas, y de +0.7 V a —1 V versus el SCE en soluciones básicas. Un electrodo sólido puede reemplazar un electrodo de mercurio para muchos análisis voltamétricos que requieren potenciales negativos, y es el electrodo de elección a potenciales más positivos. Excepto por el electrodo de pasta de carbono, un electrodo sólido se forma en un disco y se sella en el extremo de un soporte inerte con un cable eléctrico (Figura\(\PageIndex{4}\)). El electrodo de pasta de carbono se realiza llenando la cavidad al final del soporte inerte con una pasta que consiste en partículas de carbono y un aceite viscoso. Los electrodos sólidos no están exentos de problemas, el más importante de los cuales es la facilidad con que la superficie del electrodo se ve alterada por la adsorción de una especie de solución o por la formación de una capa de óxido. Por esta razón, un electrodo sólido necesita reacondicionamiento frecuente, ya sea aplicando un potencial apropiado o puliendo.
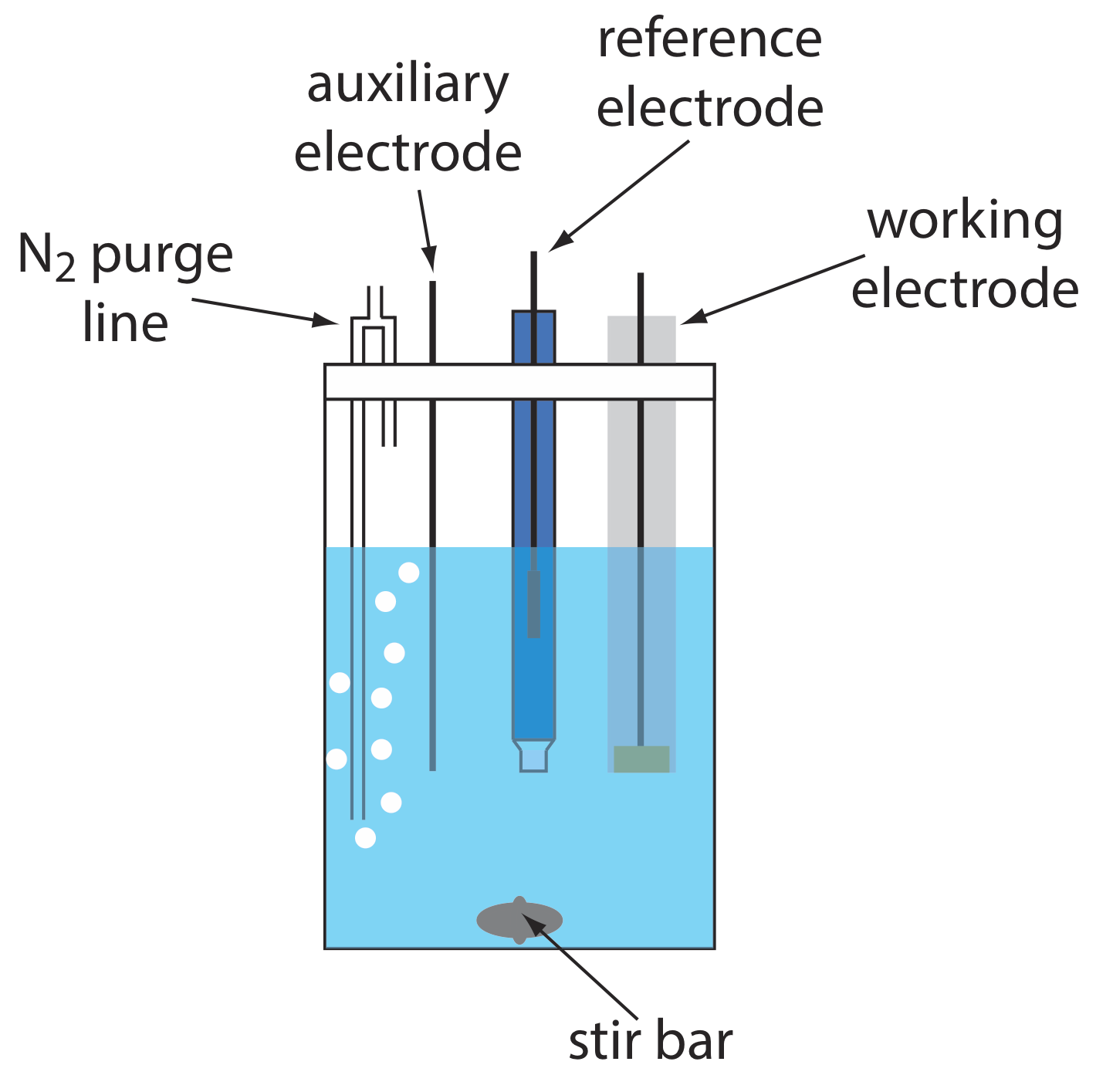
Celdas Electroquímicas
Una disposición típica para una celda electroquímica voltamétrica se muestra en la Figura\(\PageIndex{5}\). Además del electrodo de trabajo, el electrodo de referencia y el electrodo auxiliar, la celda también incluye una línea de purga N2 para eliminar O 2 disuelto, y una barra agitadora opcional. Las celdas electroquímicas están disponibles en una variedad de tamaños, lo que permite el análisis de volúmenes de solución que van desde más de 100 mL hasta tan pequeños como 50 μL.