7.3: Implementación del Plan de Muestreo
- Page ID
- 75991
Implementar un plan de muestreo generalmente implica tres pasos: retirar físicamente la muestra de su población objetivo, preservar la muestra y preparar la muestra para su análisis. A excepción del muestreo in situ, analizamos una muestra después de haberla eliminado de su población objetivo. Debido a que el muestreo expone a la población objetivo a una posible contaminación, nuestro dispositivo de muestreo debe ser inerte y limpio.
Una vez que eliminamos una muestra de su población objetivo, existe el peligro de que sufra un cambio químico o físico antes de que podamos completar su análisis. Este es un problema grave porque las propiedades de la muestra ya no serán representativas de la población objetivo. Para evitar este problema, a menudo conservamos muestras antes de transportarlas al laboratorio para su análisis. Incluso cuando analizamos una muestra en campo, la preservación puede ser aún necesaria.
La muestra inicial se denomina muestra primaria o bruta, y puede ser un solo incremento extraído de la población objetivo o un compuesto de varios incrementos. En muchos casos no podemos analizar la muestra bruta sin antes preparar la muestra para analizarla reduciendo el tamaño de partícula de la muestra, convirtiendo la muestra en una forma más fácilmente analizable o mejorando su homogeneidad.
Aunque es posible que nunca trabaje con las muestras específicas resaltadas en esta sección, los estudios de caso presentados aquí pueden ayudarlo a imaginar posibles problemas asociados con sus muestras.
Soluciones
Hay muchos buenos ejemplos de muestras de soluciones: solventes comerciales; bebidas, como leche o jugo de frutas; aguas naturales, incluyendo lagos, arroyos, agua de mar y lluvia; fluidos corporales, como sangre y orina; y suspensiones, como las que se encuentran en muchos medicamentos orales. Usemos el muestreo de aguas naturales y aguas residuales como estudio de caso en cómo muestrear una solución.
Recolección de muestras
La composición química de un agua superficial, como un arroyo, río, lago, estuario u océano, está influenciada por el caudal y la profundidad. Los arroyos y ríos poco profundos que fluyen rápidamente, y los lagos poco profundos (<5 m) generalmente están bien mezclados y muestran poca estratificación con la profundidad. Para recoger una muestra de agarre sumergimos una botella tapada debajo de la superficie, retiramos la tapa y permitimos que la botella se llene completamente, y reemplazamos la tapa. Al recolectar una muestra de esta manera se evita la interfase aire-agua, la cual puede estar enriquecida con metales pesados o contaminada con petróleo [Duce, R. A.; Quinn, J. G. Olney, C. E.; Piotrowicz, S. R.; Ray, S. J.; Wade, T. L. Science 1972, 176, 161—163].
Los arroyos y ríos que se mueven lentamente, los lagos de más de cinco metros de profundidad, los estuarios y los océanos pueden mostrar estratificación sustancial con la profundidad. Las muestras de agarre de cerca de la superficie se recolectan como se describió anteriormente, y las muestras a mayores profundidades se recolectan usando una botella de muestra rebajada a la profundidad deseada (Figura 7.3.1 ).

Los pozos para muestreo de agua subterránea se purgan antes de recolectar muestras porque la composición química del agua en una cubierta de pozo puede diferir significativamente de la del agua subterránea. Estas diferencias pueden ser el resultado de contaminantes introducidos durante la perforación del pozo o por un cambio en el potencial redox del agua subterránea después de su exposición al oxígeno atmosférico. En general, un pozo se purga bombeando un volumen de agua equivalente a varios volúmenes de revestimiento de pozo o bombeando hasta que la temperatura, pH o conductancia específica del agua sea constante. Un suministro de agua municipal, como una residencia o un negocio, se purga antes del muestreo porque la composición química del agua que se encuentra en una tubería puede diferir significativamente del suministro de agua tratada. Las muestras se recolectan en los grifos después de lavar las tuberías durante 2-3 minutos.
Las muestras de plantas de tratamiento de aguas residuales municipales y descargas industriales a menudo se recolectan como un compuesto de 24 horas. Un muestreador automático retira periódicamente una muestra individual de agarre, añadiéndola a las recolectadas previamente. El volumen de cada muestra y la frecuencia de muestreo pueden ser constantes, o pueden variar en respuesta a cambios en el caudal.
Los contenedores de muestras para la recolección de aguas naturales y aguas residuales están hechos de vidrio o plástico. El vidrio de borosilicato de la marca Kimax y Pyrex tiene la ventaja de ser fácil de esterilizar, fácil de limpiar e inerte a todas las soluciones excepto aquellas que son fuertemente alcalinas. Las desventajas de los envases de vidrio son el costo, el peso y la facilidad de rotura. Los recipientes de plástico están hechos de una variedad de polímeros, incluyendo polietileno, polipropileno, policarbonato, cloruro de polivinilo y teflón. Los recipientes de plástico son livianos, duraderos y, a excepción de los fabricados con teflón, económicos. En la mayoría de los casos, las botellas de vidrio o plástico se utilizan indistintamente, aunque generalmente se prefieren las botellas de polietileno debido a su menor costo. Los recipientes de vidrio siempre se utilizan cuando se recolectan muestras para el análisis de pesticidas, aceite y grasa, y orgánicos porque estas especies a menudo interactúan con superficies plásticas. Debido a que las superficies de vidrio adsorben fácilmente iones metálicos, se prefieren las botellas de plástico cuando se recolectan muestras para el análisis de metales traza.
En la mayoría de los casos el frasco de muestra tiene una boca ancha, lo que facilita el llenado y la extracción de la muestra. Se utiliza una botella de muestra de boca estrecha si exponer la muestra a la tapa del recipiente o al ambiente exterior es un problema. A menos que la exposición al plástico sea un problema, las tapas para botellas de muestra se fabrican a partir de polietileno. Cuando se debe evitar el polietileno, la tapa del recipiente incluye un forro interior inerte de neopreno o teflón.
Conservación y preparación de muestras
Aquí nuestra preocupación es sólo con la necesidad de preparar la muestra bruta convirtiéndola en una forma adecuada para su análisis. Algunos métodos analíticos requieren etapas adicionales de preparación de la muestra, como concentrar o diluir el analito, o ajustar la forma química del analito. Consideraremos estas formas de preparación de muestras en capítulos posteriores que se enfocan en métodos analíticos específicos.
Después de retirar una muestra de su población objetivo, su composición química puede cambiar como resultado de procesos químicos, biológicos o físicos. Para evitar un cambio en la composición, las muestras se conservan controlando el pH y la temperatura de la muestra, limitando su exposición a la luz o a la atmósfera, o agregando un conservante químico. Después de conservar una muestra, se almacena de manera segura para su posterior análisis. El tiempo máximo de retención entre la conservación y el análisis depende de la estabilidad del analito y la efectividad de la preservación de la muestra. El cuadro 7.3.1 resume los métodos de conservación y los tiempos máximos de retención para varios analitos de importancia en el análisis de aguas naturales y aguas residuales.
| analito | método de preservación | tiempo máximo de retención |
|---|---|---|
| amoníaco |
enfriar a 4 o C; agregar H 2 SO 4 a pH < 2 |
28 días |
| cloruro | ninguno requerido | 28 días |
| metales: Cr (VI) | frío a 4 o C | 24 horas |
| metales: Hg |
HNO 3 a pH < 2 |
28 días |
| metales: todos los demás |
HNO 3 a pH < 2 |
6 meses |
| nitrato |
ninguno requerido |
48 horas |
| plaguicidas organoclorados |
1 mL de 10 mg/mL de HgCl 2 o extracción inmediata con un disolvente no acuoso adecuado |
7 días sin extracción; 40 días con extracción |
| pH |
ninguno requerido |
analizar inmediatamente |
Aparte de agregar un conservante, las muestras de solución generalmente no necesitan preparación adicional antes del análisis. Este es el caso de muestras de aguas naturales y aguas residuales. Las muestras de solución con matrices particularmente complejas —la sangre y la leche son dos ejemplos comunes— pueden necesitar procesamiento adicional para separar analitos de interferentes, tema tratado más adelante en este capítulo.
Gases
Los ejemplos típicos de muestras gaseosas incluyen gases de escape de automóviles, emisiones de chimeneas industriales, gases atmosféricos y gases comprimidos. También se incluyen en esta categoría las partículas de aerosol, las partículas sólidas finas y las gotas líquidas que forman humo y smog. Usemos el muestreo de aire urbano como estudio de caso en cómo muestrear un gas.
Recolección de muestras
Un enfoque para recolectar una muestra de aire urbano es llenar un bote de acero inoxidable o una bolsa de Tedlar/Teflon. Una bomba introduce el aire en el recipiente y, después de purgarlo, el recipiente se sella. Este método tiene la ventaja de ser sencillo y de recolectar una muestra representativa. Las desventajas incluyen la tendencia de algunos analitos a adsorberse en las paredes del contenedor, la presencia de analitos a concentraciones demasiado bajas para detectarlos con precisión y precisión adecuadas, y la presencia de analitos reactivos, como ozono y óxidos de nitrógeno, que pueden reaccionar con el recipiente o que pueden de lo contrario alterará la composición química de la muestra durante el almacenamiento. Cuando se usa un bote de acero inoxidable, el enfriamiento criogénico, que cambia la muestra de un estado gaseoso a un estado líquido, puede limitar algunas de estas desventajas.
La mayoría de las muestras de aire urbano se recolectan por filtración o mediante el uso de una trampa que contiene un sorbente sólido. Los sorbentes sólidos se utilizan para gases volátiles (una presión de vapor superior a 10 —6 atm) y para gases semivolátiles (una presión de vapor entre 10 —6 atm y 10 —12 atm). La filtración se utiliza para recoger partículas de aerosol. La captura y el filtrado permiten muestrear grandes volúmenes de gas, una preocupación importante para un analito con una concentración pequeña, y estabiliza la muestra entre su recolección y su análisis.
En el muestreo de sorbentes sólidos, una bomba extrae el aire urbano a través de un bote lleno de partículas sorbentes. Por lo general, se toman muestras de 2 a 100 L de aire al recolectar un compuesto volátil y de 2 a 500 m 3 cuando se recolecta un gas semivolátil. Se ha utilizado una variedad de sorbentes inorgánicos, de polímeros orgánicos y de carbono. Los sorbentes inorgánicos, como gel de sílice, alúmina, silicato de magnesio y aluminio y tamices moleculares, son colectores eficientes para compuestos polares. Su eficiencia en la absorción de agua, sin embargo, limita su capacidad para muchos analitos orgánicos.
1 m 3 equivale a 10 3 L.
Los sorbentes poliméricos orgánicos incluyen resinas poliméricas de óxido de 2,4-difenil- p-fenileno o estireno-divinilbenceno para compuestos volátiles, y espuma de poliuretano para compuestos semivolátiles. Estos materiales tienen una baja afinidad por el agua y son eficientes para muestrear todos los compuestos orgánicos menos altamente volátiles y algunos alcoholes y cetonas de menor peso molecular. Los sorbentes de carbono son superiores a las resinas poliméricas orgánicas, lo que los hace útiles para compuestos orgánicos altamente volátiles que no absorberán sobre resinas poliméricas, aunque eliminar los compuestos puede ser difícil.
Los compuestos no volátiles normalmente están presentes como partículas sólidas o están unidos a partículas sólidas. Las muestras se recolectan tirando de un gran volumen de aire urbano a través de una unidad de filtrado y recolectando las partículas en filtros de fibra de vidrio.
La exposición a corto plazo de humanos, animales y plantas a contaminantes atmosféricos es más severa que la de otros contaminantes en otras matrices. Debido a que la composición de los gases atmosféricos puede variar significativamente a lo largo de un tiempo, es importante el monitoreo continuo de gases atmosféricos como O 3, CO, SO 2, NH 3, H 2 O 2 y NO 2 mediante muestreo in situ [Tanner, R. L. en Keith, L. H., ed. Principios del muestreo ambiental, American Chemical Society: Washington, D. C., 1988, 275—286].
Preservación de muestras
Después de recolectar una muestra bruta de aire urbano, generalmente hay poca necesidad de conservación o preparación de la muestra. La composición química de una muestra de gas generalmente es estable cuando se recolecta usando un sorbente sólido, un filtro o mediante enfriamiento criogénico. Cuando se usa un sorbente sólido, los compuestos gaseosos se liberan para su análisis por desorción térmica o por extracción con un disolvente adecuado. Si el sorbente es selectivo para un solo analito, se usa el aumento en la masa del sorbente para determinar la cantidad de analito en la muestra.
Sólidos
Los ejemplos típicos de muestras sólidas incluyen partículas grandes, tales como las que se encuentran en minerales; partículas más pequeñas, tales como suelos y sedimentos; tabletas, pellets y cápsulas utilizadas para dispensar productos farmacéuticos y alimentos para animales; materiales laminares, tales como polímeros y metales laminados; y muestras de tejido de especímenes biológicos. Los sólidos suelen ser heterogéneos y debemos recolectar muestras cuidadosamente para que sean representativas de la población objetivo. Usemos el muestreo de sedimentos, suelos y minerales como estudio de caso en cómo muestrear sólidos.
Recolección de muestras
Los sedimentos del fondo de arroyos, ríos, lagos, estuarios y océanos se recolectan con una toma de muestras de fondo o con un descorazonador. Un muestreador de agarre inferior (Figura 7.3.2 ) está equipado con un par de mandíbulas que se cierran cuando entran en contacto con el sedimento, recogiendo sedimentos en el proceso. Sus principales ventajas son la facilidad de uso y la capacidad de recolectar una muestra grande. Las desventajas incluyen la tendencia a perder partículas de sedimentos de grano más fino a medida que el agua sale del muestreador, y la pérdida de información espacial, tanto lateralmente como con profundidad, debido a la mezcla de la muestra.

Un método alternativo para la recolección de sedimentos es el dispositivo cilíndrico de extracción de núcleos que se muestra en la Figura 7.3.3 ). El descorazonador se deja caer en el sedimento, recogiendo una columna de sedimento y el agua en contacto con el sedimento. Con la posible excepción del sedimento en la superficie, que puede experimentar mezcla, las muestras recolectadas con un desbrozador mantienen su perfil vertical, lo que conserva información sobre cómo cambia la composición del sedimento con la profundidad.
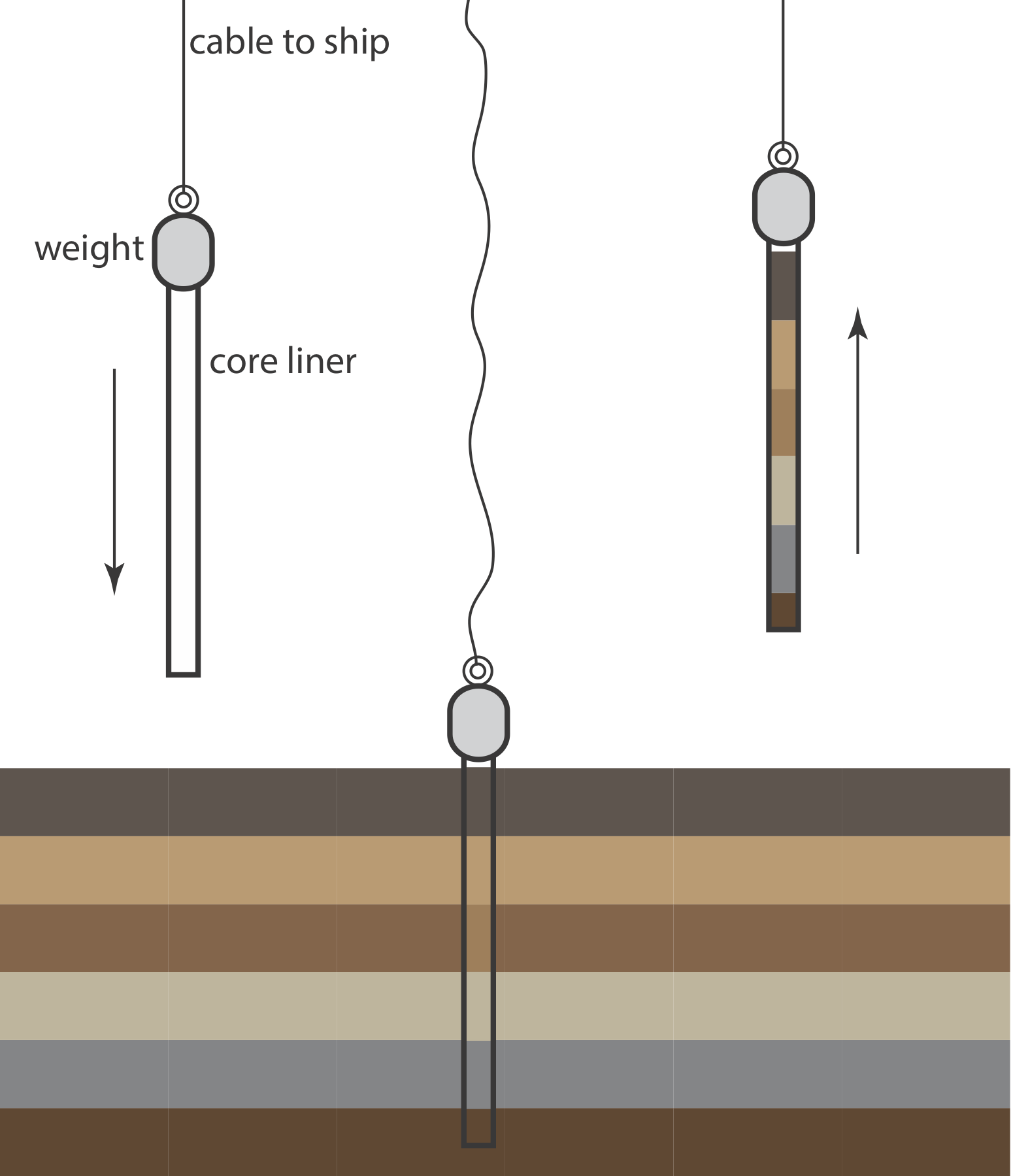
La recolección de muestras de suelo a profundidades de hasta 30 cm se realiza con una pala o una pala, aunque la varianza de muestreo generalmente es alta. Una mejor herramienta para recolectar muestras de suelo cerca de la superficie es un punzón de suelo, que es un tubo de acero de pared delgada que retiene una muestra de núcleo después de que se introduce en el suelo y se retira. Las muestras de suelo de profundidades mayores a 30 cm se recolectan cavando una zanja y recolectando muestras laterales con un ponche de suelo. Alternativamente, se utiliza una barrena para perforar un agujero a la profundidad deseada y la muestra se recolecta con un punzón de suelo.
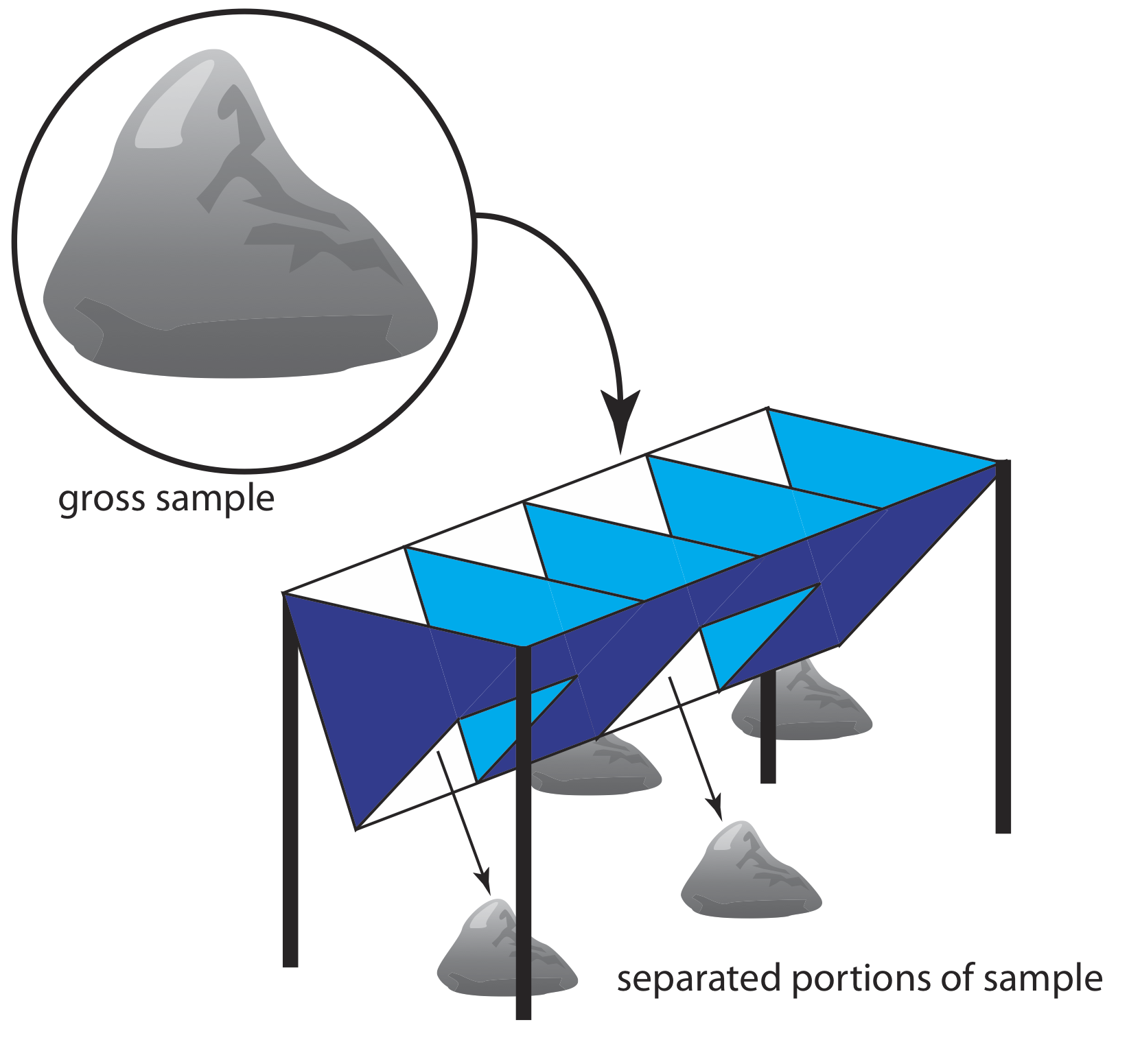
Para los materiales particulados, el tamaño de partícula a menudo determina el método de muestreo. Los sólidos particulados más grandes, como los minerales, se muestrean usando un riffle (Figura 7.3.4 ), que es un canal con un número par de compartimentos. Debido a que los compartimentos contiguos se vacían en lados opuestos del riffle, el vertido de una muestra bruta en el riffle la divide por la mitad. Al pasar repetidamente la mitad del material separado de nuevo a través del riffle, se recoge una muestra del tamaño deseado.
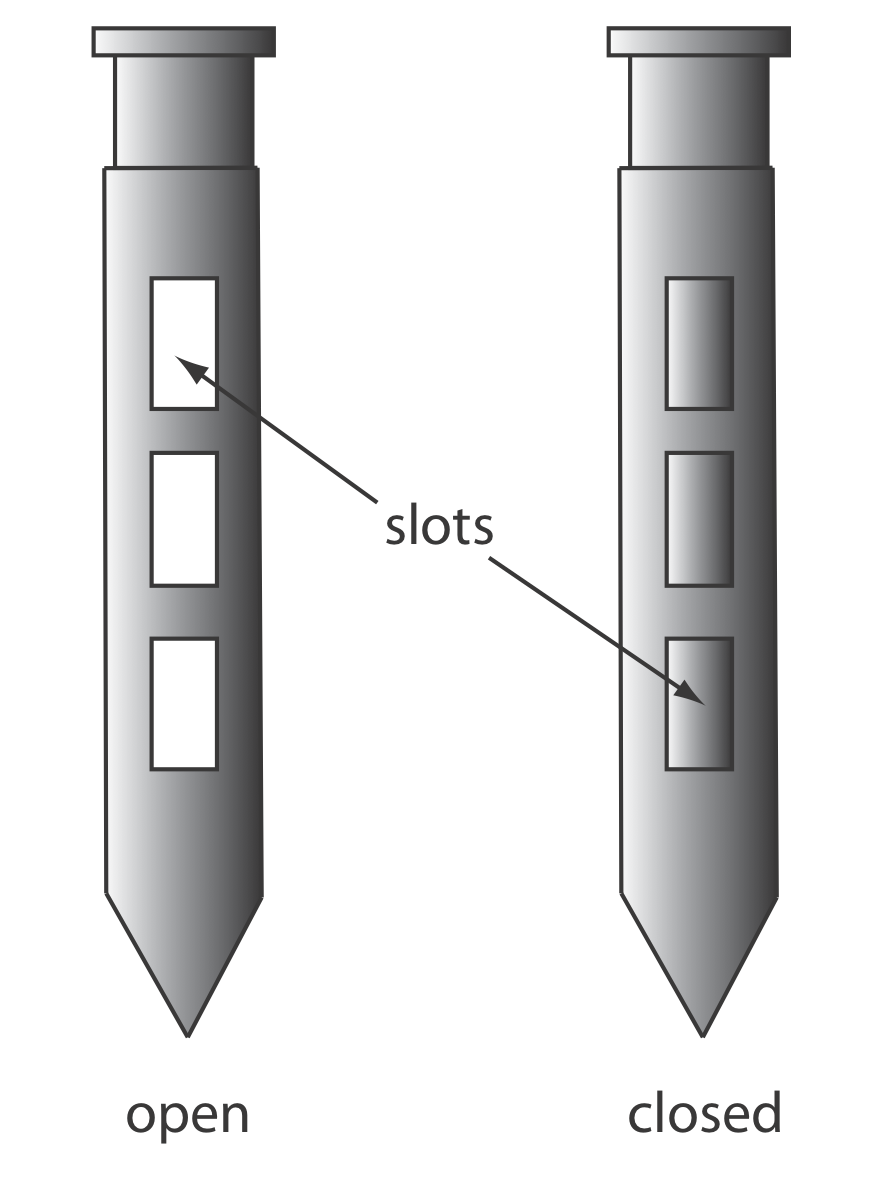
Se utiliza un ladrón de muestras (Figura 7.3.5 ) para muestrear materiales particulados más pequeños, como polvos. Un típico ladrón de muestras consiste en dos tubos que están enclavados juntos. Cada tubo tiene una o más ranuras alineadas a lo largo del ladrón de muestras. Antes de insertar el ladrón de muestras en el material que se está muestreando, las ranuras se cierran girando el tubo interno. Cuando el ladrón de muestras está en su lugar, al girar el tubo interno se abren las ranuras, que se llenan con muestras individuales. Luego se gira el tubo interno hasta la posición cerrada y se retira el ladrón de muestras.
Preservación de muestras
Sin conservación, una muestra sólida puede sufrir un cambio en la composición debido a la pérdida de material volátil, biodegradación o reactividad química (particularmente reacciones redox). El almacenamiento de muestras a temperaturas más bajas las hace menos propensas a la biodegradación y a la pérdida de material volátil, pero la fractura de sólidos y las separaciones de fases pueden presentar problemas. Para minimizar la pérdida de compuestos volátiles, el recipiente de muestra se llena completamente, eliminando un espacio de cabeza donde se acumulan los gases. Las muestras que no han sido expuestas a O 2 particularmente son susceptibles a reacciones de oxidación. Por ejemplo, se debe evitar que las muestras de sedimentos anaerobios entren en contacto con el aire.
Preparación de muestras
A diferencia de los gases y líquidos, que generalmente requieren poca preparación de la muestra, una muestra sólida generalmente necesita algún procesamiento antes del análisis. Hay dos razones para ello. Primero, como se discute en el Capítulo 7.2, la desviación estándar para el muestreo, s samp, es una función del número de partículas en la muestra, no de la masa combinada de las partículas. Para un material heterogéneo que consiste en partículas grandes, la muestra bruta puede ser demasiado grande para analizarla. Por ejemplo, un mineral portador de Ni con un tamaño promedio de partícula de 5 mm puede requerir una muestra que pese una tonelada para obtener una muestra razonable. Reducir el tamaño promedio de partícula de la muestra nos permite recolectar el mismo número de partículas con una masa más pequeña y manejable. Segundo, muchas técnicas analíticas requieren que el analito esté en solución.
Reducción del tamaño de partícula
Una reducción en el tamaño de partícula se logra triturando y moliendo la muestra bruta. Las partículas resultantes se mezclan a fondo y se dividen en submuestras de menor masa. Este proceso rara vez ocurre en un solo paso. En cambio, las submuestras se ciclan a través del proceso varias veces hasta obtener una muestra final de laboratorio.
La trituración y molienda utiliza fuerza mecánica para romper partículas más grandes en partículas más pequeñas. Se utilizan una variedad de herramientas dependiendo del tamaño y dureza de la partícula. Las partículas grandes se trituran usando trituradoras de mandíbulas que pueden reducir las partículas a diámetros de unos pocos milímetros. Se utilizan molinos de bolas, molinos de disco y morteros y majas para reducir aún más el tamaño de las partículas.
Un cambio significativo en la composición de la muestra bruta puede ocurrir durante la trituración y molienda. La disminución del tamaño de partícula aumenta el área de superficie disponible, lo que aumenta el riesgo de perder componentes volátiles. Este problema se ve agravado por el calor de fricción que acompaña a la trituración y molienda. El aumento de la superficie también expone partes interiores de la muestra a la atmósfera donde la oxidación puede alterar la composición bruta de la muestra. Otros problemas incluyen la contaminación de los materiales utilizados para triturar y moler la muestra, y las diferencias en la facilidad con que las partículas se reducen de tamaño. Por ejemplo, las partículas más blandas son más fáciles de reducir en tamaño y pueden perderse como polvo antes de procesar la muestra restante. Este es un problema particular si la distribución del analito entre diferentes tipos de partículas no es uniforme.
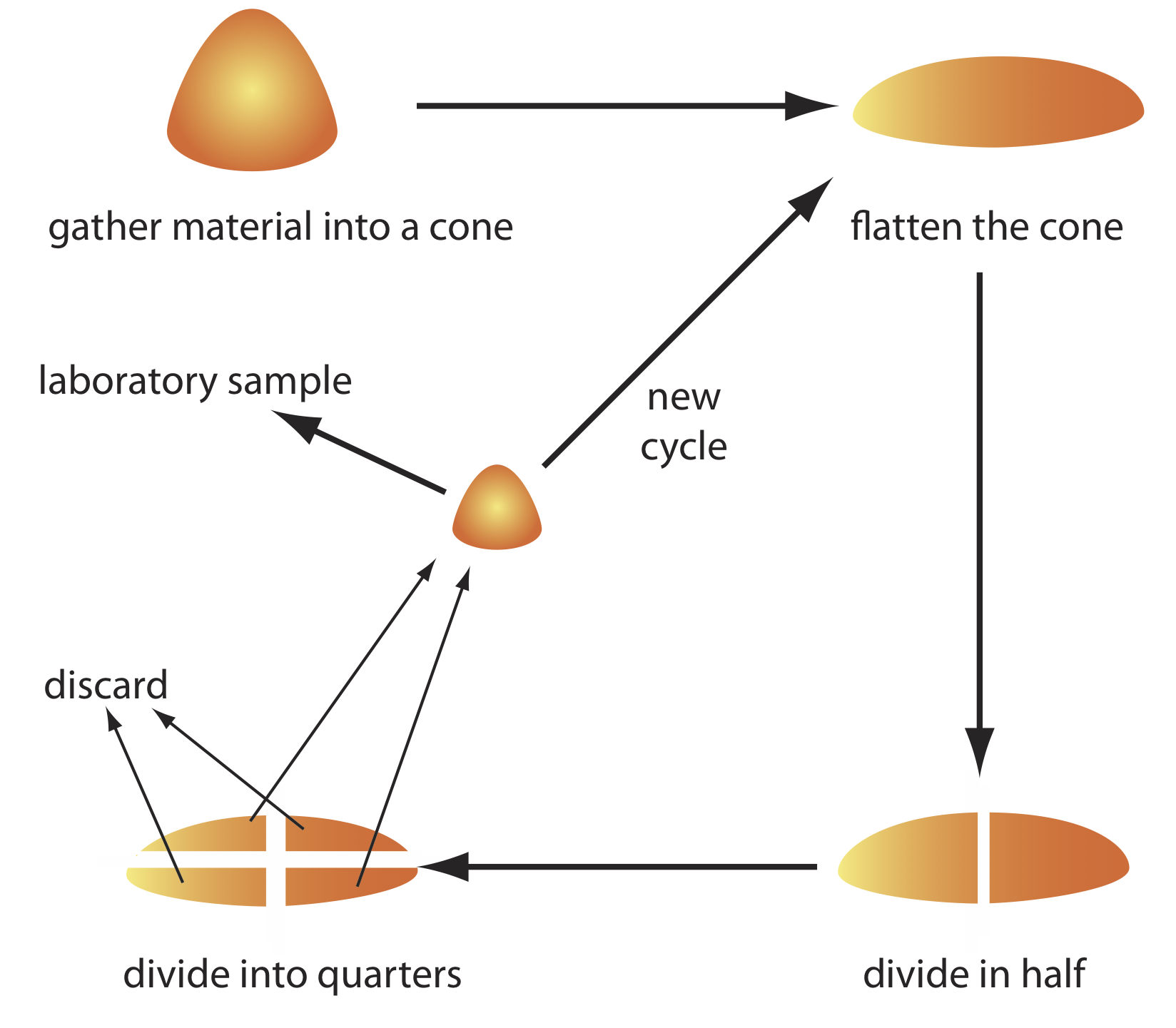
La muestra bruta se reduce a un tamaño de partícula uniforme pasándola intermitentemente a través de un tamiz. Aquellas partículas que no pasan por el tamiz reciben procesamiento adicional hasta que toda la muestra es de tamaño uniforme. El material resultante se mezcla a fondo para asegurar la homogeneidad y una submuestra obtenida con un riffle, o mediante c oning y acuartelamiento. Como se muestra en la Figura 7.3.6 , la muestra bruta se apila en un cono, se aplana y se divide en cuatro cuartos. Después de desechar dos cuartos diagonalmente opuestos, el material restante es ciclado a través del proceso de coning y cuarteado hasta que queda una muestra de laboratorio adecuada.
Llevar muestras sólidas a la solución
Si eres afortunado, tu muestra se disolverá fácilmente en un solvente adecuado, no requiriendo más esfuerzo que girar suavemente y calentando. El agua destilada suele ser el disolvente de elección para las sales inorgánicas, pero los disolventes orgánicos, como el metanol, el cloroformo y el tolueno, son útiles para materiales orgánicos.
Cuando una muestra es difícil de disolver, el siguiente paso es intentar digerirla con un ácido o una base. Table 7.3.2 enumera varios ácidos y bases comunes, y resume su uso. Las digestiones se realizan en un recipiente abierto, generalmente un vaso de precipitados, utilizando una placa caliente como fuente de calor. La principal ventaja de una digestión de recipiente abierto es el costo porque no requiere equipo especial. Los productos volátiles de reacción, sin embargo, se pierden, lo que resulta en un error determinado si incluyen el analito.
| solución | usos y propiedades |
|---|---|
|
HCl (37% p/p) |
|
|
HNO 3 (70% p/p) |
|
|
H 2 SO 4 (98% p/p) |
|
| HF (50% w/w) |
|
|
HClO 4 (70% w/w) |
|
|
HCl:HnO 3 (3:1 v/v) |
|
|
NaOH |
|
Muchas digestiones ahora se llevan a cabo en un recipiente cerrado utilizando la radiación de microondas como fuente de energía. Los recipientes para la digestión por microondas se fabrican con teflón (o algún otro fluoropolímero) o sílice fundida. Ambos materiales son térmicamente estables, químicamente resistentes, transparentes a la radiación de microondas y capaces de soportar presiones elevadas. Un recipiente típico de digestión por microondas, como se muestra en la Figura 7.3.7 , consiste en un cuerpo de recipiente aislado y una tapa con una válvula de alivio de presión. Los recipientes se colocan en un horno de microondas (un horno típico puede acomodar de 6 a 14 recipientes) y la energía de microondas se controla monitoreando la temperatura o presión dentro de uno de los recipientes.
 |
 |
Figura 7.3.7 . Unidad de digestión por microondas: a la izquierda hay una vista del interior de la unidad que muestra el carrusel que sostiene los vasos de digestión; a la derecha hay un primer plano de un recipiente de digestión de teflón, el cual está encerrado en una manga térmica. El valor de alivio de presión, que forma parte de la tapa azul del recipiente, contiene una membrana que se rompe si la presión interna se vuelve demasiado alta.
Las muestras inorgánicas que resisten la descomposición al digerir con ácidos o bases a menudo se ponen en solución fusionándose con un gran exceso de una sal de metal alcalino, llamada fundente. Después de mezclar la muestra y el fundente en un crisol, se calientan a estado fundido y se dejan enfriar lentamente a temperatura ambiente. La masa fundida resultante generalmente se disuelve fácilmente en agua destilada o ácido diluido. Table 7.3.3 resume varios flujos comunes y sus usos. La fusión funciona cuando otros métodos de descomposición no lo hacen debido a la alta temperatura y la alta concentración del flujo en el líquido fundido. Las desventajas incluyen la contaminación del fundente y el crisol, y la pérdida de materiales volátiles.
| flujo | temperatura de fusión (o C) | crisol | muestras típicas |
|---|---|---|---|
| Na 2 CO 3 | 85 | Pt | silicatos, óxidos, fosfato, sulfuros |
| Li 2 B 4 O 7 | 930 | Pt, grafito | aluminosilicatos, carbontos |
| LiBo 2 | 845 | Pt, grafito | aluminosilicatos, carbonatos |
| NaOH | 318 | Au, Ag | silicatos, carburo de silicio |
| KOH | 380 | Au, Ag | silicatos, carburo de silicio |
| Na 2 O 2 | — | Ni | silicatos, aceros al cromo, aleaciones de Pt |
| K 2 S 2 O 7 | 300 | Ni, porcelana | óxidos |
| B 2 O 3 | 577 | Pt | silicatos, óxidos |
Finalmente, podemos descomponer materiales orgánicos por cenizas secas. En este método la muestra se coloca en un crisol adecuado y se calienta sobre una llama o en un horno. El carbono presente en la muestra se oxida a CO 2, y el hidrógeno, azufre y nitrógeno se volatilizan como H 2 O, SO 2 y N 2. Estos gases pueden ser atrapados y pesados para determinar su concentración en el material orgánico. A menudo, el objetivo de la ceniza seca es eliminar el material orgánico, dejando atrás un residuo inorgánico, o ceniza, que pueda analizarse más a fondo.


