9.4: Covalencia Polar
- Page ID
- 70673
Asegúrese de comprender a fondo las siguientes ideas esenciales que se han presentado a continuación.
- Definir la electronegatividad, y describir la manera general en que las electronegatividades dependen de la ubicación de un elemento en la tabla periódica.
- Explicar cómo los valores de electronegatividad se relacionan con la naturaleza polar de un enlace químico.
- ¿Qué dos factores determinan la magnitud de un momento dipolo eléctrico?
- Esboce diagramas estructurales que ilustren cómo la presencia de enlaces polares en una molécula puede aumentar o disminuir la magnitud del momento dipolar molecular.
- Calcular la carga formal de cada átomo en una estructura, y comentar su significación en relación con la polaridad de esa estructura.
- Seleccione la probabilidad más probable de dos o más estructuras de puntos de electrones para una especie dada.
- Explicar la diferencia entre la carga formal y el número de oxidación.
- Describir los casos limitantes de enlaces covalentes e iónicos. Explique lo que ambas categorías de bonos tienen en común.
Los electrones que constituyen un enlace químico son atraídos simultáneamente por los campos electrostáticos de los núcleos de los dos átomos unidos. En una molécula homonuclear como O 2 los electrones de enlace serán compartidos equitativamente por los dos átomos. En general, sin embargo, las diferencias en los tamaños y cargas nucleares de los átomos provocarán que uno de ellos ejerza una mayor atracción sobre el par de enlaces, provocando que la nube de electrones se desplace hacia el átomo más fuertemente atrayente.
Electronegatividad
La electronegatividad de un átomo denota su poder relativo de atracción de electrones en un enlace químico. Es importante entender que la electronegatividad no es una propiedad medible de un átomo en el sentido de que las energías de ionización y las afinidades electrónicas son, aunque puede correlacionarse con ambas propiedades. El poder real de atracción de electrones de un átomo depende en parte de su entorno químico (es decir, de qué otros átomos están unidos a él), por lo que las electronegatividades tabuladas deben considerarse como no más que predictores del comportamiento de los electrones, especialmente en moléculas más complicadas. Existen varias formas de computar las electronegatividades, las cuales se expresan a escala arbitraria. El concepto de electronegatividad fue introducido por Linus Pauling y su escala 0-4 sigue siendo la más utilizada.
La escala de electronegatividad 0-4 de Pauling es la más conocida de varias escalas arbitrarias de este tipo. Los valores de electronegatividad no son directamente observables, sino que se derivan de propiedades atómicas medibles como la energía de ionización y la afinidad electrónica. El lugar de cualquier átomo en esta escala proporciona una buena indicación de su capacidad para competir con otro átomo para atraer un par de electrones compartido hacia él, pero la presencia de enlaces a otros átomos, y de pares de electrones múltiples o no enlazantes puede hacer que las predicciones sobre la naturaleza de un enlace dado sean menos confiables.
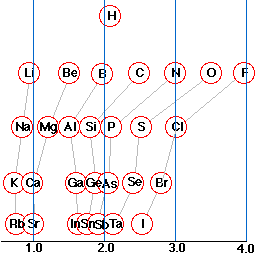
Se dice que un átomo que tiene una electronegatividad pequeña es electropositivo. Como muestra el diagrama, los elementos metálicos son generalmente electropositivos. Vale la pena señalar la posición del hidrógeno en este sentido; aunque físicamente un no metal, gran parte de su química es similar al metal.
Momentos dipolares
Cuando los átomos no idénticos se unen en un enlace covalente, el par de electrones será atraído más fuertemente hacia el átomo que tiene la electronegatividad más alta. En consecuencia, los electrones no se compartirán por igual; el centro de las cargas negativas en la molécula se desplazará del centro de carga positiva. Se dice que tales enlaces son polares y poseen carácter iónico parcial, y pueden conferir una naturaleza polar a la molécula como un todo.
Una molécula polar actúa como un dipolo eléctrico que puede interactuar con campos eléctricos que se crean artificialmente o que surgen de iones cercanos o moléculas polares. Los dipolos se representan convencionalmente como flechas que apuntan en la dirección del extremo negativo. La magnitud de la interacción con el campo eléctrico viene dada por el momento dipolo eléctrico permanente de la molécula. El momento dipolar correspondiente a un enlace individual (o a una molécula diatómica) viene dado por el producto de la cantidad de carga desplazada q y la longitud del enlace r:
\[μ = q \times r\]
En unidades SI, q se expresa en culombios y r en metros, por lo que μ tiene las dimensiones de\(C \cdot m\). Si una carga de electrones completa se desplaza 100pm (una longitud de enlace típica), entonces
\[μ = (1.6022 \times 10^{–19}\; C) \times (10^{–10}\; m) = 1.6 \times 10^{–29}\; C \cdot m = 4.8 \;D\]
La cantidad denotada por D, la unidad Debye, sigue siendo comúnmente utilizada para expresar momentos dipolares. Fue nombrado así por Peter Debye (1884-1966), el físico holandés-estadounidense que fue pionero en el estudio de los momentos dipolares y de las interacciones eléctricas entre partículas; ganó el Premio Nobel de Química en 1936.

Cómo se miden los momentos dipolares
Cuando se coloca una solución de moléculas polares entre dos placas con carga opuesta, tenderán a alinearse a lo largo de la dirección del campo. Este proceso consume energía que se devuelve al circuito eléctrico cuando se apaga el campo, un efecto conocido como capacitancia eléctrica.
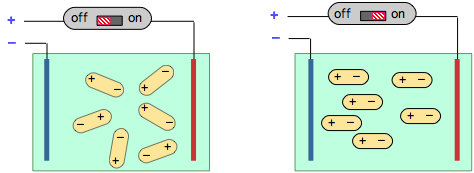
La medición de la capacitancia de un gas o solución es fácil de llevar a cabo y sirve como medio para determinar la magnitud del momento dipolar de una sustancia.
Estimar el porcentaje de carácter iónico del enlace en la molécula de fluoruro de hidrógeno a partir de los datos experimentales mostrados a la derecha.
Solución
Momentos dipolares como sumas vectoriales
En las moléculas que contienen más de un enlace polar, el momento dipolar molecular es solo la combinación vectorial de lo que puede considerarse como “momentos dipolares de enlace” individuales. Al ser vectores, estos pueden reforzarse o cancelarse entre sí, dependiendo de la geometría de la molécula; por lo tanto, no es raro que las moléculas que contienen enlaces polares sean no polares en general, como en el ejemplo del dióxido de carbono:
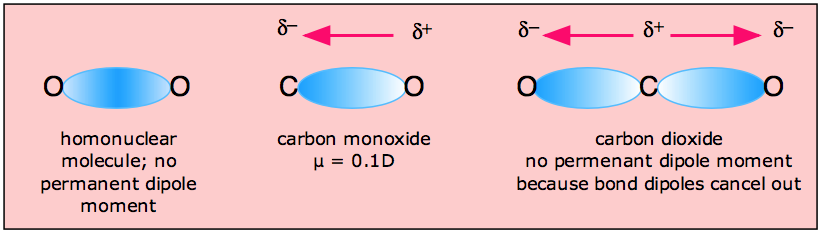
El momento dipolo cero del CO 2 es uno de los métodos experimentales más simples para demostrar la forma lineal de esta molécula.
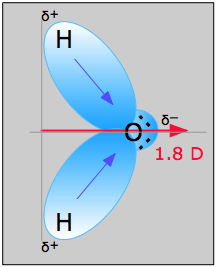
H 2 O, por el contrario, tiene un momento dipolar muy grande que resulta de los dos componentes polares H-O orientados en un ángulo de 104.5°. Los pares no enlazantes sobre el oxígeno son un factor que contribuye a la alta polaridad de la molécula de agua. En las moléculas que contienen electrones no enlazantes o enlaces múltiples, la diferencia de elecronegatividad puede no predecir correctamente la polaridad del enlace. Un buen ejemplo de ello es el monóxido de carbono, en el que la carga negativa parcial reside en el carbono, como lo predice su carga formal negativa (abajo.)
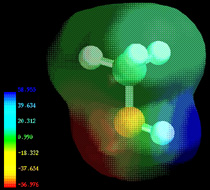
Las densidades de electrones en una molécula (y los momentos dipolares que las distribuciones de electrones desequilibradas pueden producir) ahora se calculan fácilmente mediante programas de modelado molecular. En este ejemplo, para metanol CH 3 OH, el área azul centrada en hidrógeno representa una carga positiva, el área roja centrada donde esperamos que se localicen los pares solitarios representa una carga negativa, mientras que el verde claro alrededor del metilo es aproximadamente neutro. La manera en que los enlaces individuales contribuyen al momento dipolar de la molécula está muy bien ilustrada por la serie de clorometanos:
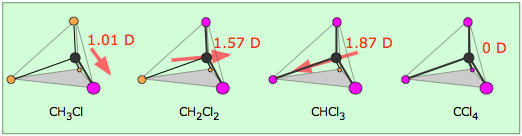
(Tenga en cuenta que las cuatro posiciones alrededor del átomo de carbono son equivalentes en esta molécula tetraédrica, por lo que sólo hay cuatro clorometanos.)
Carga formal y número de oxidación
Aunque el número total de electrones de valencia en una molécula se calcula fácilmente, no siempre hay una manera simple e inequívoca de determinar cuántos residen en un enlace particular o como pares no enlazantes en un átomo particular. Por ejemplo, se pueden escribir estructuras de octeto de Lewis válidas para monóxido de carbono que muestren un doble o triple enlace entre los dos átomos, dependiendo de cuántos pares no enlazantes se coloquen en cada uno: C: :O::: y:C : ::O: (vea el Ejemplo de Problema 3 a continuación). La elección entre estructuras como estas suele ser fácil de hacer sobre el principio de que el átomo más electronegativo tiende a rodearse con el mayor número de electrones. En los casos en que la distinción entre estructuras competidoras no es del todo tan clara, una cantidad calculada arbitrariamente conocida como la carga formal a menudo puede servir de guía.
La carga formal sobre un átomo es la carga eléctrica que tendría si todos los electrones enlazantes fueran compartidos por igual con sus vecinos unidos.
La carga formal sobre un átomo se calcula mediante la siguiente fórmula:
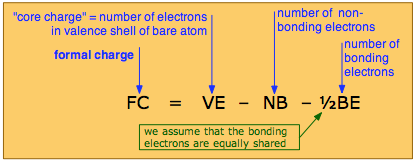
en el que la carga del núcleo es la carga eléctrica que tendría el átomo si se eliminaran todos sus electrones de valencia. En casos simples, la carga formal se puede elaborar visualmente directamente a partir de la estructura de Lewis, como se ilustra más adelante.
Encuentra las cargas formales de todos los átomos en la estructura de ácido sulfúrico que se muestra aquí.
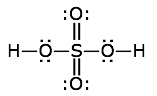
Solución
Los átomos aquí son hidrógeno, azufre y oxígenos de enlace doble y simple. Recuerda que un doble enlace está conformado por dos pares de electrones.
- hidrógeno: FC = 1 — 0 — 1 = 0
- azufre: FC = 6 — 0 — 6 = 0
- oxígeno hidroxilo: FC = 6 — 4 — 2 = 0
- oxígeno de doble enlace: FC = 6 — 4 — 2 = 0
Uso de carga formal para seleccionar la mejor estructura de Lewis
La regla general para elegir entre estructuras alternativas es que la que involucra los cargos formales más pequeños es la más favorecida, aunque el siguiente ejemplo muestra que no siempre es así.
Redactar algunas estructuras para el monóxido de carbono CO, tanto las que obedecen como las que no obedecen la regla del octeto, y seleccionar la “mejor” en base a los cargos formales.
Solución
Estructura que obedece a la regla del octeto:
a) Para:C : ::O: Carbono: 4 — 2 — 3 = —1; Oxígeno: 6 — 2 — 3 = +1
Estructuras que no obedecen a la regla del octeto (para el carbono):
b) Para:C:O::: Carbono: 4 — 2 — 1 = +1; Oxígeno: 6 — 6 — 1 = —1
c) Para:C: :O:: Carbono: 4 — 2 —2 = 0; Oxígeno: 6 — 4 — 2 = 0
Comentario: Las tres estructuras son aceptables (porque las cargas formales suman cero para esta molécula neutra) y contribuyen a la estructura general del monóxido de carbono, aunque no por igual. Tanto los modelos experimentales como los más avanzados muestran que predomina la forma de triple unión (a). La carga formal, que no es más que un esquema de contabilidad para los electrones, es por sí misma incapaz de predecir este hecho.
En una especie como el ión tiocianato\(SCN^-\) en la que se pueden escribir dos estructuras que tienen las mismas cargas formales mínimas, esperaríamos que predomine aquella en la que la carga negativa está en el átomo más electronegativo.
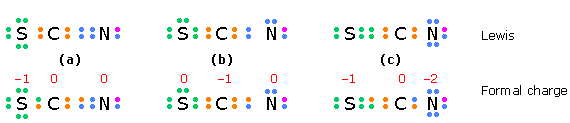
Los electrones en las estructuras de la fila superior son los electrones de valencia para cada átomo; un electrón adicional (púrpura) completa el octeto de nitrógeno en este ion negativo. Los electrones en la fila inferior se dividen en partes iguales entre los átomos unidos; la diferencia entre estos números y los anteriores da las cargas formales.
El cargo formal también puede ayudar a responder la pregunta “¿dónde se encuentra el cargo?” que se pregunta frecuentemente sobre los iones poliatómicos. Así, al escribir la estructura de Lewis para el ion amonio NH 4 +, deberías poder convencerte de que el átomo de nitrógeno tiene una carga formal de +1 y cada uno de los hidrógenos tiene 0, por lo que podemos decir que la carga positiva está localizada en el átomo central.
Número de oxidación
Esta es otra forma arbitraria de caracterizar los átomos en las moléculas. A diferencia de la carga formal, en la que se supone que los electrones en un enlace se comparten por igual, el número de oxidación es la carga eléctrica que tendría un átomo si los electrones de enlace fueran asignados exclusivamente al átomo más electronegativo. El número de oxidación sirve principalmente como una herramienta para realizar un seguimiento de los electrones en las reacciones en las que se intercambian entre reactivos, y para caracterizar el “poder combinante” de un átomo en una molécula o ion.
El siguiente diagrama compara la forma en que los electrones se asignan a los átomos en el cálculo de la carga formal y el número de oxidación en monóxido de carbono.
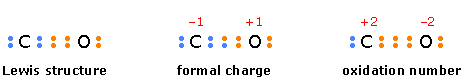
Compuestos iónicos
El modelo de pares de electrones compartidos introducido por G.N. Lewis mostró cómo se podrían formar enlaces químicos en ausencia de atracción electrostática entre iones con carga opuesta. Como tal, se ha convertido en el modelo de unión más popular y generalmente útil en todas las sustancias que no sean los metales. Un enlace químico ocurre cuando los electrones son atraídos simultáneamente a dos núcleos, actuando así para unirlos en una disposición energéticamente estable. El enlace covalente se forma cuando dos átomos son capaces de compartir un par de electrones:

En general, sin embargo, diferentes tipos de átomos ejercen diferentes grados de atracción sobre sus electrones, por lo que en la mayoría de los casos el reparto no será igual. Incluso se puede imaginar un caso extremo en el que el compartir es tan desigual que la “molécula” resultante es simplemente un par de iones:

A veces se dice que la sustancia resultante contiene un enlace iónico. De hecho, las propiedades de una serie de compuestos pueden explicarse adecuadamente utilizando el modelo iónico. Pero, ¿significa esto que realmente hay dos tipos de enlaces químicos, iónicos y covalentes? Según el modelo electrostático iónico, los sólidos como el NaCl consisten en iones positivos y negativos dispuestos en una red cristalina. Cada ion es atraído por iones vecinos de carga opuesta, y es repelido por iones de carga similar; esta combinación de atracciones y repulsiones, actuando en todas las direcciones, hace que el ion se fije firmemente en su propia ubicación en la red cristalina.
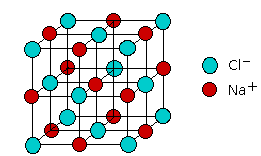
Dado que las fuerzas electrostáticas son no direccionales, la estructura de un sólido iónico está determinada puramente por la geometría: dos tipos de iones, cada uno con su propio radio, caerán en cualquier patrón de repetición que logre la menor energía potencial posible. Sorprendentemente, solo hay un pequeño número de estructuras posibles; aquí se muestra una de las más comunes, la simple celosía cúbica de NaCl.
¿Hay tal cosa como un enlace iónico?
Cuando dos elementos forman un compuesto iónico, ¿realmente se pierde un electrón por un átomo y se transfiere al otro? Para tratar esta cuestión, considere los datos sobre el LiF sólido iónico. El radio promedio del átomo de Li neutro es de aproximadamente 2.52Å. Ahora bien, si este átomo de Li reacciona con un átomo de F para formar LiF, ¿cuál es la distancia promedio entre el núcleo de Li y el electrón que ha “perdido” al átomo de flúor? La respuesta es 1.56Å; ¡el electrón está ahora más cerca del núcleo de litio que en litio neutro!
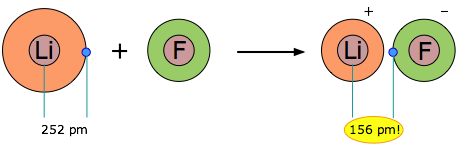
Entonces, la respuesta a la pregunta anterior es a la vez sí y no: sí, el electrón que ahora estaba en el orbital de 2 s de Li está ahora al alcance de un orbital de flúor 2p, pero no, el electrón ahora está aún más cerca del núcleo Li que antes, entonces, ¿cómo se puede “perder”? Lo único que es indiscutiblemente cierto sobre LiF es que hay más electrones más cerca de núcleos positivos que en los átomos de Li y F separados. Pero esta es solo la regla que afirmamos al inicio de esta unidad: los enlaces químicos se forman cuando los electrones pueden estar simultáneamente cerca de dos o más núcleos.
Es obvio que el enlace electrón-par provoca esta situación, y esta es la razón de la estabilidad del enlace covalente. Lo que no es tan obvio (hasta que mires los números como los citados para LiF arriba) es que el enlace “iónico” da como resultado la misma condición; incluso en los compuestos más altamente iónicos, ambos electrones están cerca de ambos núcleos, y las atracciones mutuas resultantes unen los núcleos entre sí. Siendo este el caso, ¿existe realmente alguna diferencia fundamental entre el enlace iónico y el enlace covalente?
La respuesta, según el pensamiento químico moderno es probablemente “no”; de hecho, hay alguna duda de si es realista considerar que estos sólidos consisten en “iones” en el sentido habitual. La imagen preferida que parece estar emergiendo es aquella en la que los orbitales de electrones de pares de átomos adyacentes están simplemente sesgados para colocar más densidad de electrones alrededor del elemento “negativo” que alrededor del “positivo”.
Dicho esto, hay que reiterar que el modelo iónico de unión es útil para muchos propósitos, y no hay nada de malo en usar el término “enlace iónico” para describir las interacciones entre los átomos en la clase muy pequeña de “sólidos iónicos” como LiF y NaCl.
¡“Covalente, iónico o metálico” es una sobresimplificación!
Si no existe tal cosa como un enlace “completamente iónico”, ¿podemos tener uno que sea completamente covalente? La respuesta es sí, si los dos núcleos tienen iguales poderes de atracción de electrones. Esta situación está garantizada para ser el caso de las moléculas diatómicas homonucleares, moléculas que constan de dos átomos idénticos. Así, en Cl 2, O 2 y H 2, el intercambio de electrones entre los dos átomos idénticos debe ser exactamente uniforme; en tales moléculas, el centro de carga positiva corresponde exactamente al centro de carga negativa: a medio camino entre los dos núcleos.
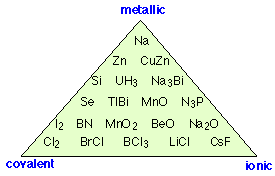
La categorización de todos los enlaces químicos como iónicos, covalentes o metálicos es una gran simplificación excesiva; como muestra este diagrama, hay ejemplos de sustancias que presentan diversos grados de las tres características de unión.
Enlaces covalentes dativos (coordinados)
En la mayoría de los enlaces covalentes, pensamos que el par de electrones tiene un doble parentesco, siendo aportado un electrón por cada átomo. Hay, sin embargo, muchos casos en los que ambos electrones provienen de un solo átomo. Esto puede suceder si el átomo donante tiene un par de electrones no enlazantes y el átomo aceptor tiene un orbital completamente vacío que puede acomodarlos. Estos se denominan enlaces covalentes dativos o coordinados.
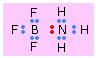
Este es el caso, por ejemplo, con trifluoruro de boro y amoníaco. En BF 3, uno de los orbitales 2p está desocupado y puede acomodar al par solitario en el átomo de nitrógeno del amoníaco. El aceptor de electrones, BF 3, actúa aquí como un ácido de Lewis, y NH 3 es la base de Lewis. Los enlaces de este tipo (a veces conocidos como enlaces covalentes coordinados o dativos) tienden a ser bastante débiles (generalmente 50-200kJ/mol); en muchos casos las dos unidades unidas conservan suficiente individualidad para justificar escribir la fórmula como un complejo molecular o aducto.


