1.4: Mediciones
- Page ID
- 75662
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)
- Explicar el proceso de medición y describir las tres partes básicas de una cantidad.
- Describir las propiedades y unidades de longitud, masa, volumen, densidad, temperatura y tiempo.
- Reconocer los prefijos de unidad comunes y utilizarlos para describir la magnitud de una medida.
- Describir y calcular la densidad de una sustancia.
- Realizar cálculos y conversiones unitarias básicas en el sistema métrico y otros sistemas unitarios.
Las mediciones proporcionan la información macroscópica que es la base de la mayoría de las hipótesis, teorías y leyes que describen el comportamiento de la materia y la energía tanto en los dominios macroscópicos como microscópicos de la química. Cada medición proporciona tres tipos de información: el tamaño o magnitud de la medición (un número); un estándar de comparación para la medición (una unidad); y una indicación de la incertidumbre de la medición. Si bien el número y la unidad se representan explícitamente cuando se escribe una cantidad, la incertidumbre es un aspecto del resultado de medición que se representa más implícitamente y se discutirá más adelante.
El número en la medición se puede representar de diferentes maneras, incluyendo la forma decimal y la notación científica. Por ejemplo, el peso máximo de despegue de un avión Boeing 777-200ER es de 298,000 kilogramos, lo que también puede escribirse como 2.98\(\times\) 10 5 kg. La masa del mosquito promedio es de aproximadamente 0.0000025 kilogramos, que puede escribirse como 2.5\(\times\) 10 −6 kg.
Unidades, como litros, libras y centímetros, son estándares de comparación para las mediciones. Cuando compramos una botella de 2 litros de un refresco, esperamos que se midiera el volumen de la bebida, por lo que es dos veces mayor que el volumen que todos aceptan que sea de 1 litro. Se mide la carne utilizada para preparar una hamburguesa de 0.25 libras por lo que pesa un cuarto tanto como 1 libra. Sin unidades, un número puede ser sin sentido, confuso o posiblemente potencialmente mortal. Supongamos que un médico le receta fenobarbital para controlar las convulsiones de un paciente y establece una dosis de “100” sin especificar unidades. Esto no sólo será confuso para el profesional médico que administra la dosis, sino que las consecuencias pueden ser nefastas: 100 mg dados tres veces al día pueden ser efectivos como anticonvulsivo, pero una sola dosis de 100 g es más de 10 veces la cantidad letal.
Generalmente reportamos los resultados de las mediciones científicas en unidades SI, una versión actualizada del sistema métrico, utilizando las unidades listadas en la Tabla\(\PageIndex{1}\). Otras unidades se pueden derivar de estas unidades base. Los estándares para estas unidades se fijan por acuerdo internacional, y se denominan Sistema Internacional de Unidades o Unidades SI (del francés, Le Système International d'Unités). Las unidades SI han sido utilizadas por el Instituto Nacional de Estándares y Tecnología de los Estados Unidos (NIST) desde 1964.
| Propiedad medida | Nombre de la Unidad | Símbolo de Unidad |
|---|---|---|
| longitud | medidor | m |
| masa | kilogramo | kg |
| tiempo | segundo | s |
| temperatura | kelvin | K |
| corriente eléctrica | amperio | A |
| cantidad de sustancia | mole | mol |
| intensidad luminosa | candela | cd |
En ocasiones utilizamos unidades que son fracciones o múltiplos de una unidad base. El helado se vende en cuartos de galón (una unidad familiar, no base SI), pintas (0.5 cuartos de galón) o galones (4 cuartos de galón). También utilizamos fracciones o múltiplos de unidades en el sistema SI, pero estas fracciones o múltiplos son siempre potencias de 10. Las unidades SI fraccionarias o múltiples se nombran usando un prefijo y el nombre de la unidad base. Por ejemplo, una longitud de 1000 metros también se llama kilómetro porque el prefijo kilo significa “mil”, que en notación científica es 10 3 (1 kilómetro = 1000 m = 10 3 m). Los prefijos utilizados y las potencias a las que se elevan 10 se listan en la Tabla\(\PageIndex{2}\).
NG, equivale a 4 veces diez al negativo 9, o 0.000000004 g El prefijo micro tiene como símbolo la letra griega mu y un factor de 10 a la sexta potencia negativa. Por lo tanto, 1 microlitro, o mu L, es igual a uno por diez al negativo 6 o 0.000001 L. El prefijo milli tiene una M minúscula como símbolo y un factor de 10 a la tercera potencia negativa. Por lo tanto, 2 milimoles, o M mol, son iguales a dos veces diez al negativo 3 o 0.002 mol. El prefijo centi tiene una C minúscula como símbolo y un factor de 10 a la segunda potencia negativa. Por lo tanto, 7 centímetros, o C M, son iguales a siete veces diez a los 2 metros negativos o 0.07 M O L. El prefijo deci tiene una D minúscula como símbolo y un factor de 10 a la primera potencia negativa. Por lo tanto, 1 decilitro, o minúscula D mayúscula L, son iguales a uno por diez al negativo 1 metros o 0.1 L. El prefijo kilo tiene una K minúscula como símbolo y un factor de 10 a la tercera potencia. Por lo tanto, 1 kilómetro, o K M, es igual a uno por diez a los terceros metros o 1000 M. El prefijo mega tiene una M mayúscula como símbolo y un factor de 10 a la sexta potencia. Por lo tanto, 3 megahercios, o M H Z, son iguales a tres veces 10 al sexto hercio, o 3000000 H Z. El prefijo giga tiene una G mayúscula como símbolo y un factor de 10 a la novena potencia. Por lo tanto, 8 gigayears, o G Y R, son iguales a ocho veces 10 a los noveno años, o 800000000 G Y R. El prefijo tera tiene una T mayúscula como símbolo y un factor de 10 a la duodécima potencia. Por lo tanto, 5 teravatios, o T W, son iguales a cinco por 10 a los duodécimo vatios, o 5000000000000 W.” data-quail-id="64" data-mt-width="1076">
| Prefijo | Símbolo | Factor | Ejemplo |
|---|---|---|---|
| femto | f | 10 −15 | 1 femtosec ond (fs) = 1\(\times\) 10 −15 s (0.000000000000001 s) |
| pico | p | 10 −12 | 1 picómetro (pm) = 1\(\times\) 10 −12 m (0.000000000001 m) |
| nano | n | 10 −9 | 4 nanogramos (ng) = 4\(\times\) 10 −9 g (0.000000004 g) |
| micro | µ | 10 −6 | 1 microlitro (μL) = 1\(\times\) 10 −6 L (0.000001 L) |
| milli | m | 10 −3 | 2 milimoles (mmol) = 2\(\times\) 10 −3 mol (0.002 mol) |
| centi | c | 10 −2 | 7 centímetros (cm) = 7\(\times\) 10 −2 m (0.07 m) |
| deci | d | 10 −1 | 1 decilitro (dL) = 1\(\times\) 10 −1 L (0.1 L) |
| kilo | k | 10 3 | 1 kilómetro (km) = 1\(\times\) 10 3 m (1000 m) |
| mega | M | 10 6 | 3 megahercios (MHz) = 3\(\times\) 10 6 Hz (3,000,000 Hz) |
| giga | G | 10 9 | 8 gigayears (Gyr) = 8\(\times\) 10 9 año (8,000,000,000 Gyr) |
| tera | T | 10 12 | 5 teravatios (TW) = 5\(\times\) 10 12 W (5,000,000,000,000 W) |
Unidades Base SI
Las unidades iniciales del sistema métrico, que finalmente evolucionaron al sistema SI, se establecieron en Francia durante la Revolución Francesa. Los estándares originales para el medidor y el kilogramo fueron adoptados allí en 1799 y eventualmente por otros países. Esta sección presenta cuatro de las unidades base SI comúnmente utilizadas en química. Otras unidades del SI se introducirán en capítulos posteriores.
Largo
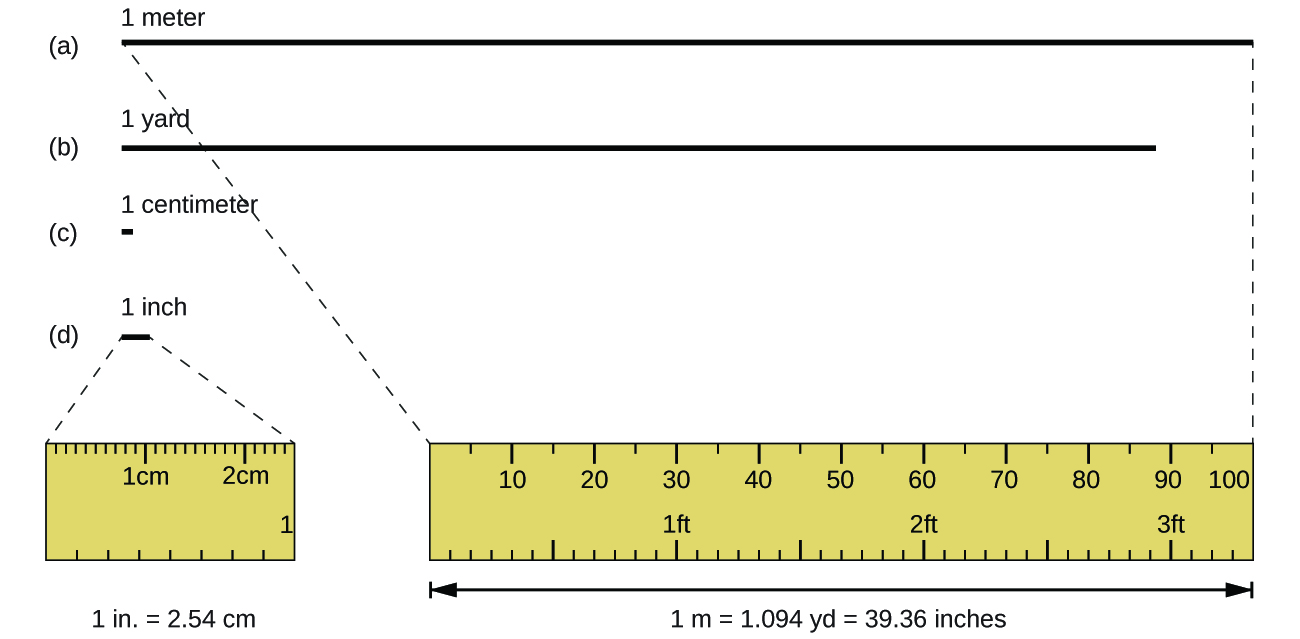
La unidad estándar de longitud tanto en el SI como en los sistemas métricos originales es el metro (m). Un metro se especificó originalmente como 1/10,000,000 de la distancia desde el Polo Norte hasta el ecuador. Ahora se define como la distancia que recorre la luz en un vacío en 1/299,792,458 de segundo. Un metro es aproximadamente 3 pulgadas más largo que una yarda (Figura\(\PageIndex{1}\)); un metro mide aproximadamente 39.37 pulgadas o 1.094 yardas. Las distancias más largas a menudo se reportan en kilómetros (1 km = 1000 m = 10 3 m), mientras que las distancias más cortas se pueden reportar en centímetros (1 cm = 0.01 m = 10 −2 m) o milímetros (1 mm = 0.001 m = 10 −3 m).
Masa
La unidad de masa estándar en el sistema SI es el kilogramo (kg). Un kilogramo se definió originalmente como la masa de un litro de agua (un cubo de agua con una longitud de borde de exactamente 0.1 metro). Ahora se define por cierto cilindro de aleación de platino-iridio, que se mantiene en Francia (Figura 1.4.2). Se dice que cualquier objeto con la misma masa que este cilindro tiene una masa de 1 kilogramo. Un kilogramo es de aproximadamente 2.2 libras. El gramo (g) es exactamente igual a 1/1000 de la masa del kilogramo (10 −3 kg).

Temperatura
La temperatura es una propiedad intensiva. La unidad de temperatura SI es el kelvin (K). La convención de la IUPAC consiste en utilizar kelvin (todas minúsculas) para la palabra, K (mayúsculas) para el símbolo de unidad, y ni la palabra “grado” ni el símbolo de grado (°). El grado Celsius (°C) también está permitido en el sistema SI, con tanto la palabra “grado” como el símbolo de grado utilizados para las mediciones de Celsius. Los grados centígrados son de la misma magnitud que los de kelvin, pero las dos escalas colocan sus ceros en diferentes lugares. El agua se congela a 273.15 K (0 °C) y hierve a 373.15 K (100 °C) por definición, y la temperatura normal del cuerpo humano es de aproximadamente 310 K (37 °C). La conversión entre estas dos unidades y la escala Fahrenheit se discutirá más adelante en este capítulo.
Tiempo
La unidad de tiempo base SI es la segunda (s). Los intervalos de tiempo pequeños y grandes se pueden expresar con los prefijos apropiados; por ejemplo, 3 microsegundos = 0.000003 s = 3\(\times\) 10 −6 y 5 megaseconds = 5,000,000 s = 5\(\times\) 10 6 s. Alternativamente, se pueden usar horas, días y años.
Unidades SI Derivadas
Podemos derivar muchas unidades de las siete unidades base SI. Por ejemplo, podemos usar la unidad base de longitud para definir una unidad de volumen, y las unidades base de masa y longitud para definir una unidad de densidad.
Volumen
El volumen es la medida de la cantidad de espacio ocupado por un objeto. La unidad de volumen SI estándar se define por la unidad base de longitud (Figura\(\PageIndex{3}\)). El volumen estándar es un metro cúbico (m 3), un cubo con una longitud de borde de exactamente un metro. Para dispensar un metro cúbico de agua, podríamos construir una caja cúbica con longitudes de borde de exactamente un metro. Esta caja contendría un metro cúbico de agua o cualquier otra sustancia.
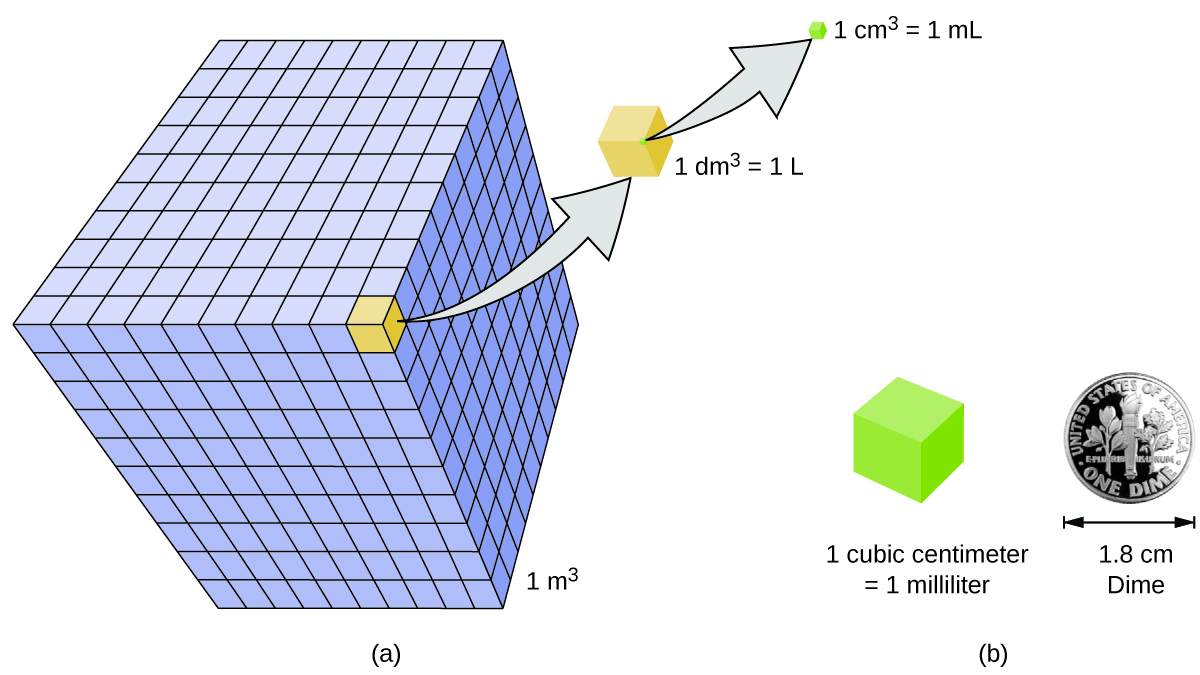
Una unidad de volumen más utilizada se deriva del decímetro (0.1 m, o 10 cm). Un cubo con longitudes de borde de exactamente un decímetro contiene un volumen de un decímetro cúbico (dm 3). Un litro (L) es el nombre más común para el decímetro cúbico. Un litro es de aproximadamente 1.06 cuartos de galón. Un centímetro cúbico (cm 3) es el volumen de un cubo con una longitud de borde de exactamente un centímetro. La abreviatura cc (para c ubic c entimeter) suele ser utilizada por profesionales de la salud. Un centímetro cúbico también se llama mililitro (mL) y es 1/1000 de litro.
Densidad
Utilizamos la masa y el volumen de una sustancia para determinar su densidad. Así, las unidades de densidad se definen por las unidades base de masa y longitud.
La densidad de una sustancia es la relación entre la masa de una muestra de la sustancia y su volumen. La unidad SI para densidad es el kilogramo por metro cúbico (kg/m 3). Para muchas situaciones, sin embargo, esto como una unidad inconveniente, y a menudo usamos gramos por centímetro cúbico (g/cm 3) para las densidades de sólidos y líquidos, y gramos por litro (g/L) para gases. Aunque hay excepciones, la mayoría de los líquidos y sólidos tienen densidades que van desde aproximadamente 0.7 g/cm 3 (la densidad de la gasolina) hasta 19 g/cm 3 (la densidad del oro). La densidad del aire es de aproximadamente 1.2 g/L.\(\PageIndex{3}\) La tabla muestra las densidades de algunas sustancias comunes.
| Sólidos | Líquidos | Gases (a 25 °C y 1 atm) |
|---|---|---|
| hielo (a 0 °C) 0.92 g/cm 3 | agua 1.0 g/cm 3 | aire seco 1.20 g/L |
| roble (madera) 0.60—0.90 g/cm 3 | etanol 0.79 g/cm 3 | oxígeno 1.31 g/L |
| hierro 7.9 g/cm 3 | acetona 0.79 g/cm 3 | nitrógeno 1.14 g/L |
| cobre 9.0 g/cm 3 | glicerina 1.26 g/cm 3 | dióxido de carbono 1.80 g/L |
| plomo 11.3 g/cm 3 | aceite de oliva 0.92 g/cm 3 | helio 0.16 g/L |
| plata 10.5 g/cm 3 | gasolina 0.70—0.77 g/cm 3 | neón 0.83 g/L |
| oro 19.3 g/cm 3 | mercurio 13.6 g/cm 3 | radón 9.1 g/L |
Si bien hay muchas formas de determinar la densidad de un objeto, quizás el método más sencillo consiste en encontrar por separado la masa y el volumen del objeto, y luego dividir la masa de la muestra por su volumen. En el siguiente ejemplo, la masa se encuentra directamente pesando, pero el volumen se encuentra indirectamente a través de mediciones de longitud.
\[\mathrm{density=\dfrac{mass}{volume}} \nonumber \]
Cálculo de Densidad El oro, en ladrillos, barras y monedas, ha sido una forma de moneda durante siglos. Para engañar a la gente para que paguen por un ladrillo de oro sin invertir realmente en un ladrillo de oro, la gente ha considerado llenar los centros de ladrillos huecos de oro con plomo para engañar a los compradores para que piensen que todo el ladrillo es oro. No funciona: El plomo es una sustancia densa, pero su densidad no es tan grande como la del oro, 19.3 g/cm 3. ¿Cuál es la densidad del plomo si un cubo de plomo tiene una longitud de borde de 2.00 cm y una masa de 90.7 g?
Solución
La densidad de una sustancia se puede calcular dividiendo su masa por su volumen. El volumen de un cubo se calcula cubicando la longitud del borde.
\[\mathrm{volume\: of\: lead\: cube=2.00\: cm\times2.00\: cm\times2.00\: cm=8.00\: cm^3} \nonumber \]
\[\mathrm{density=\dfrac{mass}{volume}=\dfrac{90.7\: g}{8.00\: cm^3}=\dfrac{11.3\: g}{1.00\: cm^3}=11.3\: g/cm^3} \nonumber \]
(Discutiremos el motivo del redondeo al primer decimal en la siguiente sección.)
- A tres decimales, ¿cuál es el volumen de un cubo (cm 3) con una longitud de borde de 0.843 cm?
- Si el cubo en la parte (a) es de cobre y tiene una masa de 5.34 g, ¿cuál es la densidad del cobre a dos decimales?
- Contestar a
-
0.599 cm 3;
- Respuesta b
-
8.91 g/cm 3
Esta simulación PhET ilustra otra forma de determinar la densidad, utilizando el desplazamiento del agua. Determinar la densidad de los bloques rojo y amarillo.
Solución
Cuando abres la simulación de densidad y seleccionas Misma Masa, puedes elegir entre varios bloques de colores de 5.00 kg que puedes dejar caer en un tanque que contiene 100.00 L de agua. El bloque amarillo flota (es menos denso que el agua), y el nivel del agua sube a 105.00 L. Mientras flota, el bloque amarillo desplaza 5.00 L de agua, cantidad igual al peso del bloque. El bloque rojo se hunde (es más denso que el agua, que tiene densidad = 1.00 Kg/L), y el nivel del agua sube a 101.25 L.
Por lo tanto, el bloque rojo desplaza 1.25 L de agua, una cantidad igual al volumen del bloque. La densidad del bloque rojo es:
\[\mathrm{density=\dfrac{mass}{volume}=\dfrac{5.00\: kg}{1.25\: L}=4.00\: kg/L} \nonumber \]
Tenga en cuenta que dado que el bloque amarillo no está completamente sumergido, no se puede determinar su densidad a partir de esta información. Pero si sostienes el bloque amarillo en el fondo del tanque, el nivel del agua sube a 110.00 L, lo que significa que ahora desplaza 10.00 L de agua, y su densidad se puede encontrar:
\[\mathrm{density=\dfrac{mass}{volume}=\dfrac{5.00\: kg}{10.00\: L}=0.500\: kg/L} \nonumber \]
Retire todos los bloques del agua y agregue el bloque verde al tanque de agua, colocándolo aproximadamente en el medio del tanque. Determinar la densidad del bloque verde.
- Contestar
-
2.00 Kg/L
Resumen
Las mediciones proporcionan información cuantitativa que es crítica en el estudio y la práctica de la química. Cada medición tiene una cantidad, una unidad de comparación y una incertidumbre. Las mediciones se pueden representar en notación decimal o científica. Los científicos utilizan principalmente el SI (Sistema Internacional) o sistemas métricos. Utilizamos unidades SI base como metros, segundos y kilogramos, así como unidades derivadas, como litros (para volumen) y g/cm 3 (para densidad). En muchos casos, nos resulta conveniente usar prefijos unitarios que producen unidades fraccionarias y múltiples, como microsegundos (10 −6 segundos) y megahercios (10 6 hercios), respectivamente.
Ecuaciones Clave
- \(\mathrm{density=\dfrac{mass}{volume}}\)
Glosario
- Celsius (°C)
- unidad de temperatura; el agua se congela a 0 °C y hierve a 100 °C en esta escala
- centímetro cúbico (cm 3 o cc)
- volumen de un cubo con una longitud de borde de exactamente 1 cm
- metro cúbico (m 3)
- Unidad SI de volumen
- densidad
- relación de masa a volumen para una sustancia u objeto
- Kelvin (K)
- Unidad de temperatura SI; 273.15 K = 0 ºC
- kilogramo (kg)
- Unidad de masa estándar SI; 1 kg = aproximadamente 2.2 libras
- longitud
- medida de una dimensión de un objeto
- litro (L)
- (también, decímetro cúbico) unidad de volumen; 1 L = 1,000 cm 3
- metro (m)
- unidad métrica estándar y SI de longitud; 1 m = aproximadamente 1.094 yardas
- mililitro (mL)
- 1/1,000 de litro; igual a 1 cm 3
- segundo (s)
- SI unidad de tiempo
- Unidades SI (Sistema Internacional de Unidades)
- normas fijadas por convenio internacional en el Sistema Internacional de Unidades (Le Système International d'Unités)
- unidad
- estándar de comparación para mediciones
- volumen
- cantidad de espacio ocupado por un objeto


