9.3: Estequiometría de Sustancias Gaseosas, Mezclas y Reacciones
- Page ID
- 75801
- Utilice la ley de gas ideal para calcular densidades de gas y masas molares
- Realizar cálculos estequiométricos que involucran sustancias gaseosas
- Ley estatal de Dalton de presiones parciales y utilizarla en cálculos que involucren mezclas gaseosas
El estudio del comportamiento químico de los gases formó parte de la base de quizás la revolución química más fundamental de la historia. El noble francés Antoine Lavoisier, ampliamente considerado como el “padre de la química moderna”, cambió la química de una ciencia cualitativa a una cuantitativa a través de su trabajo con gases. Descubrió la ley de conservación de la materia, descubrió el papel del oxígeno en las reacciones de combustión, determinó la composición del aire, explicó la respiración en términos de reacciones químicas, y más. Fue víctima de la Revolución Francesa, guillotinado en 1794. De su muerte, el matemático y astrónomo Joseph-Louis Lagrange dijo: “A la mafia le tomó solo un momento quitarle la cabeza; un siglo no bastará para reproducirla”.
Como se describe en un capítulo anterior de este texto, podemos recurrir a la estequiometría química para obtener respuestas a muchas de las preguntas que hacen “¿Cuánto?” Podemos responder a la pregunta con masas de sustancias o volúmenes de soluciones. No obstante, también podemos responder a esta pregunta de otra manera: con volúmenes de gases. Podemos usar la ecuación de gas ideal para relacionar la presión, el volumen, la temperatura y el número de moles de un gas. Aquí combinaremos la ecuación de gas ideal con otras ecuaciones para encontrar la densidad del gas y la masa molar. Nos ocuparemos de mezclas de diferentes gases, y calcularemos cantidades de sustancias en reacciones que involucren gases. Esta sección no introducirá ningún material o ideas nuevas, sino que brindará ejemplos de aplicaciones y formas de integrar conceptos que ya hemos comentado.
Densidad de un Gas
Recordemos que la densidad de un gas es su relación masa/volumen,\(ρ=\dfrac{m}{V}\). Por lo tanto, si podemos determinar la masa de algún volumen de un gas, obtendremos su densidad. La densidad de un gas desconocido puede utilizarse para determinar su masa molar y así ayudar en su identificación. La ley de gas ideal, PV = nRT, nos proporciona un medio para derivar tal fórmula matemática para relacionar la densidad de un gas con su volumen en la prueba que se muestra en el Ejemplo\(\PageIndex{1}\).
Usar PV = nRT para derivar una fórmula para la densidad del gas en g/L
S olución
\[PV = nRT \nonumber \]
Reorganizar para obtener (mol/L):
\[\dfrac{n}{v}=\dfrac{P}{RT} \nonumber \]
Multiplique cada lado de la ecuación por la masa molar,. Cuando los moles se multiplican por en g/mol, se obtienen g:
\[(ℳ)\left(\dfrac{n}{V}\right)=\left(\dfrac{P}{RT}\right)(ℳ) \nonumber \]
\[ℳ/V=ρ=\dfrac{Pℳ}{RT} \nonumber \]
Se encontró que un gas tenía una densidad de 0.0847 g/L a 17.0 °C y una presión de 760 torr. ¿Cuál es su masa molar? ¿Cuál es el gas?
- Contestar
-
\[ρ=\dfrac{Pℳ}{RT} \nonumber \]
\[\mathrm{0.0847\:g/L=760\cancel{torr}×\dfrac{1\cancel{atm}}{760\cancel{torr}}×\dfrac{\mathit{ℳ}}{0.0821\: L\cancel{atm}/mol\: K}×290\: K} \nonumber \]
= 2.02 g/mol; por lo tanto, el gas debe ser hidrógeno (H 2, 2.02 g/mol)
Debemos especificar tanto la temperatura como la presión de un gas al calcular su densidad debido a que el número de moles de un gas (y así la masa del gas) en un litro cambia con la temperatura o presión. Las densidades de gas a menudo se reportan en STP.
Utilizando la Ley de Gas Ideal y Densidad de un Gas Ciclopropano, un gas que una vez usado con oxígeno como anestésico general, está compuesto por 85.7% de carbono y 14.3% de hidrógeno en masa. Encuentra la fórmula empírica. Si 1.56 g de ciclopropano ocupa un volumen de 1.00 L a 0.984 atm y 50 °C, ¿cuál es la fórmula molecular para el ciclopropano?
Solución
Estrategia:
Primero resolver el problema de la fórmula empírica utilizando los métodos discutidos anteriormente. Asumir 100 g y convertir el porcentaje de cada elemento en gramos. Determinar el número de moles de carbono e hidrógeno en la muestra de 100 g de ciclopropano. Dividir por el menor número de moles para relacionar el número de moles de carbono con el número de moles de hidrógeno. En el último paso, darse cuenta de que la relación de números enteros más pequeña es la fórmula empírica:
\[\mathrm{85.7\: g\: C×\dfrac{1\: mol\: C}{12.01\: g\: C}=7.136\: mol\: C\hspace{20px}\dfrac{7.136}{7.136}=1.00\: mol\: C} \nonumber \]
\[\mathrm{14.3\: g\: H×\dfrac{1\: mol\: H}{1.01\: g\: H}=14.158\: mol\: H\hspace{20px}\dfrac{14.158}{7.136}=1.98\: mol\: H} \nonumber \]
La fórmula empírica es CH 2 [masa empírica (EM) de 14.03 g/unidad empírica].
A continuación, utilice la ecuación de densidad relacionada con la ley de gas ideal para determinar la masa molar:
\[d=\dfrac{Pℳ}{RT}\hspace{20px}\mathrm{\dfrac{1.56\: g}{1.00\: L}=0.984\: atm×\dfrac{ℳ}{0.0821\: L\: atm/mol\: K}×323\: K} \nonumber \]
= 42.0 g/mol\(\dfrac{ℳ}{Eℳ}=\dfrac{42.0}{14.03}=2.99\), así que (3) (CH 2) = C 3 H 6 (fórmula molecular)
El acetileno, un combustible usado para sopletes de soldadura, está compuesto por 92.3% C y 7.7% H en masa. Encuentra la fórmula empírica. Si 1.10 g de acetileno ocupa un volumen de 1.00 L a 1.15 atm y 59.5 °C, ¿cuál es la fórmula molecular del acetileno?
- Contestar
-
Fórmula empírica, CH; Fórmula molecular, C 2 H 2
Masa molar de un gas
Otra aplicación útil de la ley de gas ideal implica la determinación de la masa molar. Por definición, la masa molar de una sustancia es la relación de su masa en gramos, m, a su cantidad en moles, n:
\[ℳ=\mathrm{\dfrac{grams\: of\: substance}{moles\: of\: substance}}=\dfrac{m}{n} \nonumber \]
La ecuación de gas ideal se puede reorganizar para aislar n:
\[n=\dfrac{PV}{RT} \nonumber \]
y luego se combina con la ecuación de masa molar para producir:
\[ℳ=\dfrac{mRT}{PV} \nonumber \]
Esta ecuación se puede utilizar para derivar la masa molar de un gas a partir de mediciones de su presión, volumen, temperatura y masa.
La masa molar aproximada de un líquido volátil se puede determinar por:
- Calentar una muestra del líquido en un matraz con un pequeño orificio en la parte superior, lo que convierte el líquido en gas que puede escapar a través del orificio
- Retirar el matraz del calor en el instante en que el último bit de líquido se convierte en gas, momento en el que el matraz se llenará solo con muestra gaseosa a presión ambiente
- Sellar el matraz y permitir que la muestra gaseosa se condense a líquido, y luego pesar el matraz para determinar la masa de la muestra (Figura\(\PageIndex{1}\))

Mediante este procedimiento, se recoge una muestra de gas cloroformo que pesa 0.494 g en un matraz con un volumen de 129 cm 3 a 99.6 °C cuando la presión atmosférica es de 742.1 mm Hg. ¿Cuál es la masa molar aproximada del cloroformo?
Solución
Desde
\[ℳ=\dfrac{m}{n} \nonumber \]
y
\[n=\dfrac{PV}{RT} \nonumber \]
sustituir y reorganizar da
\[ℳ=\dfrac{mRT }{PV} \nonumber \]
entonces
\[ℳ=\dfrac{mRT}{PV}=\mathrm{\dfrac{(0.494\: g)×0.08206\: L⋅atm/mol\: K×372.8\: K}{0.976\: atm×0.129\: L}=120\:g/mol} \nonumber \]
Una muestra de fósforo que pesa 3.243 × 10 −2 g ejerce una presión de 31.89 kPa en un bulbo de 56.0-mL a 550 °C. ¿Cuáles son la masa molar y la fórmula molecular del vapor de fósforo?
- Contestar
-
124 g/mol P 4
La presión de una mezcla de gases: la ley de Dalton
A menos que reaccionen químicamente entre sí, los gases individuales en una mezcla de gases no afectan la presión del otro. Cada gas individual en una mezcla ejerce la misma presión que ejercería si estuviera presente solo en el contenedor (Figura\(\PageIndex{2}\)). La presión ejercida por cada gas individual en una mezcla se llama su presión parcial. Esta observación se resume por la ley de Dalton de presiones parciales: La presión total de una mezcla de gases ideales es igual a la suma de las presiones parciales de los gases componentes:
\[P_{Total}=P_A+P_B+P_C+...=\sum_iP_i \nonumber \]
En la ecuación P Total es la presión total de una mezcla de gases, P A es la presión parcial del gas A; P B es la presión parcial del gas B; P C es la presión parcial del gas C; y así sucesivamente.

La presión parcial del gas A se relaciona con la presión total de la mezcla de gases a través de su fracción molar (X), unidad de concentración definida como el número de moles de un componente de una solución dividido por el número total de moles de todos los componentes:
\[P_A=X_A×P_{Total}\hspace{20px}\ce{where}\hspace{20px}X_A=\dfrac{n_A}{n_{Total}} \nonumber \]
donde P A, X A y n A son la presión parcial, la fracción molar y el número de moles de gas A, respectivamente, y n Total es el número de moles de todos los componentes en la mezcla.
Un recipiente de 10.0-L contiene 2.50 × 10 −3 mol de H 2, 1.00 × 10 −3 mol de He y 3.00 × 10 −4 mol de Ne a 35 °C.
- ¿Cuáles son las presiones parciales de cada uno de los gases?
- ¿Cuál es la presión total en atmósferas?
Solución
Los gases se comportan de manera independiente, por lo que la presión parcial de cada gas se puede determinar a partir de la ecuación de gas ideal, utilizando\(P=\dfrac{nRT}{V}\):
\[P_\mathrm{H_2}=\mathrm{\dfrac{(2.50×10^{−3}\:mol)(0.08206\cancel{L}atm\cancel{mol^{−1}\:K^{−1}})(308\cancel{K})}{10.0\cancel{L}}=6.32×10^{−3}\:atm} \nonumber \]
\[P_\ce{He}=\mathrm{\dfrac{(1.00×10^{−3}\cancel{mol})(0.08206\cancel{L}atm\cancel{mol^{−1}\:K^{−1}})(308\cancel{K})}{10.0\cancel{L}}=2.53×10^{−3}\:atm} \nonumber \]
\[P_\ce{Ne}=\mathrm{\dfrac{(3.00×10^{−4}\cancel{mol})(0.08206\cancel{L}atm\cancel{mol^{−1}\:K^{−1}})(308\cancel{K})}{10.0\cancel{L}}=7.58×10^{−4}\:atm} \nonumber \]
La presión total viene dada por la suma de las presiones parciales:
\[P_\ce{T}=P_\mathrm{H_2}+P_\ce{He}+P_\ce{Ne}=\mathrm{(0.00632+0.00253+0.00076)\:atm=9.61×10^{−3}\:atm} \nonumber \]
Un matraz de 5.73 l a 25 °C contiene 0.0388 mol de N 2, 0.147 mol de CO y 0.0803 mol de H 2. ¿Cuál es la presión total en el matraz en atmósferas?
- Contestar
-
1.137 atm
Aquí hay otro ejemplo de este concepto, pero tratando con cálculos de fracción molar.
Una mezcla de gases utilizada para anestesia contiene 2.83 mol de oxígeno, O 2, y 8.41 mol de óxido nitroso, N 2 O. La presión total de la mezcla es de 192 kPa.
- ¿Cuáles son las fracciones molares de O 2 y N 2 O?
- ¿Cuáles son las presiones parciales de O 2 y N 2 O?
Solución
La fracción molar viene dada por
\[X_A=\dfrac{n_A}{n_{Total}} \nonumber \]
y la presión parcial es
\[P_A = X_A \times P_{Total} \nonumber \]
Para O 2,
\[X_{O_2}=\dfrac{n_{O_2}}{n_{Total}}=\mathrm{\dfrac{2.83 mol}{(2.83+8.41)\:mol}=0.252} \nonumber \]
y
\[P_{O_2}=X_{O_2}×P_{Total}=\mathrm{0.252×192\: kPa=48.4\: kPa} \nonumber \]
Para N 2 O,
\[X_{N_2O}=\dfrac{n_{N_2O}}{n_{Total}}=\mathrm{\dfrac{8.41\: mol}{(2.83+8.41)\:mol}=0.748} \nonumber \]
y
\[P_{N_2O}=X_{N_2O}×P_{Total}=\mathrm{(0.748)×192\: kPa = 143.6 \: kPa} \nonumber \]
¿Cuál es la presión de una mezcla de 0.200 g de H 2, 1.00 g de N 2 y 0.820 g de Ar en un recipiente con un volumen de 2.00 L a 20 °C?
- Contestar
-
1.87 atm
Recolección de Gases sobre Agua
Una forma sencilla de recolectar los gases que no reaccionan con el agua es capturarlos en una botella que ha sido llenada con agua e invertida en un plato lleno de agua. La presión del gas dentro de la botella se puede hacer igual a la presión del aire exterior al subir o bajar la botella. Cuando el nivel del agua es el mismo tanto dentro como fuera de la botella (Figura\(\PageIndex{3}\)), la presión del gas es igual a la presión atmosférica, la cual se puede medir con un barómetro.
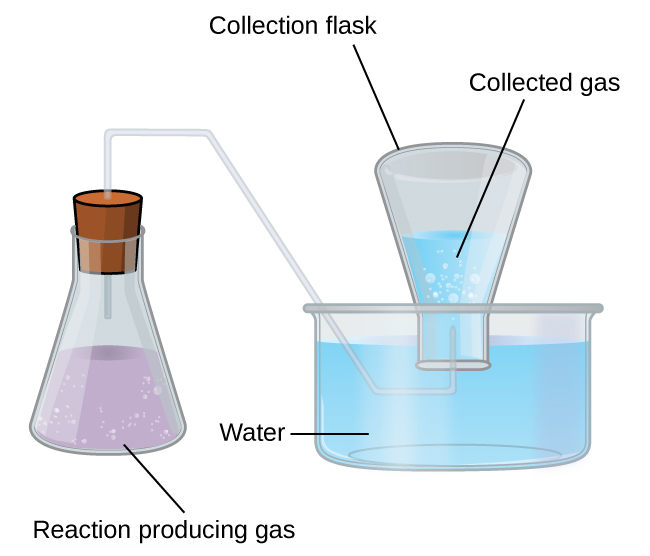
Sin embargo, hay otro factor que debemos considerar cuando medimos la presión del gas por este método. El agua se evapora y siempre hay agua gaseosa (vapor de agua) por encima de una muestra de agua líquida. A medida que un gas se recoge sobre el agua, se satura con vapor de agua y la presión total de la mezcla es igual a la presión parcial del gas más la presión parcial del vapor de agua. Por lo tanto, la presión del gas puro es igual a la presión total menos la presión del vapor de agua, esto se conoce como la presión del gas “seco”, es decir, la presión del gas solo, sin vapor de agua.
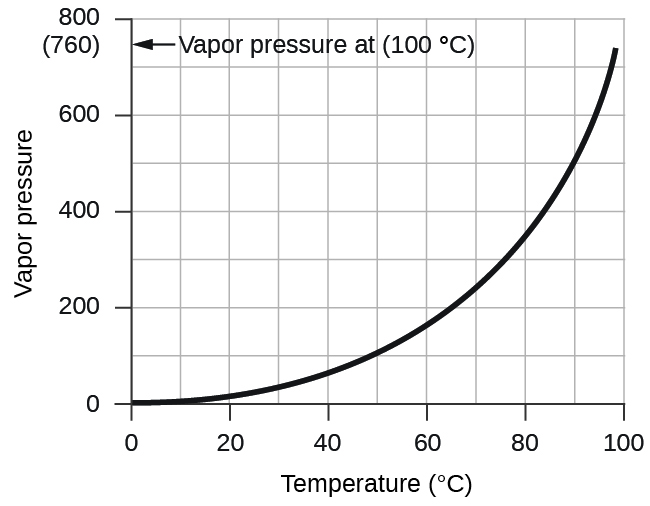
La presión de vapor del agua, que es la presión ejercida por el vapor de agua en equilibrio con el agua líquida en un recipiente cerrado, depende de la temperatura (Figura\(\PageIndex{4}\)); información más detallada sobre la dependencia de la temperatura del vapor de agua se puede encontrar en la Tabla\(\PageIndex{1}\), y el vapor presión se discutirá con más detalle en el próximo capítulo sobre líquidos.
| Temperatura (°C) | Presión (torr) | Temperatura (°C) | Presión (torr) | Temperatura (°C) | Presión (torr) | ||
|---|---|---|---|---|---|---|---|
| —10 | 1.95 | 18 | 15.5 | 30 | 31.8 | ||
| —5 | 3.0 | 19 | 16.5 | 35 | 42.2 | ||
| —2 | 3.9 | 20 | 17.5 | 40 | 55.3 | ||
| 0 | 4.6 | 21 | 18.7 | 50 | 92.5 | ||
| 2 | 5.3 | 22 | 19.8 | 60 | 149.4 | ||
| 4 | 6.1 | 23 | 21.1 | 70 | 233.7 | ||
| 6 | 7.0 | 24 | 22.4 | 80 | 355.1 | ||
| 8 | 8.0 | 25 | 23.8 | 90 | 525.8 | ||
| 10 | 9.2 | 26 | 25.2 | 95 | 633.9 | ||
| 12 | 10.5 | 27 | 26.7 | 99 | 733.2 | ||
| 14 | 12.0 | 28 | 28.3 | 100.0 | 760.0 | ||
| 16 | 13.6 | 29 | 30.0 | 101.0 | 787.6 |
Si se recogen 0.200 L de argón sobre agua a una temperatura de 26 °C y una presión de 750 torr en un sistema como el que se muestra en la Figura\(\PageIndex{3}\), ¿cuál es la presión parcial del argón?
Solución
Según la ley de Dalton, la presión total en la botella (750 torr) es la suma de la presión parcial del argón y la presión parcial del agua gaseosa:
\[P_\ce{T}=P_\ce{Ar}+P_\mathrm{H_2O} \nonumber \]
Reorganizar esta ecuación para resolver la presión del argón da:
\[P_\ce{Ar}=P_\ce{T}−P_\mathrm{H_2O} \nonumber \]
La presión del vapor de agua por encima de una muestra de agua líquida a 26 °C es de 25.2 torr (Apéndice E), por lo que:
\[P_\ce{Ar}=\mathrm{750\:torr−25.2\:torr=725\:torr} \nonumber \]
Una muestra de oxígeno recolectada sobre agua a una temperatura de 29.0 °C y una presión de 764 torr tiene un volumen de 0.560 L. ¿Qué volumen tendría el oxígeno seco en las mismas condiciones de temperatura y presión?
- Contestar
-
0.583 L
Estequiometría Química y Gases
La estequiometría química describe las relaciones cuantitativas entre los reactivos y los productos en las reacciones químicas. Anteriormente hemos medido cantidades de reactivos y productos utilizando masas para sólidos y volúmenes junto con la molaridad para soluciones; ahora también podemos usar volúmenes de gas para indicar cantidades. Si conocemos el volumen, la presión y la temperatura de un gas, podemos usar la ecuación de gas ideal para calcular cuántos moles del gas están presentes. Si sabemos cuántos moles de un gas están involucrados, podemos calcular el volumen de un gas a cualquier temperatura y presión.
Ley de Avogadro revisada
En ocasiones podemos aprovechar una característica simplificadora de la estequiometría de gases que los sólidos y las soluciones no exhiben: Todos los gases que muestran un comportamiento ideal contienen el mismo número de moléculas en un mismo volumen (a la misma temperatura y presión). Así, las relaciones de volúmenes de gases involucrados en una reacción química vienen dadas por los coeficientes en la ecuación para la reacción, siempre que los volúmenes de gas se midan a la misma temperatura y presión.
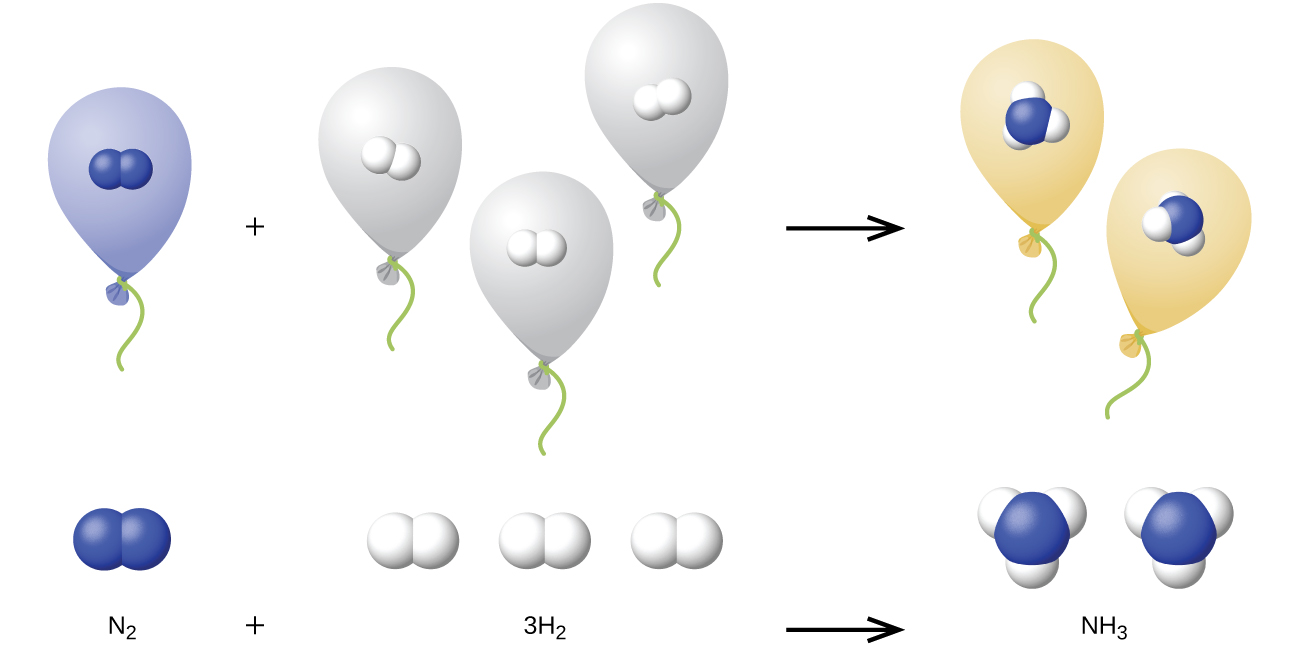
Podemos extender la ley de Avogadro (que el volumen de un gas es directamente proporcional al número de moles del gas) a reacciones químicas con gases: Los gases se combinan, o reaccionan, en proporciones definidas y simples por volumen, siempre que todos los volúmenes de gas se midan a la misma temperatura y presión. Por ejemplo, dado que los gases de nitrógeno e hidrógeno reaccionan para producir gas amoníaco de acuerdo con
\[\ce{N2}(g)+\ce{3H2}(g)⟶\ce{2NH3}(g) \nonumber \]
un volumen dado de gas nitrógeno reacciona con tres veces ese volumen de gas hidrógeno para producir dos veces ese volumen de gas amoníaco, si la presión y la temperatura permanecen constantes.
La explicación de esto se ilustra en la Figura\(\PageIndex{4}\). Según la ley de Avogadro, volúmenes iguales de N 2, H 2 y NH 3 gaseosos, a la misma temperatura y presión, contienen el mismo número de moléculas. Debido a que una molécula de N 2 reacciona con tres moléculas de H 2 para producir dos moléculas de NH 3, el volumen de H 2 requerido es tres veces el volumen de N 2, y el volumen de NH 3 producido es dos veces el volumen de N 2.
El propano, C 3 H 8 (g), se utiliza en parrillas de gas para proporcionar el calor para cocinar. ¿Qué volumen de O 2 (g) medido a 25 °C y 760 torr se requiere para reaccionar con 2.7 L de propano medido en las mismas condiciones de temperatura y presión? Supongamos que el propano se somete a combustión completa.
Solución
La relación de los volúmenes de C 3 H 8 y O 2 será igual a la relación de sus coeficientes en la ecuación equilibrada para la reacción:
\ [\ begin {align}
&\ ce {C3H8} (g) +\ ce {5O2} (g) ⟶ &&\ ce {3CO2} (g) +\ ce {4H2O} (l)\\
\ ce {&1\: volumen + 5\: volúmenes &&3\: volúmenes + 4\: volúmenes}
\ end {align}\ nonumber\]
De la ecuación, vemos que un volumen de C 3 H 8 reaccionará con cinco volúmenes de O 2:
\[\mathrm{2.7\cancel{L\:C_3H_8}×\dfrac{5\: L\:\ce{O2}}{1\cancel{L\:C_3H_8}}=13.5\: L\:\ce{O2}} \nonumber \]
Se requerirá un volumen de 13.5 L de O 2 para reaccionar con 2.7 L de C 3 H 8.
Un tanque de acetileno para un soplete de oxiacetileno proporciona 9340 L de gas acetileno, C 2 H 2, a 0 °C y 1 atm. ¿Cuántos tanques de oxígeno, cada uno proporcionando 7.00 × 10 3 L de O 2 a 0 °C y 1 atm, se requerirán para quemar el acetileno?
\[\ce{2C2H2 + 5O2⟶4CO2 + 2H2O} \nonumber \]
- Contestar
-
Tanques 3.34 (2.34 × 10 4 L)
El amoníaco es un importante fertilizante y químico industrial. Supongamos que se fabricó un volumen de 683 mil millones de pies cúbicos de amoníaco gaseoso, medido a 25 °C y 1 atm. ¿Qué volumen de H 2 (g), medido en las mismas condiciones, se requirió para preparar esta cantidad de amoníaco por reacción con N 2?
\[\ce{N2}(g)+\ce{3H2}(g)⟶\ce{2NH3}(g) \nonumber \]
Solución
Debido a que volúmenes iguales de H 2 y NH 3 contienen igual número de moléculas y cada tres moléculas de H 2 que reaccionan producen dos moléculas de NH 3, la relación de los volúmenes de H 2 y NH 3 será igual a 3:2. Dos volúmenes de NH 3, en este caso en unidades de mil millones de pies 3, se formarán a partir de tres volúmenes de H 2:
\[\mathrm{683\cancel{billion\:ft^3\:NH_3}×\dfrac{3\: billion\:ft^3\:H_2}{2\cancel{billion\:ft^3\:NH_3}}=1.02×10^3\:billion\:ft^3\:H_2} \nonumber \]
La fabricación de 683 mil millones de pies 3 de NH 3 requirió 1020 mil millones de pies 3 de H 2. (A 25 °C y 1 atm, este es el volumen de un cubo con una longitud de borde de aproximadamente 1.9 millas).
¿Qué volumen de O 2 (g) medido a 25 °C y 760 torr se requiere para reaccionar con 17.0 L de etileno, C 2 H 4 (g), medido en las mismas condiciones de temperatura y presión? Los productos son CO 2 y vapor de agua.
- Contestar
-
51.0 L
¿Qué volumen de hidrógeno a 27 °C y 723 torr se puede preparar mediante la reacción de 8.88 g de galio con un exceso de ácido clorhídrico?
\[\ce{2Ga}(s)+\ce{6HCl}(aq)⟶\ce{2GaCl3}(aq)+\ce{3H2}(g) \nonumber \]
Sol ución
Para convertir de la masa de galio al volumen de H 2 (g), necesitamos hacer algo como esto:
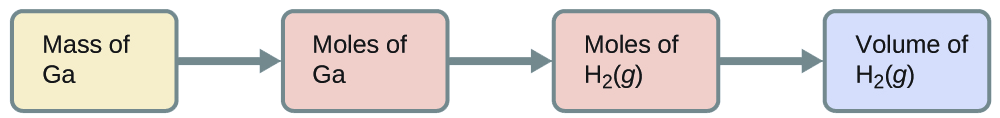
Las dos primeras conversiones son:
\[\mathrm{8.88\cancel{g\: Ga}×\dfrac{1\cancel{mol\: Ga}}{69.723\cancel{g\: Ga}}×\dfrac{3\: mol\:H_2}{2\cancel{mol\: Ga}}=0.191\:mol\: H_2} \nonumber \]
Por último, podemos utilizar la ley de gas ideal:
\[V_\mathrm{H_2}=\left(\dfrac{nRT}{P}\right)_\mathrm{H_2}=\mathrm{\dfrac{0.191\cancel{mol}×0.08206\: L\cancel{atm\:mol^{−1}\:K^{−1}}×300\: K}{0.951\:atm}=4.94\: L} \nonumber \]
El dióxido de azufre es un intermedio en la preparación del ácido sulfúrico. ¿Qué volumen de SO 2 a 343 °C y 1.21 atm se produce al quemar l.00 kg de azufre en oxígeno?
- Contestar
-
1.30 × 10 3 L
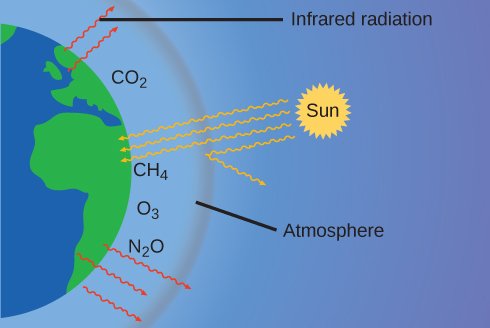
La fina piel de nuestra atmósfera evita que la tierra sea un planeta de hielo y la hace habitable. De hecho, esto se debe a menos de 0.5% de las moléculas de aire. De la energía del sol que llega a la tierra, casi\(\dfrac{1}{3}\) se refleja de nuevo al espacio, con el resto absorbido por la atmósfera y la superficie de la tierra. Parte de la energía que absorbe la tierra es reemitida como radiación infrarroja (IR), una parte de la cual pasa de nuevo a través de la atmósfera hacia el espacio. Sin embargo, la mayor parte de esta radiación IR es absorbida por ciertas sustancias en la atmósfera, conocidas como gases de efecto invernadero, que reemiten esta energía en todas las direcciones, atrapando parte del calor. Esto mantiene condiciones de vida favorables, sin atmósfera, la temperatura promedio global promedio de 14 °C (57 °F) sería de aproximadamente —19 °C (—2 °F). Los principales gases de efecto invernadero (GEI) son vapor de agua, dióxido de carbono, metano y ozono. Desde la Revolución Industrial, la actividad humana ha ido incrementando las concentraciones de GEI, que han cambiado el balance energético y están alterando significativamente el clima terrestre (Figura\(\PageIndex{6}\)).
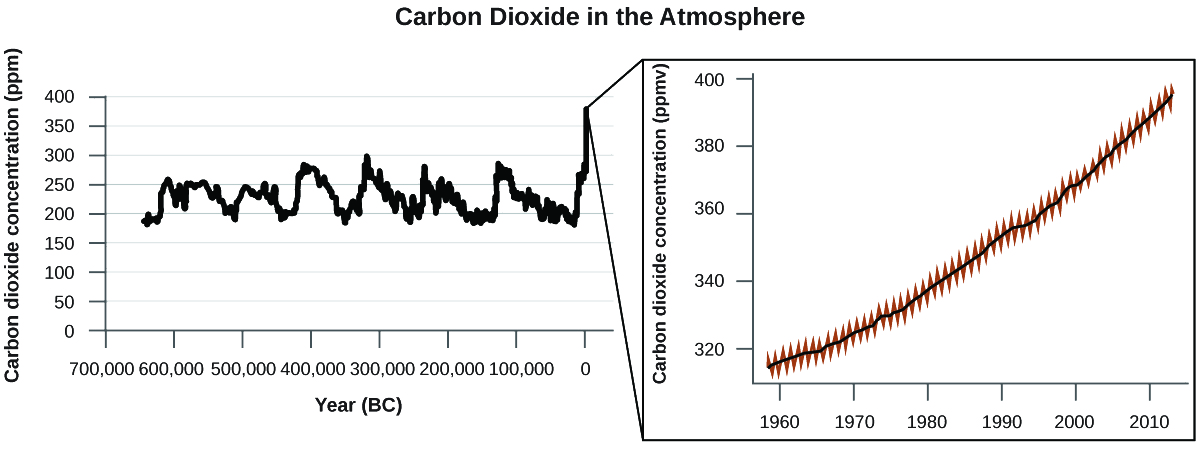
Existe una fuerte evidencia de múltiples fuentes de que los niveles atmosféricos más altos de CO 2 son causados por la actividad humana, y la quema\(\dfrac{3}{4}\) de combustibles fósiles representa aproximadamente el reciente aumento del CO 2. Datos confiables de núcleos de hielo revelan que la concentración de CO 2 en la atmósfera se encuentra en el nivel más alto en los últimos 800,000 años; otra evidencia indica que puede estar en su nivel más alto en 20 millones de años. En los últimos años, la concentración de CO 2 ha aumentado desde niveles históricos por debajo de 300 ppm a casi 400 ppm en la actualidad (Figura\(\PageIndex{7}\)).
Resumen
La ley de gas ideal se puede utilizar para derivar una serie de ecuaciones convenientes que relacionan las cantidades medidas directamente con las propiedades de interés para sustancias gaseosas y mezclas. Se puede hacer un reordenamiento apropiado de la ecuación de gas ideal para permitir el cálculo de densidades de gas y masas molares. La ley de Dalton de presiones parciales se puede usar para relacionar las presiones de gas medidas para mezclas gaseosas con sus composiciones. La ley de Avogadro puede ser utilizada en cálculos estequiométricos para reacciones químicas que involucren reactivos gaseosos o productos.
Ecuaciones Clave
- P Total = P A + P B + P C +... = i P i
- P A = X A P Total
- \(X_A=\dfrac{n_A}{n_{Total}}\)
Notas al pie
- “Citas de Joseph-Louis Lagrange”, última modificación febrero 2006, consultado febrero 10, 2015, www-history.mcs.st-andrews.ac... /Lagrange.html
Resumen
- Ley de Dalton de presiones parciales
- la presión total de una mezcla de gases ideales es igual a la suma de las presiones parciales de los gases componentes.
- fracción molar (X)
- unidad de concentración definida como la relación entre la cantidad molar de un componente de la mezcla y el número total de moles de todos los componentes de la mezcla
- presión parcial
- presión ejercida por un gas individual en una mezcla
- presión de vapor del agua
- presión ejercida por el vapor de agua en equilibrio con el agua líquida en un recipiente cerrado a una temperatura específica


