10.1: Fuerzas intermoleculares
- Page ID
- 75287
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Describir los tipos de fuerzas intermoleculares posibles entre átomos o moléculas en fases condensadas (fuerzas de dispersión, atracciones dipolo-dipolo y enlaces de hidrógeno)
- Identificar los tipos de fuerzas intermoleculares experimentadas por moléculas específicas en función de sus estructuras
- Explicar la relación entre las fuerzas intermoleculares presentes dentro de una sustancia y las temperaturas asociadas a cambios en su estado físico
Como fue el caso de las sustancias gaseosas, la teoría molecular cinética puede ser utilizada para explicar el comportamiento de sólidos y líquidos. En la siguiente descripción, el término partícula se utilizará para referirse a un átomo, molécula o ion. Tenga en cuenta que utilizaremos la popular frase “atracción intermolecular” para referirnos a las fuerzas de atracción entre las partículas de una sustancia, independientemente de que estas partículas sean moléculas, átomos o iones.
Considere estos dos aspectos de los entornos a nivel molecular en materia sólida, líquida y gaseosa:
- Las partículas en un sólido están estrechamente empaquetadas y a menudo dispuestas en un patrón regular; en un líquido, están muy juntas sin arreglo regular; en un gas, están muy separadas sin arreglo regular.
- Las partículas en un sólido vibran alrededor de posiciones fijas y generalmente no se mueven una con relación a la otra; en un líquido, se mueven una junto a la otra pero permanecen en contacto esencialmente constante; en un gas, se mueven independientemente entre sí excepto cuando chocan.
Las diferencias en las propiedades de un sólido, líquido o gas reflejan las fuerzas de atracción entre los átomos, moléculas o iones que componen cada fase. La fase en la que existe una sustancia depende de la extensión relativa de sus fuerzas intermoleculares (IMF) y de las energías cinéticas (KE) de sus moléculas. Los IMF son las diversas fuerzas de atracción que pueden existir entre los átomos y moléculas de una sustancia debido a fenómenos electrostáticos, como se detallará en este módulo. Estas fuerzas sirven para mantener las partículas juntas, mientras que el KE de las partículas proporciona la energía requerida para superar las fuerzas de atracción y así aumentar la distancia entre las partículas. La figura\(\PageIndex{1}\) ilustra cómo pueden inducirse cambios en el estado físico cambiando la temperatura, de ahí, el KE promedio, de una sustancia dada.
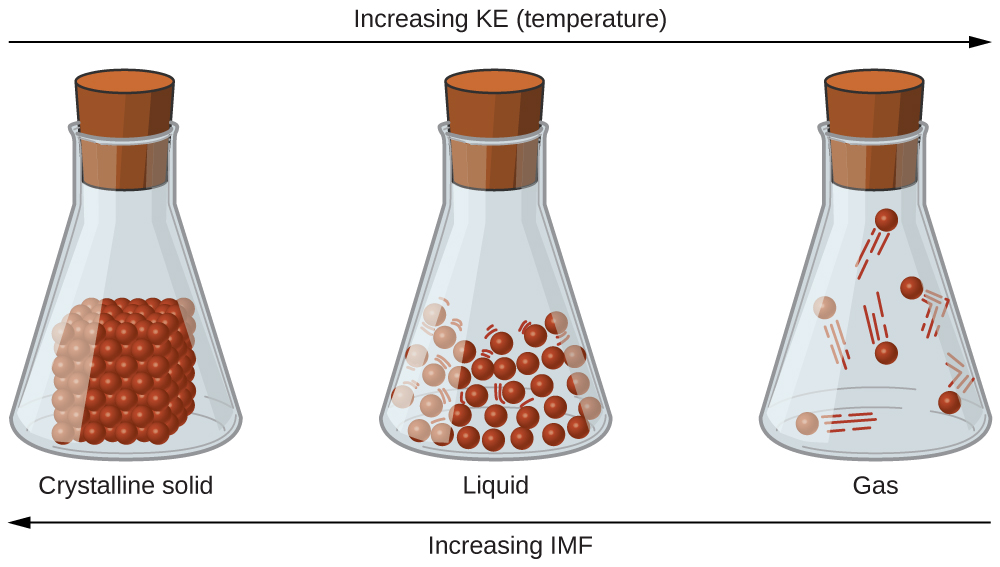
Como ejemplo de los procesos representados en esta figura, considera una muestra de agua. Cuando el agua gaseosa se enfría suficientemente, las atracciones entre las moléculas de H 2 O serán capaces de mantenerlas unidas cuando entren en contacto entre sí; el gas se condensa, formando el líquido H 2 O. Por ejemplo, el agua líquida se forma en el exterior de un vaso frío como el agua vapor en el aire es enfriado por el vidrio frío, como se ve en la Figura\(\PageIndex{2}\).

También podemos licuar muchos gases comprimiéndolos, si la temperatura no es demasiado alta. El aumento de la presión acerca las moléculas de un gas, de tal manera que las atracciones entre las moléculas se vuelven fuertes en relación con su KE. En consecuencia, forman líquidos. El butano, C 4 H 10, es el combustible utilizado en los encendedores desechables y es un gas a temperatura y presión estándar. Dentro del compartimiento de combustible del encendedor, el butano se comprime a una presión que resulta en su condensación al estado líquido, como se muestra en la Figura\(\PageIndex{3}\).

Finalmente, si la temperatura de un líquido se vuelve suficientemente baja, o la presión sobre el líquido se vuelve suficientemente alta, las moléculas del líquido ya no tienen suficiente KE para superar el IMF entre ellas, y se forma un sólido. Una discusión más profunda de estos y otros cambios de estado, o transiciones de fase, se proporciona en un módulo posterior de este capítulo.
Fuerzas entre Moléculas
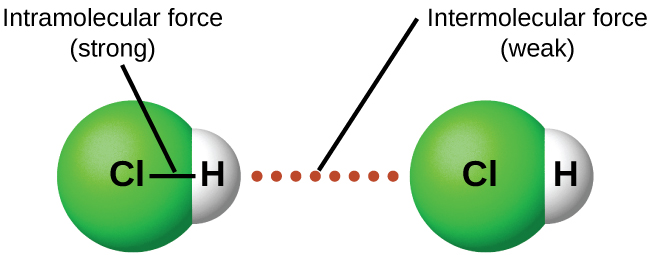
En condiciones apropiadas, las atracciones entre todas las moléculas de gas harán que formen líquidos o sólidos. Esto se debe a fuerzas intermoleculares, no a fuerzas intramoleculares. Las fuerzas intramoleculares son aquellas dentro de la molécula que mantienen unida a la molécula, por ejemplo, los enlaces entre los átomos. Las fuerzas intermoleculares son las atracciones entre las moléculas, las cuales determinan muchas de las propiedades físicas de una sustancia. La figura\(\PageIndex{4}\) ilustra estas diferentes fuerzas moleculares. Las fuerzas de estas fuerzas de atracción varían ampliamente, aunque generalmente los IMF entre moléculas pequeñas son débiles en comparación con las fuerzas intramoleculares que unen los átomos dentro de una molécula. Por ejemplo, para superar los IMF en un mol de HCl líquido y convertirlo en HCl gaseoso se requieren sólo unos 17 kilojulios. Sin embargo, para romper los enlaces covalentes entre los átomos de hidrógeno y cloro en un mol de HCl se requieren aproximadamente 25 veces más energía, 430 kilojulios.
Todas las fuerzas atractivas entre los átomos neutros y las moléculas se conocen como fuerzas de van der Waals, aunque generalmente se las conoce de manera más informal como atracción intermolecular. Consideraremos los distintos tipos de IMF en las siguientes tres secciones de este módulo.
Fuerzas de Dispersión
Una de las tres fuerzas de van der Waals está presente en todas las fases condensadas, independientemente de la naturaleza de los átomos o moléculas que componen la sustancia. Esta fuerza atractiva se llama la fuerza de dispersión londinense en honor al físico estadounidense de origen alemán Fritz London quien, en 1928, lo explicó por primera vez. Esta fuerza a menudo se denomina simplemente la fuerza de dispersión. Debido a que los electrones de un átomo o molécula están en constante movimiento (o, alternativamente, la ubicación del electrón está sujeta a variabilidad cuántico-mecánica), en cualquier momento en el tiempo, un átomo o molécula puede desarrollar un dipolo temporal, instantáneo si sus electrones se distribuyen asimétricamente. La presencia de este dipolo puede, a su vez, distorsionar los electrones de un átomo o molécula vecina, produciendo un dipolo inducido. Estos dos dipolos temporales que fluctúan rápidamente resultan en una atracción electrostática relativamente débil entre las especies, una llamada fuerza de dispersión como la ilustrada en la Figura\(\PageIndex{5}\).
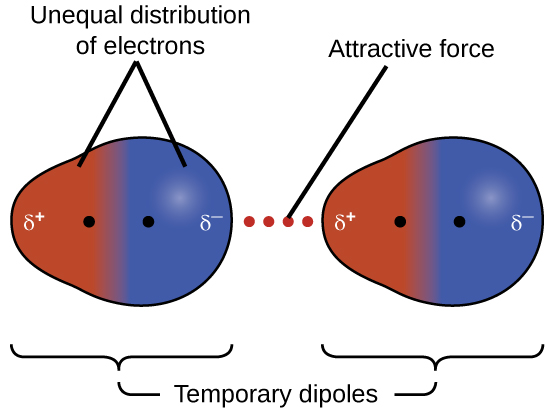
Las fuerzas de dispersión que se desarrollan entre los átomos en diferentes moléculas pueden atraer a las dos moléculas entre sí. Las fuerzas son relativamente débiles, sin embargo, y se vuelven significativas solo cuando las moléculas están muy cerca. Los átomos y moléculas más grandes y más pesados exhiben fuerzas de dispersión más fuertes que los átomos y moléculas más pequeños y más ligeros. F 2 y Cl 2 son gases a temperatura ambiente (reflejando fuerzas de atracción más débiles); Br 2 es un líquido e I 2 es un sólido (reflejando fuerzas de atracción más fuertes). Las tendencias en los puntos de fusión y ebullición observados para los halógenos demuestran claramente este efecto, como se ve en la Tabla\(\PageIndex{1}\).
| Halógeno | Masa molar | Radio Atómico | Punto de fusión | Punto de ebullición |
|---|---|---|---|---|
| flúor, F 2 | 38 g/mol | 72 pm | 53 K | 85 K |
| cloro, Cl 2 | 71 g/mol | 99 pm | 172 K | 238 K |
| bromo, Br 2 | 160 g/mol | 114pm | 266 K | 332 K |
| yodo, I 2 | 254 g/mol | 133pm | 387 K | 457 K |
| astatino, At 2 | 420 g/mol | 150pm | 575 K | 610 K |
El aumento en los puntos de fusión y ebullición con el aumento del tamaño atómico/molecular puede racionalizarse considerando cómo la fuerza de las fuerzas de dispersión se ve afectada por la estructura electrónica de los átomos o moléculas en la sustancia. En un átomo mayor, los electrones de valencia están, en promedio, más alejados de los núcleos que en un átomo más pequeño. Así, se sujetan con menos fuerza y pueden formar más fácilmente los dipolos temporales que producen la atracción. La medida de lo fácil o difícil que es para otra carga electrostática (por ejemplo, un ion cercano o molécula polar) distorsionar la distribución de carga de una molécula (su nube de electrones) se conoce como polarizabilidad. Se dice que una molécula que tiene una nube de carga que se distorsiona fácilmente es muy polarizable y tendrá grandes fuerzas de dispersión; una con una nube de carga que es difícil de distorsionar no es muy polarizable y tendrá pequeñas fuerzas de dispersión.
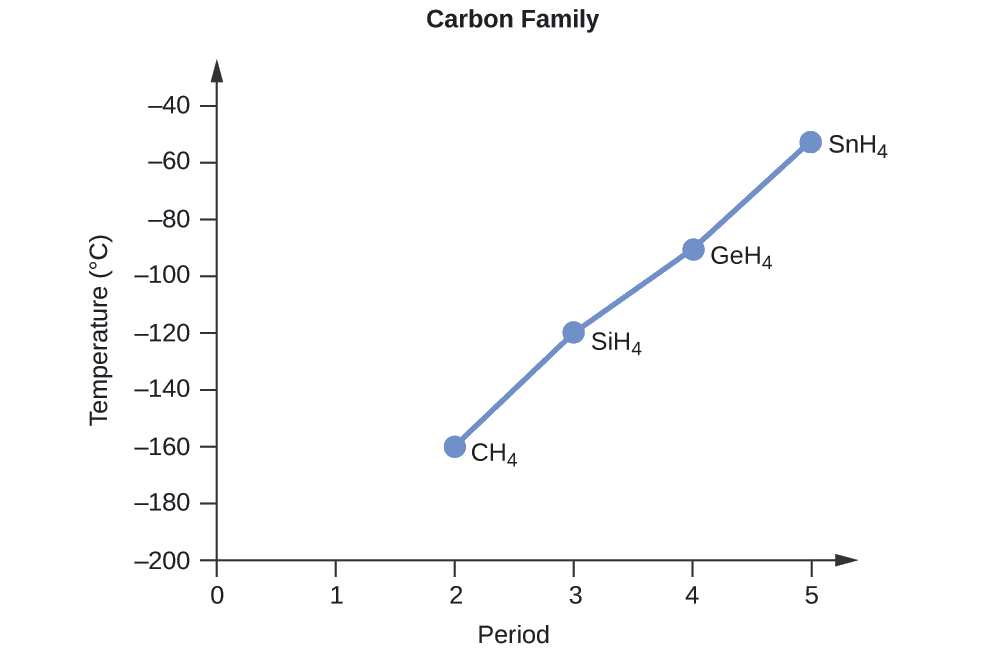
Ordene los siguientes compuestos de un elemento del grupo 14 e hidrógeno de menor a mayor punto de ebullición: CH 4, SiH 4, GeH 4 y SnH 4. Explica tu razonamiento.
Solución
Aplicando las habilidades adquiridas en el capítulo sobre unión química y geometría molecular, se predice que todos estos compuestos son no polares, por lo que pueden experimentar solo fuerzas de dispersión: cuanto más pequeña sea la molécula, menos polarizable y más débiles sean las fuerzas de dispersión; cuanto mayor sea la molécula, mayor será fuerzas de dispersión. Las masas molares de CH 4, SiH 4, GeH 4 y SnH 4 son aproximadamente 16 g/mol, 32 g/mol, 77 g/mol y 123 g/mol, respectivamente. Por lo tanto, se espera que CH 4 tenga el punto de ebullición más bajo y SnH 4 el punto de ebullición más alto. Se espera que el orden del punto de ebullición más bajo al más alto sea
CH 4 < SiH 4 < GeH 4 < SnH 4
Una gráfica de los puntos de ebullición reales de estos compuestos versus el periodo de los elementos del grupo 14 muestra que esta predicción es correcta:
Ordene los siguientes hidrocarburos de menor a mayor punto de ebullición: C 2 H 6, C 3 H 8 y C 4 H 10.
- Contestar
-
Todos estos compuestos son no polares y solo tienen fuerzas de dispersión de Londres: cuanto mayor es la molécula, mayores son las fuerzas de dispersión y mayor es el punto de ebullición. El orden del punto de ebullición más bajo al más alto es por lo tanto
C 2 H 6 < C 3 H 8 < C 4 H 10.
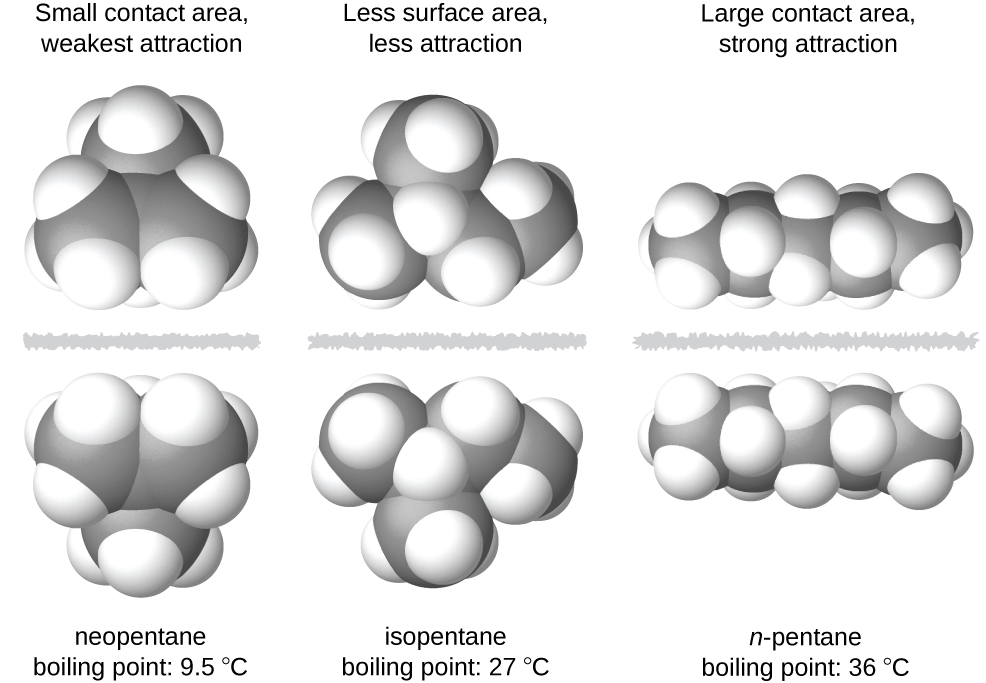
Las formas de las moléculas también afectan las magnitudes de las fuerzas de dispersión entre ellas. Por ejemplo, los puntos de ebullición para los isómeros n-pentano, isopentano y neopentano (mostrados en la Figura\(\PageIndex{6}\)) son 36 °C, 27 °C y 9.5 °C, respectivamente. A pesar de que estos compuestos están compuestos por moléculas con la misma fórmula química, C 5 H 12, la diferencia en los puntos de ebullición sugiere que las fuerzas de dispersión en la fase líquida son diferentes, siendo mayores para el n-pentano y menos para el neopentano. La forma alargada de n-pentano proporciona una mayor área de superficie disponible para el contacto entre moléculas, lo que resulta en fuerzas de dispersión correspondientemente más fuertes. La forma más compacta del isopentano ofrece una superficie más pequeña disponible para el contacto intermolecular y, por lo tanto, fuerzas de dispersión más débiles. Las moléculas de neopentano son las más compactas de las tres, ofreciendo la menor superficie disponible para el contacto intermolecular y, por lo tanto, las fuerzas de dispersión más débiles. Este comportamiento es análogo a las conexiones que se pueden formar entre las tiras de cierres de la marca VELCRO: cuanto mayor sea el área de contacto de la tira, más fuerte es la conexión.
Los geckos tienen una increíble capacidad para adherirse a la mayoría de las superficies. Pueden correr rápidamente por paredes lisas y techos que no tienen soportes para los pies, y lo hacen sin tener ventosas o una sustancia pegajosa en los dedos de los pies. Y mientras un gecko puede levantar sus pies fácilmente mientras camina por una superficie, si intentas recogerlo, se pega a la superficie. ¿Cómo pueden hacer esto los geckos (así como las arañas y algunos otros insectos)? Si bien este fenómeno ha sido investigado durante cientos de años, los científicos solo recientemente descubrieron los detalles del proceso que permite que los pies de geckos se comporten de esta manera.

Los dedos de los pies de Geckos están cubiertos de cientos de miles de pelos diminutos conocidos como setas, con cada seta, a su vez, ramificándose en cientos de puntas diminutas, planas y triangulares llamadas espátulas. La enorme cantidad de espátulas en sus setas proporcionan un gecko, que se muestra en la Figura\(\PageIndex{7}\), con una gran superficie total para adherirse a una superficie. En 2000, Kellar Autumn, quien lidera un equipo de investigación de gecko multi-institucional, encontró que los geckos se adhirieron igualmente bien tanto al dióxido de silicio polar como al arseniuro de galio no polar. Esto demostró que los geckos se adhieren a las superficies debido a las fuerzas de dispersión, débiles atracciones intermoleculares que surgen de distribuciones de carga temporales y sincronizadas entre moléculas adyacentes. Si bien las fuerzas de dispersión son muy débiles, la atracción total sobre millones de espátulas es lo suficientemente grande como para soportar muchas veces el peso del gecko.
En 2014, dos científicos desarrollaron un modelo para explicar cómo los geckos pueden pasar rápidamente de “pegajosos” a “no pegajosos”. Alex Greaney y Congcong Hu de la Universidad Estatal de Oregón describieron cómo los geckos pueden lograr esto cambiando el ángulo entre sus espáulas y la superficie. Los pies de Geckos, que normalmente no son pegajosos, se vuelven pegajosos cuando se aplica una pequeña fuerza de cizallamiento. Al rizar y desenroscar los dedos de los pies, los geckos pueden alternar entre pegarse y despegarse de una superficie, y así moverse fácilmente a través de ella. Otras investigaciones pueden conducir eventualmente al desarrollo de mejores adhesivos y otras aplicaciones.
Mira este video para conocer más sobre la investigación de Kellar Autumn que determinó que las fuerzas de van der Waals son responsables de la capacidad de un gecko para aferrarse y escalar.
Atracciones Dipole-Dipole
Recordemos del capítulo sobre unión química y geometría molecular que las moléculas polares tienen una carga positiva parcial en un lado y una carga negativa parcial en el otro lado de la molécula, una separación de carga llamada dipolo. Considera una molécula polar como cloruro de hidrógeno, HCl. En la molécula de HCl, el átomo de Cl más electronegativo lleva la carga negativa parcial, mientras que el átomo de H menos electronegativo lleva la carga positiva parcial. Una fuerza atractiva entre las moléculas de HCl resulta de la atracción entre el extremo positivo de una molécula de HCl y el extremo negativo de otra. Esta fuerza de atracción se denomina atracción dipolo-dipolo, la fuerza electrostática entre el extremo parcialmente positivo de una molécula polar y el extremo parcialmente negativo de otra, como se ilustra en la Figura\(\PageIndex{8}\).
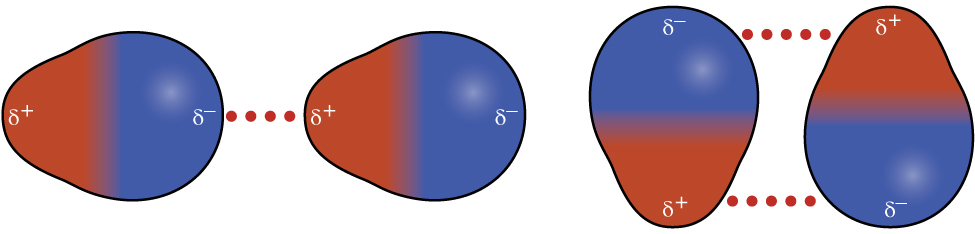
El efecto de una atracción dipolo-dipolo es evidente cuando comparamos las propiedades de las moléculas de HCl con las moléculas F 2 no polares. Tanto el HCl como el F 2 constan del mismo número de átomos y tienen aproximadamente la misma masa molecular. A una temperatura de 150 K, las moléculas de ambas sustancias tendrían el mismo KE promedio. Sin embargo, las atracciones dipolo-dipolo entre las moléculas de HCl son suficientes para hacer que se “peguen” para formar un líquido, mientras que las fuerzas de dispersión relativamente más débiles entre las moléculas F 2 no polares no lo son, por lo que esta sustancia es gaseosa a esta temperatura. El punto de ebullición normal más alto del HCl (188 K) en comparación con F 2 (85 K) es un reflejo de la mayor fuerza de atracciones dipolo-dipolo entre las moléculas de HCl, en comparación con las atracciones entre las moléculas F 2 no polares. A menudo utilizaremos valores como puntos de ebullición o congelación, o entalpías de vaporización o fusión, como indicadores de las fuerzas relativas de IMF de atracción presentes dentro de diferentes sustancias.
Predecir cuál tendrá el punto de ebullición más alto: N 2 o CO. Explica tu razonamiento.
Solución
CO y N 2 son moléculas diatómicas con masas de aproximadamente 28 amu, por lo que experimentan fuerzas de dispersión similares en Londres. Debido a que el CO es una molécula polar, experimenta atracciones dipolo-dipolo. Debido a que N 2 es no polar, sus moléculas no pueden exhibir atracciones dipolo-dipolo. Las atracciones dipolo-dipolo entre las moléculas de CO son comparablemente más fuertes que las fuerzas de dispersión entre las moléculas de N 2 no polares, por lo que se espera que el CO tenga el punto de ebullición más alto.
Un método común para preparar oxígeno es la descomposición
Predecir cuál tendrá el punto de ebullición más alto:\(\ce{ICl}\) o\(\ce{Br2}\). Explica tu razonamiento.
- Contestar
-
iCL. ICl y Br 2 tienen masas similares (~160 amu) y por lo tanto experimentan fuerzas de dispersión similares en Londres. ICl es polar y por lo tanto también exhibe atracciones dipolo-dipolo; Br 2 es no polar y no lo hace. Las atracciones dipolo-dipolo relativamente más fuertes requieren más energía para superar, por lo que iCL tendrá el punto de ebullición más alto.
Enlace de hidrógeno
El fluoruro de nitrosil (ONF, masa molecular 49 amu) es un gas a temperatura ambiente. El agua (H 2 O, masa molecular 18 amu) es un líquido, aunque tiene una menor masa molecular. Claramente no podemos atribuir esta diferencia entre los dos compuestos a las fuerzas de dispersión. Ambas moléculas tienen aproximadamente la misma forma y ONF es la molécula más pesada y más grande. Por lo tanto, se espera que experimente fuerzas de dispersión más significativas. Adicionalmente, no podemos atribuir esta diferencia en los puntos de ebullición a diferencias en los momentos dipolares de las moléculas. Ambas moléculas son polares y presentan momentos dipolares comparables. La gran diferencia entre los puntos de ebullición se debe a una atracción dipolo-dipolo particularmente fuerte que puede ocurrir cuando una molécula contiene un átomo de hidrógeno unido a un átomo de flúor, oxígeno o nitrógeno (los tres elementos más electronegativos). La gran diferencia en electronegatividad entre el átomo de H (2.1) y el átomo al que está unido (4.0 para un átomo de F, 3.5 para un átomo de O, o 3.0 para un átomo de N), combinada con el tamaño muy pequeño de un átomo de H y los tamaños relativamente pequeños de átomos de F, O o N, conduce a una concentración parcial altamente concentrada carga con estos átomos. Las moléculas con restos F-H, O-H o N-H se sienten muy fuertemente atraídas por restos similares en moléculas cercanas, un tipo particularmente fuerte de atracción dipolo-dipolo llamada enlace de hidrógeno. Ejemplos de enlaces de hidrógeno incluyen HF HF, H 2 OHOH y H 3 NHNH 2, en los que los enlaces de hidrógeno se denotan por puntos. La figura\(\PageIndex{9}\) ilustra enlaces de hidrógeno entre moléculas de agua.
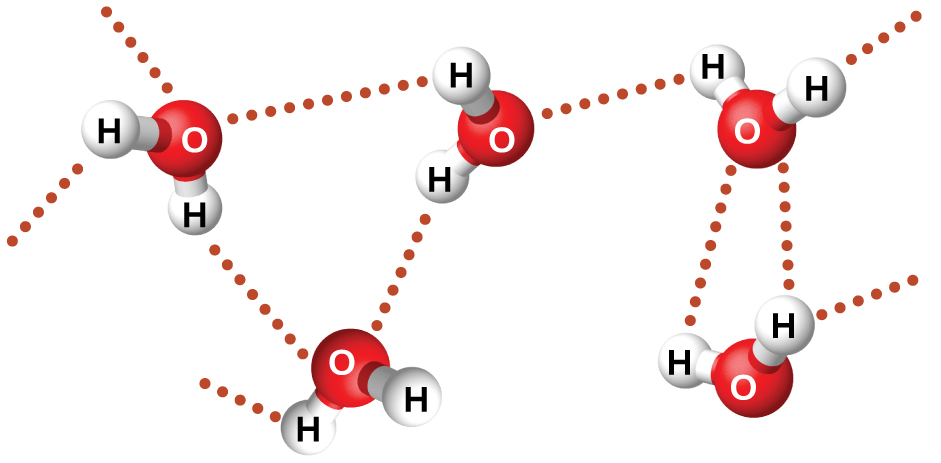
A pesar del uso de la palabra “enlace”, hay que tener en cuenta que los enlaces de hidrógeno son fuerzas de atracción intermoleculares, no fuerzas de atracción intramoleculares (enlaces covalentes). Los enlaces de hidrógeno son mucho más débiles que los enlaces covalentes, solo alrededor del 5 al 10% más fuertes, pero generalmente son mucho más fuertes que otras atracciones dipolo-dipolo y fuerzas de dispersión.
Los enlaces de hidrógeno tienen un efecto pronunciado sobre las propiedades de las fases condensadas (líquidos y sólidos). Por ejemplo, considere las tendencias en los puntos de ebullición para los hidruros binarios del grupo 15 (NH 3, PH 3, Ash 3 y SBh 3), los hidruros del grupo 16 (H 2 O, H 2 S, H 2 Se y H 2 Te) y los hidruros del grupo 17 (HF, HCl, HBr y HOLA). Los puntos de ebullición de los tres hidruros más pesados para cada grupo se representan gráficamente en la Figura\(\PageIndex{10}\). A medida que avanzamos hacia abajo en cualquiera de estos grupos, las polaridades de las moléculas disminuyen ligeramente, mientras que los tamaños de las moléculas aumentan sustancialmente. El efecto de fuerzas de dispersión cada vez más fuertes domina el de las atracciones dipolo-dipolo cada vez más débiles, y se observa que los puntos de ebullición aumentan constantemente. Para los hidruros del grupo 15, 16 y 17, los puntos de ebullición para cada clase de compuestos aumentan al aumentar la masa molecular para los elementos en los periodos 3, 4 y 5.
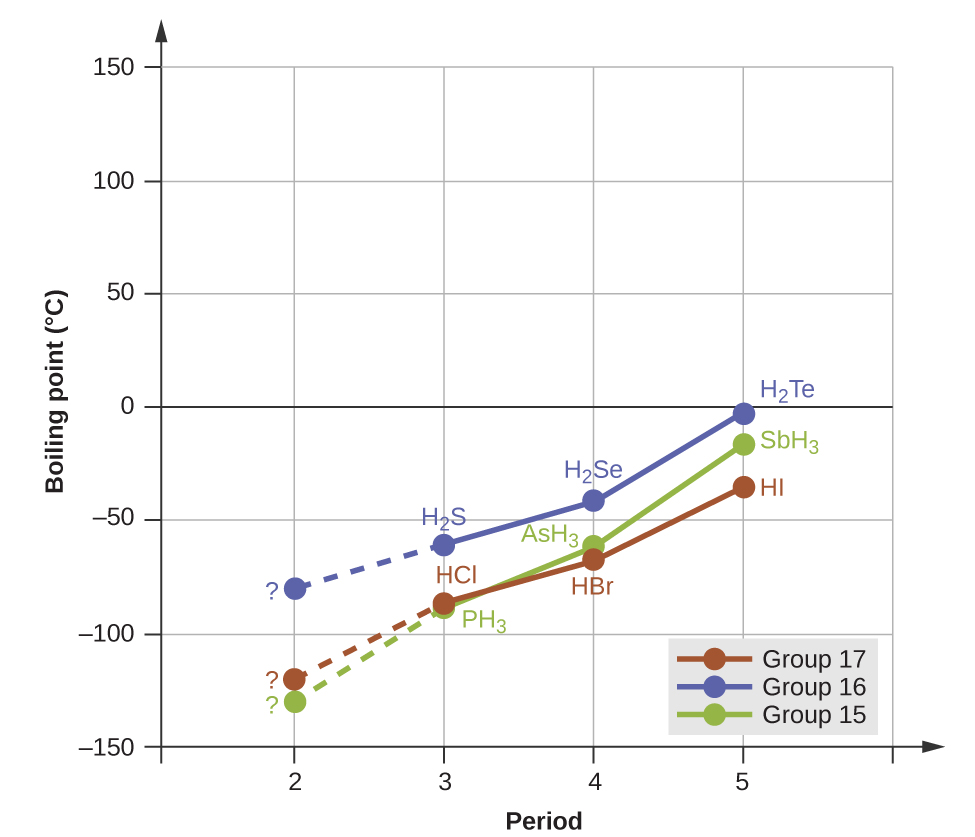
Si usamos esta tendencia para predecir los puntos de ebullición para el hidruro más ligero para cada grupo, esperaríamos que NH 3 hierva a aproximadamente −120 °C, H 2 O hierva a aproximadamente −80 °C y HF a aproximadamente -110 °C; sin embargo, cuando medimos los puntos de ebullición de estos compuestos, encontramos que son dramáticamente superior a lo que las tendencias predecirían, como se muestra en la Figura\(\PageIndex{10}\). El marcado contraste entre nuestras predicciones ingenuas y la realidad proporciona evidencia convincente de la fuerza de los enlaces de hidrógeno.
Considere los compuestos éter dimetílico (CH 3 OCH 3), etanol (CH 3 CH 2 OH) y propano (CH 3 CH 2 CH 3). Sus puntos de ebullición, no necesariamente en orden, son −42.1 °C, −24.8 °C y 78.4 °C. Coinciden cada compuesto con su punto de ebullición. Explica tu razonamiento.
Solución
Las formas predichas por VSEPR de CH 3 OCH 3, CH 3 CH 2 OH y CH 3 CH 2 CH 3 son similares, al igual que sus masas molares (46 g/mol, 46 g/mol y 44 g/mol, respectivamente), por lo que exhibirán fuerzas de dispersión similares. Dado que CH 3 CH 2 CH 3 es no polar, puede exhibir solo fuerzas de dispersión. Debido a que CH 3 OCH 3 es polar, también experimentará atracciones dipolo-dipolo. Finalmente, CH 3 CH 2 OH tiene un grupo −OH, por lo que experimentará la atracción dipolo-dipolo excepcionalmente fuerte conocida como enlace de hidrógeno. Entonces el orden en términos de fuerza de IMF, y por lo tanto puntos de ebullición, es CH 3 CH 2 CH 3 < CH 3 OCH 3 < CH 3 CH 2 OH. El punto de ebullición del propano es −42.1 °C, el punto de ebullición del éter dimetílico es −24.8 °C y el punto de ebullición del etanol es 78.5 °C.
El etano (CH 3 CH 3) tiene un punto de fusión de −183 °C y un punto de ebullición de −89 °C. Predice los puntos de fusión y ebullición para la metilamina (CH 3 NH 2). Explica tu razonamiento.
- Contestar
-
Se prevé que el punto de fusión y el punto de ebullición de la metilamina sean significativamente mayores que los del etano. CH 3 CH 3 y CH 3 NH 2 son similares en tamaño y masa, pero la metilamina posee un grupo -NH y por lo tanto puede presentar enlaces de hidrógeno. Esto aumenta en gran medida sus IMF, y por lo tanto sus puntos de fusión y ebullición. Es difícil predecir valores, pero los valores conocidos son un punto de fusión de −93 °C y un punto de ebullición de −6 °C.
Enlace de hidrógeno y ADN
El ácido desoxirribonucleico (ADN) se encuentra en todos los organismos vivos y contiene la información genética que determina las características del organismo, proporciona el modelo para elaborar las proteínas necesarias para la vida y sirve como plantilla para transmitir esta información a la descendencia del organismo. Una molécula de ADN consiste en dos cadenas (anti-) paralelas de nucleótidos repetitivos, que forman su bien conocida estructura de doble hélice, como se muestra en la Figura\(\PageIndex{10}\).
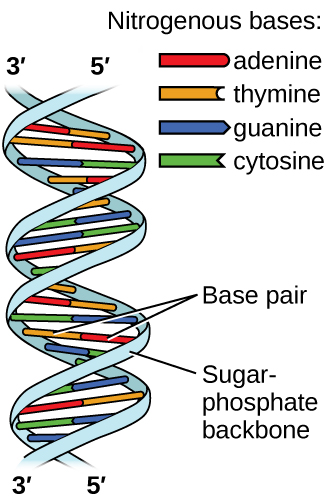
Cada nucleótido contiene un azúcar (desoxirribosa) unido a un grupo fosfato en un lado, y una de las cuatro bases nitrogenadas en el otro. Dos de las bases, citosina (C) y timina (T), son estructuras de un solo anillo conocidas como pirimidinas. Las otras dos, adenina (A) y guanina (G), son estructuras de doble anillo llamadas purinas. Estas bases forman pares de bases complementarias consistentes en una purina y una pirimidina, con apareamiento de adenina con timina, y citosina con guanina. Cada par de bases se mantiene unido por enlaces de hidrógeno. A y T comparten dos enlaces de hidrógeno, C y G comparten tres, y ambos emparejamientos tienen una forma y estructura similares Figura\(\PageIndex{12}\)
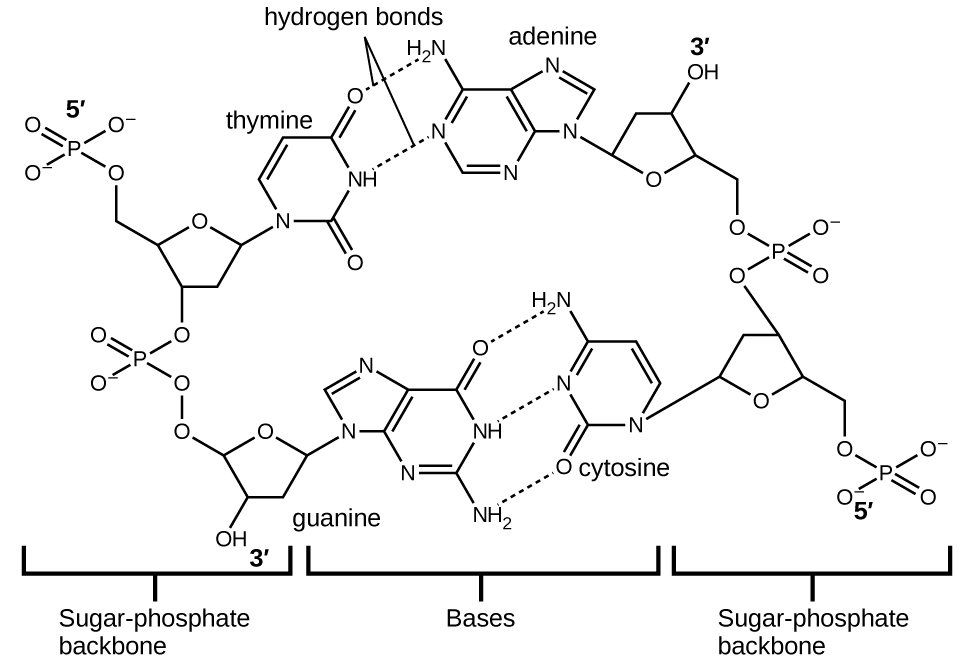
El efecto acumulativo de millones de enlaces de hidrógeno mantiene juntas las dos cadenas de ADN de manera efectiva. Es importante destacar que las dos cadenas de ADN pueden “descomprimir” con relativa facilidad por la mitad, ya que los enlaces de hidrógeno son relativamente débiles en comparación con los enlaces covalentes que mantienen unidos los átomos de las moléculas de ADN individuales. Esto permite que ambas cadenas funcionen como una plantilla para la replicación.
Resumen
Las propiedades físicas de la materia condensada (líquidos y sólidos) pueden explicarse en términos de la teoría molecular cinética. En un líquido, las fuerzas de atracción intermoleculares mantienen a las moléculas en contacto, aunque todavía tienen suficiente energía cinética para pasar unas de otras. Las fuerzas de atracción intermoleculares, denominadas colectivamente fuerzas de van der Waals, son responsables del comportamiento de líquidos y sólidos y son de naturaleza electrostática. Las atracciones dipolo-dipolo resultan de la atracción electrostática del extremo negativo parcial de una molécula dipolar para el extremo positivo parcial de otra. El dipolo temporal que resulta del movimiento de los electrones en un átomo puede inducir un dipolo en un átomo adyacente y dar lugar a la fuerza de dispersión de Londres. Las fuerzas de Londres aumentan con el aumento del tamaño molecular. Los enlaces de hidrógeno son un tipo especial de atracción dipolo-dipolo que resulta cuando el hidrógeno está unido a uno de los tres elementos más electronegativos: F, O o N.
Glosario
- atracción dipolo-dipolo
- atracción intermolecular entre dos dipolos permanentes
- fuerza de dispersión
- (también, la fuerza de dispersión de Londres) atracción entre dos dipolos temporales que fluctúan rápidamente; significativa solo cuando las partículas están muy juntas
- enlaces de hidrógeno
- ocurre cuando se atraen dipolos excepcionalmente fuertes; unión que existe cuando el hidrógeno está unido a uno de los tres elementos más electronegativos: F, O o N
- dipolo inducido
- dipolo temporal formado cuando los electrones de un átomo o molécula son distorsionados por el dipolo instantáneo de un átomo o molécula vecina
- dipolo instantáneo
- dipolo temporal que ocurre por un breve momento en el tiempo cuando los electrones de un átomo o molécula se distribuyen asimétricamente
- fuerza intermolecular
- fuerza de atracción no covalente entre átomos, moléculas y/o iones
- polarizabilidad
- medida de la capacidad de una carga para distorsionar la distribución de carga de una molécula (nube de electrones)
- fuerza van der Waals
- fuerza de atracción o repulsión entre moléculas, incluidas las fuerzas de dispersión dipolo-dipolo, dipolo inducido por dipolo y London; no incluye fuerzas debidas al enlace covalente o iónico, o la atracción entre iones y moléculas


