14.6: Búferes
- Page ID
- 75884
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Describir la composición y función de los tampones ácido-base
- Calcular el pH de un tampón antes y después de la adición de ácido o base añadidos
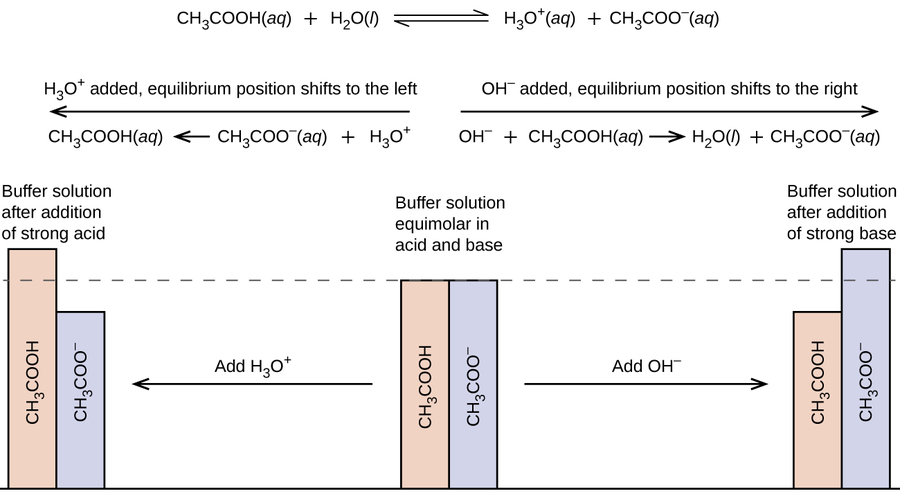
Una mezcla de un ácido débil y su base conjugada (o una mezcla de una base débil y su ácido conjugado) se llama solución tampón, o tampón. Las soluciones tampón resisten un cambio en el pH cuando se agregan pequeñas cantidades de un ácido fuerte o una base fuerte (Figura\(\PageIndex{1}\)). Una solución de ácido acético (\(\ce{CH3COOH}\)y acetato de sodio\(\ce{CH3COONa}\)) es un ejemplo de un tampón que consiste en un ácido débil y su sal. Un ejemplo de un tampón que consiste en una base débil y su sal es una solución de amoníaco (\(\ce{NH3(aq)}\)) y cloruro de amonio (\(\ce{NH4Cl(aq)}\)).

Cómo funcionan los búferes
Una mezcla de ácido acético y acetato de sodio es ácida porque la Ka del ácido acético es mayor que la K b de su acetato base conjugada. Es un tampón porque contiene tanto el ácido débil como su sal. De ahí que actúe para mantener la concentración de iones hidronio (y el pH) casi constantes mediante la adición de una pequeña cantidad de un ácido fuerte o una base fuerte. Si añadimos una base como el hidróxido de sodio, los iones hidróxido reaccionan con los pocos iones hidronio presentes. Entonces más ácido acético reacciona con el agua, restaurando la concentración de iones hidronio casi a su valor original:
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)⟶\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \nonumber \]
El pH cambia muy poco. Si añadimos un ácido como el ácido clorhídrico, la mayoría de los iones hidronio del ácido clorhídrico se combinan con iones acetato, formando moléculas de ácido acético:
\[\ce{H3O+}(aq)+\ce{CH3CO2-}(aq)⟶\ce{CH3CO2H}(aq)+\ce{H2O}(l) \nonumber \]
Así, hay muy poco incremento en la concentración del ión hidronio, y el pH permanece prácticamente sin cambios (Figura\(\PageIndex{2}\)).
Una mezcla de amoníaco y cloruro de amonio es básica porque el K b para el amoníaco es mayor que el K a para el ion amonio. Es un buffer porque también contiene la sal de la base débil. Si añadimos una base (iones hidróxido), los iones amonio en el tampón reaccionan con los iones hidróxido para formar amoníaco y agua y reducir la concentración de iones hidróxido casi a su valor original:
\[\ce{NH4+}(aq)+\ce{OH-}(aq)⟶\ce{NH3}(aq)+\ce{H2O}(l) \nonumber \]
Si agregamos un ácido (iones hidronio), las moléculas de amoníaco en la mezcla tampón reaccionan con los iones hidronio para formar iones amonio y reducir la concentración de iones hidronio casi a su valor original:
\[\ce{H3O+}(aq)+\ce{NH3}(aq)⟶\ce{NH4+}(aq)+\ce{H2O}(l) \nonumber \]
Las tres partes del siguiente ejemplo ilustran el cambio en el pH que acompaña a la adición de base a una solución tamponada de un ácido débil y a una solución no tamponada de un ácido fuerte.
Los tampones de acetato se utilizan en estudios bioquímicos de enzimas y otros componentes químicos de las células para prevenir cambios de pH que podrían cambiar la actividad bioquímica de estos compuestos.
- Calcular el pH de un tampón acetato que es una mezcla con ácido acético 0.10 M y acetato de sodio 0.10 M.
- Calcular el pH después de agregar 1.0 mL de NaOH 0.10 M a 100 mL de este tampón, dando una solución con un volumen de 101 mL.
Solución
- Calcular el pH de un tampón acetato que es una mezcla con ácido acético 0.10 M y acetato de sodio 0.10 M.
Para determinar el pH de la solución tampón utilizamos un cálculo de equilibrio típico (como se ilustra en ejemplos anteriores):
- Determinar la dirección del cambio. El equilibrio en una mezcla de H 3 O +\(\ce{CH3CO2-}\), y CH 3 CO 2 H es:
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \nonumber \]
No se da la constante de equilibrio para CH 3 CO 2 H, por lo que la buscamos en la Tabla E1: K a = 1.8 × 10 −5. Con [CH 3 CO 2 H] =\(\ce{[CH3CO2- ]}\) = 0.10 M y [H 3 O +] = ~0 M, la reacción se desplaza hacia la derecha para formar H 3 O +.
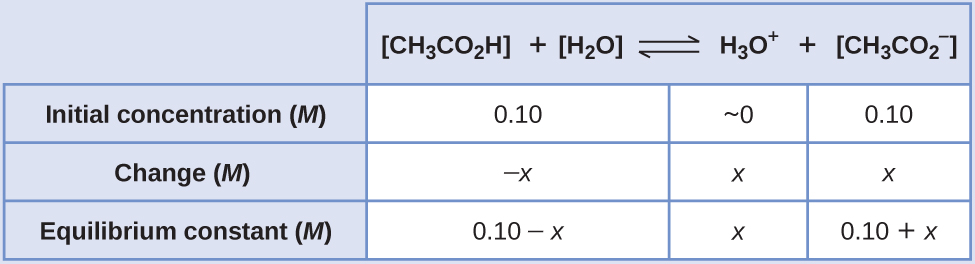
- Determinar x y concentraciones de equilibrio. A continuación se presenta una tabla de cambios y concentraciones:
- Determinar la dirección del cambio. El equilibrio en una mezcla de H 3 O +\(\ce{CH3CO2-}\), y CH 3 CO 2 H es:
- Resolver para x y las concentraciones de equilibrio. Nos encontramos con:
\[x=1.8×10^{−5}\:M \nonumber \]
- y
\[\ce{[H3O+]}=0+x=1.8×10^{−5}\:M \nonumber \]
Por lo tanto:\[\mathrm{pH=−log[H_3O^+]=−log(1.8×10^{−5})} \nonumber \]
\[=4.74 \nonumber \]
4. Revisar la obra. Si calculamos todas las concentraciones de equilibrio calculadas, encontramos que el valor de equilibrio del coeficiente de reacción, Q = K a.
(b) Calcular el pH después de agregar 1.0 mL de NaOH 0.10 M a 100 mL de este tampón, dando una solución con un volumen de 101 mL.
Primero, calculamos las concentraciones de una mezcla intermedia resultante de la reacción completa entre el ácido en el tampón y la base agregada. Luego determinamos las concentraciones de la mezcla en el nuevo equilibrio:
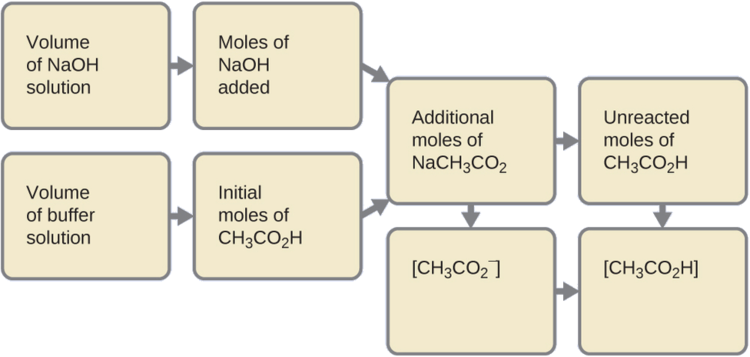
- Determinar los moles de NaOH. Un mililitro (0.0010 L) de NaOH 0.10 M contiene:
\[\mathrm{0.0010\cancel{L}×\left(\dfrac{0.10\:mol\: NaOH}{1\cancel{L}}\right)=1.0×10^{−4}\:mol\: NaOH} \nonumber \]
- Determinar los moles de CH 2 CO 2 H. Antes de la reacción, 0.100 L de la solución tampón contiene:
\[\mathrm{0.100\cancel{L}×\left(\dfrac{0.100\:mol\:CH_3CO_2H}{1\cancel{L}}\right)=1.00×10^{−2}\:mol\:CH_3CO_2H} \nonumber \]
- Resolver por la cantidad de nACh 3 CO 2 producido. El 1.0 × 10 −4 mol de NaOH neutraliza 1.0 × 10 −4 mol de CH 3 CO 2 H, dejando:
\[\mathrm{(1.0×10^{−2})−(0.01×10^{−2})=0.99×10^{−2}\:mol\:CH_3CO_2H} \nonumber \]
y produciendo 1.0 × 10 −4 mol de NaCH 3 CO 2. Esto hace un total de:
[\ mathrm {(1.0×10^ {−2}) + (0.01×10^ {−2}) =1.01×10^ {−2}\ :mol\ :nach_3co_2}\ nonumber\]
4. Encuentra la molaridad de los productos. Después de la reacción, CH 3 CO 2 H y NACh 3 CO 2 están contenidos en 101 mL de la solución intermedia, por lo que:
\[\ce{[CH3CO2H]}=\mathrm{\dfrac{9.9×10^{−3}\:mol}{0.101\:L}}=0.098\:M \nonumber \]
\[\ce{[NaCH3CO2]}=\mathrm{\dfrac{1.01×10^{−2}\:mol}{0.101\:L}}=0.100\:M \nonumber \]
Ahora calculamos el pH después de que la solución intermedia, que es de 0.098 M en CH 3 CO 2 H y 0.100 M en nACh 3 CO 2, llegue a equilibrio. El cálculo es muy similar al de la parte (a) de este ejemplo:

Esta serie de cálculos da un pH = 4.75. Así, la adición de la base apenas cambia el pH de la solución.
(c) Para comparación, calcular el pH después de agregar 1.0 mL de NaOH 0.10 M a 100 mL de una solución de una solución no tamponada con un pH de 4.74 (una solución 1.8 × 10 −5 - M de HCl). El volumen de la solución final es de 101 mL.
Solución
Esta solución 1.8 × 10 −5 M de HCl tiene la misma concentración de iones hidronio que la solución 0.10- M de tampón de ácido acético-acetato de sodio descrita en la parte (a) de este ejemplo. La solución contiene:
\(\mathrm{0.100\:L×\left(\dfrac{1.8×10^{−5}\:mol\: HCl}{1\:L}\right)=1.8×10^{−6}\:mol\: HCl} \)
Como se muestra en la parte (b), 1 mL de NaOH 0.10 M contiene 1.0 × 10 −4 mol de NaOH. Cuando se mezclan las soluciones de NaOH y HCl, el HCl es el reactivo limitante en la reacción. Todo el HCl reacciona, y la cantidad de NaOH que queda es:
\( (1.0×10^{−4})−(1.8×10^{−6})=9.8×10^{−5}\:M \)
La concentración de NaOH es:
\(\dfrac{9.8×10^{−5}\:M\:\ce{NaOH}}{0.101\:\ce{L}}=9.7×10^{−4}\:M \)
El PoH de esta solución es:
\(\mathrm{pOH=−log[OH^- ]=−log(9.7×10^{−4})=3.01} \)El pH es:
\(\mathrm{pH=14.00−pOH=10.99} \)
El pH cambia de 4.74 a 10.99 en esta solución no tamponada. Esto se compara con el cambio de 4.74 a 4.75 que ocurrió cuando se añadió la misma cantidad de NaOH a la solución tamponada descrita en la parte (b).
Mostrar que al agregar 1.0 mL de HCl 0.10 M se cambia el pH de 100 mL de una solución de HCl 1.8 × 10 −5 M de 4.74 a 3.00.
- Contestar
-
pH inicial de 1.8 × 10 −5 M HCl; pH = −log [H 3 O +] = −log [1.8 × 10 −5] = 4.74
Moles de H 3 O + añadidos por adición de 1.0 mL de HCl 0.10 M: 0.10 moles/L × 0.0010 L = 1.0 × 10-4 moles; pH final después de la adición de 1.0 mL de HCl 0.10 M:
\[\mathrm{pH=−log[H_3O^+]=−log\left(\dfrac{total\: moles\:H_3O^+}{total\: volume}\right)=−log\left(\dfrac{1.0×10^{−4}\:mol+1.8×10^{−6}\:mol}{101\:mL\left(\dfrac{1\:L}{1000\:mL}\right)}\right)=3.00} \nonumber \]
Capacidad de búfer
Las soluciones tampón no tienen una capacidad ilimitada para mantener el pH relativamente constante (Figura\(\PageIndex{3}\)). Si añadimos tanta base a un tampón que se agota el ácido débil, no es posible más acción amortiguadora hacia la base. Por otro lado, si añadimos un exceso de ácido, la base débil se agotaría, y no sería posible más acción tamponadora hacia ningún ácido adicional. De hecho, ni siquiera necesitamos agotar todo el ácido o base en un tampón para abrumarlo; su acción amortiguadora disminuirá rápidamente a medida que un componente dado se acerca al agotamiento.

Figura\(\PageIndex{3}\): El color indicador (naranja de metilo) muestra que una pequeña cantidad de ácido añadida a una solución tamponada de pH 8 (vaso de precipitados a la izquierda) tiene poco efecto sobre el sistema tamponado (vaso medio). Sin embargo, una gran cantidad de ácido agota la capacidad de tamponamiento de la solución y el pH cambia drásticamente (vaso de precipitados a la derecha). (crédito: modificación de obra por Mark Ott) La capacidad tampón es la cantidad de ácido o base que se puede agregar a un volumen dado de una solución tampón antes de que el pH cambie significativamente, generalmente en una unidad. La capacidad de tampón depende de las cantidades del ácido débil y su base conjugada que se encuentran en una mezcla tampón. Por ejemplo, 1 L de una solución que es 1.0 M en ácido acético y 1.0 M en acetato de sodio tiene una mayor capacidad tampón que 1 L de una solución que es 0.10 M en ácido acético y 0.10 M en acetato de sodio aunque ambas soluciones tengan el mismo pH. La primera solución tiene más capacidad tampón porque contiene más ácido acético e ion acetato.
Selección de Mezclas Buffer Adecuadas
Hay dos reglas útiles para seleccionar mezclas de búfer:
- Una buena mezcla tampón debe tener concentraciones aproximadamente iguales de ambos componentes. Una solución tampón generalmente ha perdido su utilidad cuando un componente del par de tampones es menor que aproximadamente 10% del otro. La Figura\(\PageIndex{4}\) muestra un tampón de iones ácido acético-acetato como base que se agrega. El pH inicial es de 4.74. Un cambio de 1 unidad de pH ocurre cuando la concentración de ácido acético se reduce a 11% de la concentración de iones acetato.
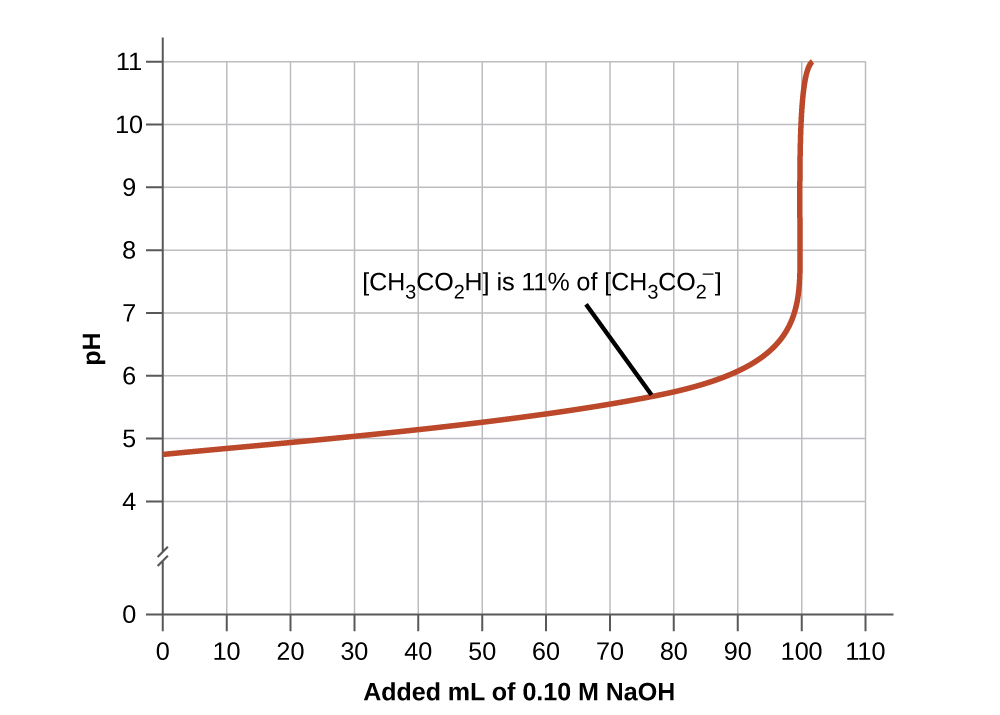
Figura\(\PageIndex{4}\): La gráfica, una ilustración de la acción tamponadora, muestra el cambio de pH a medida que se agrega una cantidad creciente de una solución de NaOH 0.10-M a 100 mL de una solución tampón en la que, inicialmente,\([\ce{CH3CO2H}] = 0.10\: M\) y\(\ce{[CH3CO2^{-}]}=0.10\:M\).
- Los ácidos débiles y sus sales son mejores como tampones para pH menores a 7; las bases débiles y sus sales son mejores como tampones para pH mayores a 7.
La sangre es un ejemplo importante de una solución tamponada, siendo el ácido y el ion principal responsable de la acción tamponante el ácido carbónico, H 2 CO 3, y el ion bicarbonato\(\ce{HCO3-}\). Cuando un exceso de iones de hidrógeno entra en el torrente sanguíneo, se elimina principalmente por la reacción:
\[\ce{H3O+}(aq)+\ce{HCO3-}(aq)⟶\ce{H2CO3}(aq)+\ce{H2O}(l) \nonumber \]
Cuando está presente un exceso del ion hidróxido, se elimina mediante la reacción:
\[\ce{OH-}(aq)+\ce{H2CO3}(aq)⟶\ce{HCO3-}(aq)+\ce{H2O}(l) \nonumber \]
El pH de la sangre humana se mantiene así muy cerca de 7.35, es decir, ligeramente básico. Las variaciones suelen ser menores a 0.1 de una unidad de pH. Un cambio de 0.4 de una unidad de pH es probable que sea fatal.
La aproximación Henderson-Hasselbalch
La expresión constante de ionización para una solución de un ácido débil se puede escribir como:
\[K_\ce{a}=\ce{\dfrac{[H3O+][A- ]}{[HA]}} \nonumber \]
Reordenando para resolver para [H 3 O +], obtenemos:
\[\ce{[H3O+]}=K_\ce{a}×\ce{\dfrac{[HA]}{[A- ]}} \nonumber \]
Tomando el logaritmo negativo de ambos lados de esta ecuación, llegamos a:
\[\mathrm{−log[H_3O^+]=−log\mathit{K}_a − log\dfrac{[HA]}{[A^- ]}} \nonumber \]
que se puede escribir como
\[\mathrm{pH=p\mathit{K}_a+log\dfrac{[A^- ]}{[HA]}} \nonumber \]
donde p K a es el negativo del logaritmo común de la constante de ionización del ácido débil (p K a = −log K a). Esta ecuación relaciona el pH, la constante de ionización de un ácido débil y las concentraciones del ácido débil y su sal en una solución tamponada. Los científicos suelen utilizar esta expresión, llamada aproximación Henderson-Hasselbalch, para calcular el pH de las soluciones tampón. Es importante señalar que la suposición “x es pequeña” debe ser válida para usar esta ecuación.
Lawrence Joseph Henderson (1878—1942) fue un médico, bioquímico y fisiólogo estadounidense, por nombrar sólo algunas de sus muchas actividades. Obtuvo el título de médico de Harvard y luego pasó 2 años estudiando en Estrasburgo, luego parte de Alemania, antes de regresar para ocupar un puesto de profesor en Harvard. Finalmente se convirtió en profesor en Harvard y trabajó allí toda su vida. Descubrió que el equilibrio ácido-base en la sangre humana está regulado por un sistema tampón formado por el dióxido de carbono disuelto en la sangre. Escribió una ecuación en 1908 para describir el sistema tampón de ácido carbónico-carbonato en la sangre. Henderson tenía amplio conocimiento; además de su importante investigación sobre la fisiología de la sangre, también escribió sobre las adaptaciones de los organismos y su ajuste con sus entornos, sobre sociología y sobre educación universitaria. También fundó el Laboratorio de Fatiga, en la Harvard Business School, que examinó la fisiología humana con enfoque específico en el trabajo en la industria, el ejercicio y la nutrición.
En 1916, Karl Albert Hasselbalch (1874-1962), médico y químico danés, compartió autoría en un artículo con Christian Bohr en 1904 que describía el efecto Bohr, que mostraba que la capacidad de la hemoglobina en la sangre para unirse con oxígeno estaba inversamente relacionada con la acidez de la sangre y la concentración de dióxido de carbono. La escala de pH fue introducida en 1909 por otro danés, Sørensen, y en 1912, Hasselbalch publicó mediciones del pH de la sangre. En 1916, Hasselbalch expresó la ecuación de Henderson en términos logarítmicos, consistentes con la escala logarítmica de pH, y así nació la ecuación de Henderson-Hasselbalch.
El pH normal de la sangre humana es de aproximadamente 7.4. El sistema de tampón de carbonato en la sangre utiliza la siguiente reacción de equilibrio:
\[\ce{CO2}(g)+\ce{2H2O}(l)⇌\ce{H2CO3}(aq)⇌\ce{HCO3-}(aq)+\ce{H3O+}(aq) \nonumber \]
La concentración de ácido carbónico, H 2 CO 3 es aproximadamente 0.0012 M, y la concentración del ion hidrogenocarbonato,\(\ce{HCO3-}\), es de alrededor de 0.024 M. Usando la ecuación de Henderson-Hasselbalch y la p K a del ácido carbónico a temperatura corporal, podemos calcular el pH de la sangre:
\[\mathrm{pH=p\mathit{K}_a+\log\dfrac{[base]}{[acid]}=6.1+\log\dfrac{0.024}{0.0012}=7.4} \nonumber \]
El hecho de que la concentración de H 2 CO 3 sea significativamente menor que la del\(\ce{HCO3-}\) ion puede parecer inusual, pero este desequilibrio se debe a que la mayoría de los subproductos de nuestro metabolismo que ingresan a nuestro torrente sanguíneo son ácidos. Por lo tanto, debe haber una mayor proporción de base que de ácido, de manera que no se supere la capacidad del tampón.
El ácido láctico se produce en nuestros músculos cuando hacemos ejercicio. A medida que el ácido láctico ingresa al torrente sanguíneo, es neutralizado por el\(\ce{HCO3-}\) ion, produciendo H 2 CO 3. Una enzima luego acelera la descomposición del exceso de ácido carbónico a dióxido de carbono y agua, que se puede eliminar respirando. De hecho, además de los efectos reguladores del sistema de tamponamiento de carbonato sobre el pH de la sangre, el cuerpo utiliza la respiración para regular el pH de la sangre. Si el pH de la sangre disminuye demasiado, un aumento en la respiración elimina CO 2 de la sangre a través de los pulmones impulsando la reacción de equilibrio de tal manera que se baja [H 3 O +]. Si la sangre es demasiado alcalina, una menor frecuencia respiratoria aumenta la concentración de CO 2 en la sangre, impulsando la reacción de equilibrio de otra manera, aumentando [H +] y restaurando un pH apropiado.
Resumen
Una solución que contiene una mezcla de un ácido y su base conjugada, o de una base y su ácido conjugado, se denomina solución tampón. A diferencia del caso de una solución de ácido, base o sal, la concentración de iones hidronio de una solución tampón no cambia mucho cuando se agrega una pequeña cantidad de ácido o base a la solución tampón. La base (o ácido) en el tampón reacciona con el ácido (o base) agregado.
Ecuaciones Clave
- p K a = −log K a
- p K b = −log K b
- \(\mathrm{pH=p\mathit{K}_a+\log\dfrac{[A^- ]}{[HA]}}\)
Glosario
- capacidad de búfer
- cantidad de un ácido o base que se puede agregar a un volumen de una solución tampón antes de que su pH cambie significativamente (generalmente en una unidad de pH)
- búfer
- mezcla de un ácido débil o una base débil y la sal de su conjugado; el pH de un tampón resiste el cambio cuando se agregan pequeñas cantidades de ácido o base
- Ecuación de Henderson-Hasselbalch
- ecuación utilizada para calcular el pH de las soluciones tampón
- Determinar los moles de NaOH. Un mililitro (0.0010 L) de NaOH 0.10 M contiene:


