8.13.2.1: Iones haluro como agentes reductores
- Page ID
- 81398
Esta página examina las reacciones redox que involucran iones haluro y ácido sulfúrico concentrado, utilizando estas reacciones para discutir la tendencia a reducir la capacidad de los iones de fluoruro a yoduro. Dos tipos de reacciones pueden ocurrir cuando se agrega ácido sulfúrico concentrado a un haluro iónico sólido como fluoruro, cloruro, bromuro o yoduro de sodio. El ácido sulfúrico concentrado puede actuar tanto como ácido como agente oxidante.
Ácido sulfúrico concentrado que actúa como un ácido
El ácido sulfúrico concentrado transfiere un protón al ion haluro para producir un haluro de hidrógeno gaseoso, el cual escapa inmediatamente del sistema. Si el haluro de hidrógeno se expone al aire húmedo, se forman humos de vapor. Por ejemplo, el ácido sulfúrico concentrado reacciona con cloruro de sodio sólido a bajas temperaturas para producir cloruro de hidrógeno y bisulfato de sodio, como en la siguiente ecuación:
\[ NaCl + H_2SO_4 \rightarrow HCl + NaHSO_4\]
Todos los iones haluro se comportan de manera similar.
Ácido sulfúrico concentrado que actúa como agente oxidante
Con fluoruro o cloruro
El ácido sulfúrico concentrado no es un agente oxidante lo suficientemente fuerte como para oxidar fluoruro o cloruro. En esos casos, solo se producen los humos humeantes del haluro de hidrógeno, fluoruro de hidrógeno o cloruro de hidrógeno. En cuanto a los iones haluro, el fluoruro y el cloruro no son agentes reductores lo suficientemente fuertes como para reducir el ácido sulfúrico. Este no es el caso de los bromuros y yoduros.
Con bromuro
El bromuro es un agente reductor lo suficientemente fuerte como para reducir el ácido sulfúrico. El bromuro se oxida a bromo en el proceso, como en la media ecuación a continuación:
\[ 2Br^- \rightarrow Br_2 + 2e^-\]
El bromuro reduce el ácido sulfúrico a gas dióxido de azufre, disminuyendo el estado de oxidación del azufre de +6 a +4. La semiecuación para esta transición es la siguiente:
\[ H_2SO_4 + 2H^+ + 2e^- \rightarrow SO_2 + 2H_2O\]
Estas dos medias ecuaciones se pueden combinar en la ecuación iónica general para la reacción:
\[ H_2SO_4 + 2H^+ + 2Br^- \rightarrow Br_2 +SO_2 +2H_2O\]
En la práctica, esta reacción es confirmada por los vapores de bromuro de hidrógeno contaminados con el color marrón del vapor de bromo. El dióxido de azufre es un gas incoloro, su presencia no se puede observar directamente.
Con yoduro
El yoduro es un agente reductor más fuerte que el bromuro, y es oxidado a yodo por el ácido sulfúrico:
\[ 2I^- \rightarrow I_2 +2e^-\]
La reducción del ácido sulfúrico es más complicada que con bromuro. El yoduro es lo suficientemente potente como para reducirlo en tres pasos:
- ácido sulfúrico a dióxido de azufre (estado de oxidación de azufre = +4)
- dióxido de azufre a azufre elemental (estado de oxidación = 0)
- azufre a sulfuro de hidrógeno (estado de oxidación de azufre = -2).
El producto más abundante es el sulfuro de hidrógeno. La semiecuación para su formación es la siguiente:
\[H_2SO_4 + 8H^+ + 8e^- \rightarrow H_2S + 4H2O\]
La combinación de estas dos medias ecuaciones da la siguiente ecuación iónica neta:
\[ H_2SO_4 + 8H^+ + 8I^- \rightarrow 4I_2 + H_2S + 4H2O\]
Esto se confirma con un rastro de humos humeantes de yoduro de hidrógeno, y una gran cantidad de yodo. La reacción es exotérmica: se forma vapor de yodo púrpura, condensándose yodo sólido gris oscuro alrededor de la parte superior del recipiente de reacción. También hay un color rojo donde el yodo entra en contacto con sales sólidas de yoduro. El color rojo se debe al ion I 3 - formado por la reacción entre I 2 moléculas e I - iones. El gas sulfuro de hidrógeno se puede detectar por su olor a “huevo podrido”, pero este gas es intensamente venenoso.
Resumen de la tendencia en la reducción de la capacidad
- El fluoruro y el cloruro no pueden reducir el ácido sulfúrico concentrado.
- El bromuro reduce el ácido sulfúrico a dióxido de azufre. En el proceso, los iones bromuro se oxidan a bromo.
- El yoduro reduce el ácido sulfúrico a una mezcla de productos que incluyen sulfuro de hidrógeno. Los iones yoduro se oxidan a yodo.
- La capacidad reductora de los iones haluro aumenta en el grupo.
Explicando la tendencia
Una explicación demasiado simplificada
La siguiente explicación es solo (parcialmente) precisa si se descuida el fluoruro. Cuando un ion haluro actúa como agente reductor, transfiere electrones a otra cosa. Eso significa que el ion haluro mismo pierde electrones. Cuanto más grande es el ion haluro, más lejos están los electrones externos del núcleo, y más están protegidos por electrones internos. Por lo tanto, resulta más fácil que los iones haluro pierdan electrones en el grupo porque hay menos atracción entre los electrones externos y el núcleo. Este argumento parece válido, pero es defectuoso. Se debe examinar la energética del cambio.
Una explicación más detallada
Variación del cambio de entalpía entre halógenos
Se debe considerar la cantidad de calor desprendido o absorbido cuando un haluro sólido (como el cloruro de sodio) se convierte en un halógeno elemental. Tomando como ejemplo el cloruro de sodio, son importantes las siguientes cantidades energéticas:
- La energía requerida para romper las atracciones entre los iones en el cloruro de sodio (la entalpía de la red).
- La energía requerida para eliminar el electrón del ion cloruro. Esto es lo inverso de la afinidad electrónica del cloro (la afinidad electrónica puede adquirirse de una tabla de datos y anularse).
- La energía se recuperó cuando los átomos de cloro se convierten en cloro diatómico. La energía se libera cuando se forman estos enlaces. El cloro es simple porque es un gas. En bromo y yodo, el calor también se libera durante la condensación a un líquido o un sólido, respectivamente. Para dar cuenta de esto, es más sencillo pensar en términos de energía de atomización en lugar de energía de enlace. El valor de interés es el reverso de la energía de atomización.
La energía de atomización es la energía necesaria para producir 1 mol de átomos gaseosos aislados a partir de un elemento en su estado estándar (gas para cloro y líquido para bromo, por ejemplo, ambos como X 2). La siguiente figura muestra cómo encaja esta información:
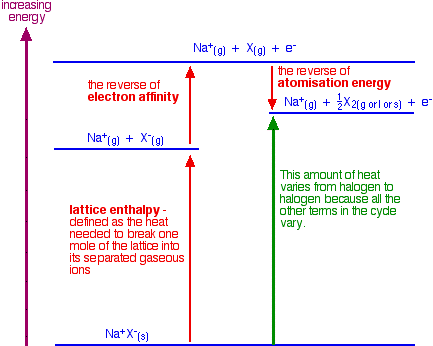
Se debe comparar el cambio de entalpía que muestra la flecha verde en el diagrama para cada uno de los halógenos. El diagrama muestra que el cambio global que involucra a los iones haluro es endotérmico (la flecha verde apunta hacia arriba hacia una mayor energía).
Este no es el cambio total de entalpía para toda la reacción. El calor se emite cuando ocurren los cambios que involucran el ácido sulfúrico. Eso es lo mismo independientemente del halógeno en cuestión. El cambio de entalpía total es la suma de los cambios de entalpía para la semirreacción de ion haluro y la semirreacción de ácido sulfúrico.
La siguiente tabla muestra los cambios de energía que varían de halógeno a halógeno. Se supone que el proceso comienza a partir del haluro de sodio sólido. Los valores para las entalpías reticulares para otros haluros sólidos serían diferentes, pero el patrón sería el mismo.
| calor necesario para romper la red NaX (kJ mol -1) |
calor necesario para eliminar el electrón del ion haluro (kJ mol -1) |
calor liberado en la formación de moléculas halógenas (kJ mol -1) |
suma de estos (kJ mol-1) |
|
|---|---|---|---|---|
| F | +902 | +328 | -79 | +1151 |
| Cl | +771 | +349 | -121 | +999 |
| Br | +733 | +324 | -112 | +945 |
| I | +684 | +295 | -107 | +872 |
El cambio global de entalpía para la semirreacción de haluro:
La suma de los cambios de entalpía, en la columna final, es decrecientemente endotérmica en el grupo. El cambio total en la entalpía (incluyendo el ácido sulfúrico) también es menos positivo.
La cantidad de calor producido en la media reacción que involucra al ácido sulfúrico debe ser lo suficientemente grande como para hacer factibles las reacciones con el bromuro o yoduro, pero no suficiente para compensar los valores más positivos producidos por las semirreacciones de fluoruro y cloruro.
Explorando los cambios en los diversos términos energéticos
En esta sección, se determinan los términos de energía individual en la tabla que son más importantes para hacer que la semirreacción halógena sea menos endotérmica en el grupo.
Cloro a yodo
De cloro a yodo, la entalpía reticular cambia más, disminuyendo 87 kJ mol -1. Por el contrario, la energía requerida para eliminar el electrón disminuye en solo 54 kJ mol -1. Ambos términos importan, pero la disminución de la entalpía reticular es la más significativa. Esta cantidad disminuye porque los iones son cada vez más grandes. Eso significa que están más alejados el uno del otro, y así se disminuyen las atracciones entre los iones positivos y negativos en la red sólida.
La explicación simplificada mencionada anteriormente es engañosa porque se concentra en la disminución menos importante en la cantidad de energía necesaria para eliminar el electrón del ion.
Flúor
Los iones fluoruro son muy difíciles de oxidar a flúor. La tabla anterior muestra que esto no tiene nada que ver con la cantidad de energía requerida para eliminar un electrón de un ion fluoruro. En realidad, se necesita menos energía para eliminar un electrón de un ion fluoruro que de un ion cloruro. La generalización de que un electrón se vuelve más fácil de eliminar a medida que el ion se hace más grande no se aplica aquí.
Los iones fluoruro son tan pequeños que los electrones experimentan una fuerte repulsión entre sí. Esto supera el efecto de su cercanía al núcleo y los hace más fáciles de eliminar de lo que predice el argumento simplificado.
Hay dos razones importantes por las que los iones fluoruro son tan difíciles de oxidar. La primera es la entalpía de celosía comparativamente alta del fluoruro sólido. Esto se debe al pequeño tamaño del ion fluoruro, lo que significa que los iones positivo y negativo están muy unidos entre sí y por lo tanto fuertemente atraídos entre sí. El otro factor es la pequeña cantidad de calor que se libera cuando los átomos de flúor se combinan para formar moléculas de flúor (ver la tabla anterior). Esto se debe a la baja entalpía de enlace del enlace F-F. La razón de esta entalpía de baja unión se discute en una página separada.
¿Y si los iones haluro estuvieran en solución y no en un sólido?
Esta discusión se ha centrado en la energía del proceso a partir de iones haluro sólidos porque ese es el procedimiento estándar cuando se usa ácido sulfúrico concentrado. Los haluros también podrían oxidarse en solución con otro agente oxidante.
La tendencia es exactamente la misma. El fluoruro es difícil de oxidar y se vuelve más fácil en el grupo hacia el yoduro; en otras palabras, los iones fluoruro no son buenos agentes reductores, pero los iones yoduro lo son.
La explicación parte de los iones hidratados en solución en lugar de iones sólidos. En cierto sentido, esto ya se ha hecho en otra página. El flúor es un agente oxidante muy potente porque forma muy fácilmente su ion negativo en solución. Por lo tanto, es energéticamente difícil revertir el proceso. Por el contrario, por razones energéticas, el yodo es relativamente reacio a formar su ion negativo en solución. Por lo tanto, es relativamente fácil para él volver a yodo.
Colaboradores y Atribuciones
Jim Clark (Chemguide.co.uk)


