9.5: Otros aspectos de los enlaces covalentes
- Page ID
- 74908
- Describir un enlace no polar y un enlace polar.
- Utilice la electronegatividad para determinar si un enlace entre dos elementos será covalente no polar, covalente polar o iónico.
- Describir la energía de enlace de un enlace covalente.
Considere la molécula H 2:
\[\mathbf{H}\: \mathbf{: H}\nonumber \]
Debido a que los núcleos de cada átomo de H contienen protones, los electrones en el enlace son atraídos hacia los núcleos (las cargas opuestas se atraen). Pero debido a que los dos átomos involucrados en el enlace covalente son ambos átomos de H, cada núcleo atrae a los electrones en la misma cantidad. Así, el par de electrones es igualmente compartido por los dos átomos. La distribución equitativa de electrones en un enlace covalente se denomina enlace covalente no polar.
Ahora considere la\(HF\) molécula:

Hay dos átomos diferentes involucrados en el enlace covalente. El átomo H tiene un protón en su núcleo que está atrayendo el par de electrones de unión. Sin embargo, el átomo F tiene nueve protones en su núcleo, con nueve veces la atracción del átomo H. El átomo F atrae a los electrones con tanta fuerza que los electrones permanecen más cerca del átomo F que del átomo H; los electrones ya no están igualmente equilibrados entre los dos núcleos. En lugar de representar la molécula de HF como

puede ser más apropiado dibujar el enlace covalente como
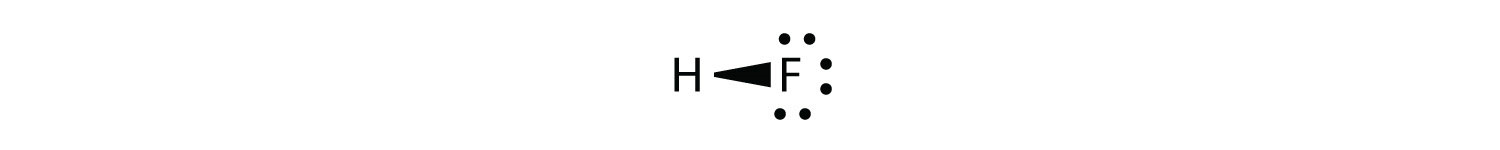
estando los electrones en el enlace más cercanos al átomo F que al átomo H. Debido a que los electrones en el enlace están más cerca del átomo F, este lado de la molécula adquiere una carga negativa parcial, que está representada por δ− (δ es la letra griega minúscula delta). El otro lado de la molécula, el átomo de H, adopta una carga positiva parcial, que está representada por δ+:
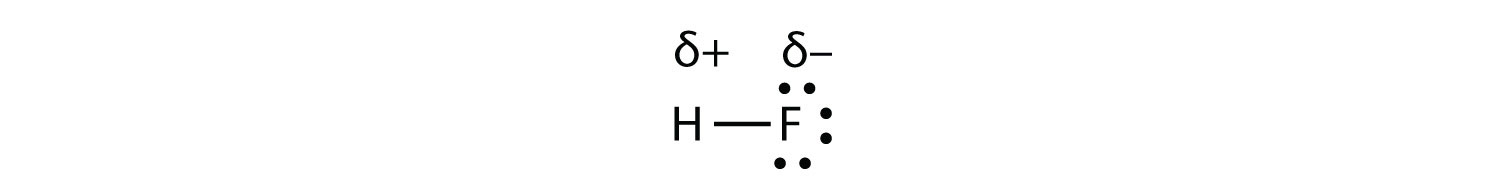
Un enlace covalente entre diferentes átomos que atraen los electrones compartidos en diferentes cantidades, y provocan un desequilibrio de distribución de electrones se denomina enlace covalente polar.
Técnicamente, cualquier enlace covalente entre dos elementos diferentes es polar. Sin embargo, el grado de polaridad es importante. Un enlace covalente entre dos elementos diferentes puede estar tan ligeramente desequilibrado que el enlace es, esencialmente, no polar. Un enlace puede ser tan polar que un electrón realmente se transfiere de un átomo a otro, formando un verdadero enlace iónico. ¿Cómo juzgamos el grado de polaridad? Los científicos han ideado una escala llamada electronegatividad, una escala para juzgar cuán fuertemente los átomos de cualquier elemento atraen electrones. La electronegatividad es un número sin unidades; cuanto mayor es el número, más atrae un átomo a los electrones. En la Figura se muestra una escala común para la electronegatividad\(\PageIndex{1}\).
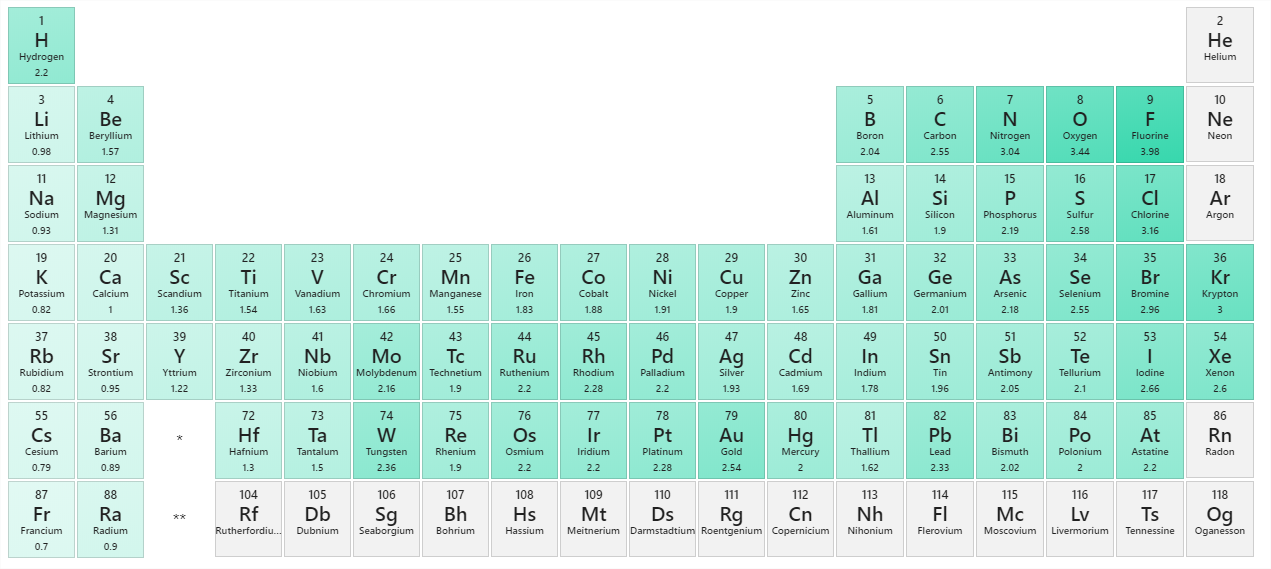
La polaridad de un enlace covalente puede juzgarse determinando la diferencia de las electronegatividades de los dos átomos involucrados en el enlace covalente, como se resume en la siguiente tabla:
| Diferencia de Electronegatividad | Tipo de enlace |
|---|---|
| 0 | covalente no polar |
| 0—0.4 | covalente ligeramente polar |
| 0.4—1.9 | definitivamente covalente polar |
| >1.9 | probable iónica |
¿Cuál es la polaridad de cada enlace?
- C—H
- O—H
Solución
Usando Figura\(\PageIndex{1}\), podemos calcular la diferencia de las electronegatividades de los átomos involucrados en el enlace.
- Para el enlace C—H, la diferencia en las electronegatividades es 2.5 − 2.1 = 0.4. Por lo tanto, predecimos que este enlace será ligeramente covalente polar.
- Para el enlace O—H, la diferencia en electronegatividades es 3.5 − 2.1 = 1.4, por lo que predecimos que este enlace será definitivamente covalente polar.
¿Cuál es la polaridad de cada enlace?
- Rb—F
- P—Cl
- Contestar a
-
probable iónica
- Respuesta b
-
covalente polar
La polaridad de un enlace covalente puede tener una influencia significativa en las propiedades de la sustancia. Si la molécula global es polar, la sustancia puede tener un punto de fusión y punto de ebullición más altos de lo esperado; además, puede o no ser soluble en otras sustancias diversas, como agua o hexano.
Debe ser obvio que los enlaces covalentes son estables porque existen moléculas. Sin embargo, pueden romperse si se suministra suficiente energía a una molécula. Para la mayoría de los enlaces covalentes entre dos átomos dados, se debe suministrar una cierta cantidad de energía. Aunque la cantidad exacta de energía depende de la molécula, la cantidad aproximada de energía a suministrar es similar si los átomos en el enlace son los mismos. La cantidad aproximada de energía necesaria para romper un enlace covalente se denomina energía de enlace del enlace covalente. Tabla\(\PageIndex{1}\), enumera las energías de enlace de algunos enlaces covalentes.
| Bond | Energía (kJ/mol) | Bond | Energía (kJ/mol) | |
|---|---|---|---|---|
| C—C | 348 | N—N | 163 | |
| C=C | 611 | N=N | 418 | |
| C=C | 837 | N=N | 946 | |
| C—O | 351 | N—H | 389 | |
| C=O | 799 | O—O | 146 | |
| C—Cl | 328 | O=O | 498 | |
| C—H | 414 | O—H | 463 | |
| F—F | 159 | S—H | 339 | |
| H—Cl | 431 | S=O | 523 | |
| H—F | 569 | Si—H | 293 | |
| H—H | 436 | Si—O | 368 |
Algunas tendencias son obvias a partir de Table\(\PageIndex{1}\). Para los enlaces que involucran los mismos dos elementos, un doble enlace es más fuerte que un enlace simple, y un triple enlace es más fuerte que un doble enlace. Las energías de los enlaces múltiples no son múltiplos exactos de la energía del enlace simple; para los enlaces carbono-carbono, la energía aumenta algo menos que duplicar o triplicar la energía del enlace C-C, mientras que para los enlaces nitrógeno-nitrógeno la energía del enlace aumenta a una velocidad mayor que el múltiplo de la energía de enlace simple N-N. Las energías de enlace en la Tabla\(\PageIndex{1}\) son valores promedio; el valor exacto de la energía de enlace covalente variará ligeramente entre las moléculas con estos enlaces, pero debe estar cerca de estos valores.
Para romperse, los enlaces covalentes siempre requieren energía; es decir, la ruptura del enlace covalente es siempre un proceso endotérmico. Por lo tanto, el Δ H para este proceso es positivo:
Molécula—O—H → Molécula—O + H
con Δ H ≈ +463 kJ/mol
Sin embargo, al hacer un enlace covalente, siempre se desprende energía; la formación de enlaces covalentes es siempre un proceso exotérmico. Así pues, Δ H para este proceso es negativo:
Molécula—S + H → Molécula—S—H
con Δ H ≈ −339 kJ/mol
Las energías de enlace se pueden utilizar para estimar el cambio de energía de una reacción química. Cuando se rompen enlaces en los reactivos, el cambio de energía para este proceso es endotérmico. Cuando se forman enlaces en los productos, el cambio de energía para este proceso es exotérmico. Combinamos el cambio de energía positiva con el cambio de energía negativa para estimar el cambio energético general de la reacción. Por ejemplo, en
2H 2 + O 2 → 2H 2 O
podemos dibujar diagramas de puntos electrónicos de Lewis para cada sustancia para ver qué enlaces se rompen y qué enlaces se forman:
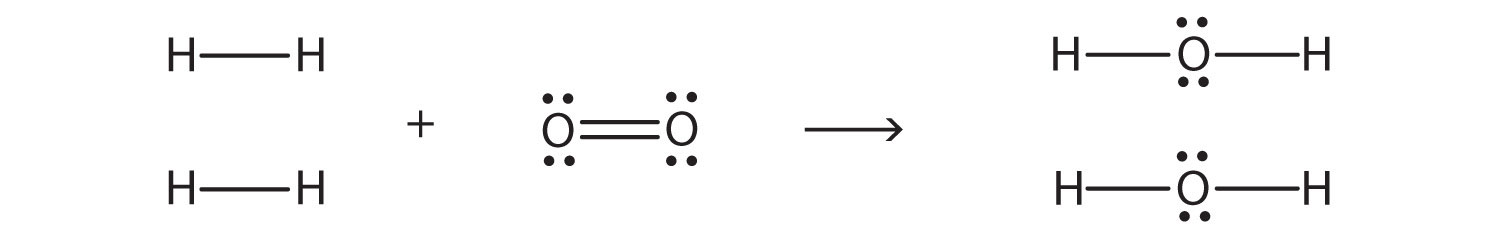
(Los pares de electrones solitarios en los átomos de O se omiten para mayor claridad). Estamos rompiendo dos enlaces H—H y un doble enlace O-O y formando cuatro enlaces sencillos O-H. La energía requerida para romper los bonos es la siguiente:
| 2 bonos H—H: | 2 (+436 kJ/mol) |
|---|---|
| 1 enlace O=O: | +498 kJ/mol |
| Total: | +1,370 kJ/mol |
La energía que se desprende cuando se hacen los cuatro enlaces O-H es la siguiente:
| 4 bonos O—H: | 4 (−463 kJ/mol) |
|---|---|
| Total: | −1,852 kJ/mol |
Combinando estos dos números:
| +1,370 kJ/mol + (−1,852 kJ/mol) | |
|---|---|
| Cambio neto: | −482 kJ/mol ≈ Δ H |
El ΔH real es −572 kJ/mol; estamos apagados en aproximadamente 16%. Aunque no es ideal, una diferencia de 16% es razonable porque utilizamos energías de enlace estimadas, no exactas.
Estimar el cambio energético de esta reacción.
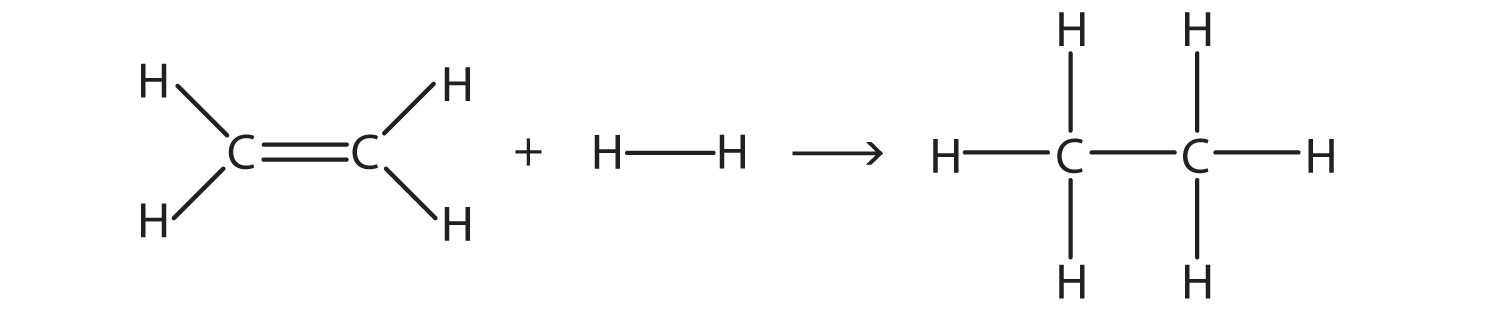
Solución
Aquí, estamos rompiendo un doble enlace C-C y un enlace sencillo H—H y haciendo un enlace sencillo C—C y dos enlaces sencillos C—H. La ruptura de enlaces es endotérmica, mientras que la formación de enlaces es exotérmica. Para la ruptura del enlace:
| 1 C=C: | +611 kJ/mol |
|---|---|
| 1 H—H: | +436 kJ/mol |
| Total: | +1,047 kJ/mol |
Para la fabricación de bonos:
| 1 C—C: | −348 kJ/mol |
|---|---|
| 2 C—H: | 2 (−414 kJ/mol) |
| Total | −1,176 kJ/mol |
En general, el cambio de energía es +1,047 + (−1,176) = −129 kJ/mol.
Estimar el cambio energético de esta reacción.
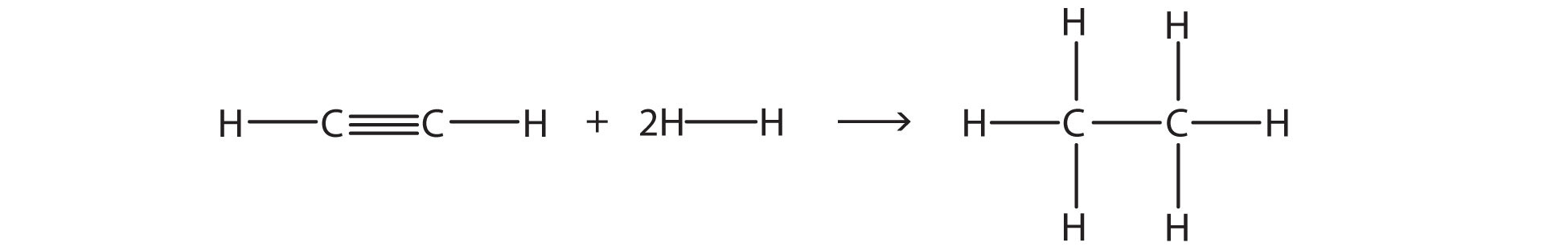
Resumen
- Los enlaces covalentes pueden ser no polares o polares, dependiendo de las electronegatividades de los átomos involucrados.
- Los enlaces covalentes pueden romperse si se agrega energía a una molécula.
- La formación de enlaces covalentes va acompañada de energía desprendida.
- Las energías de enlace covalente se pueden utilizar para estimar los cambios de entalpía de las reacciones químicas.


