4.10: Reglas para escribir fórmulas de Lewis
( \newcommand{\kernel}{\mathrm{null}\,}\)
- Escribe estructuras de Lewis para moléculas e iones.
- Conocer las excepciones a la regla del octeto.
Se puede usar el siguiente procedimiento para construir estructuras de electrones de Lewis para moléculas e iones más complejos:
1. Determinar el número total de electrones de valencia en la molécula o ion.
- Sumar los electrones de valencia de cada átomo. (Recordemos que el número de electrones de valencia está indicado por la posición del elemento en la tabla periódica.)
- Si la especie es un ion poliatómico, recuerde sumar o restar el número de electrones necesarios para dar la carga total sobre el ion.
Para CO 3 2 −, por ejemplo, agregamos dos electrones al total debido a la carga −2.
2. Organizar los átomos para mostrar conexiones específicas.
- Cuando hay un átomo central, suele ser el elemento menos electronegativo en el compuesto. Los químicos suelen enumerar este átomo central primero en la fórmula química (como en CCl 4 y CO 3 2 −, que ambos tienen C como átomo central), que es otra pista de la estructura del compuesto.
- El hidrógeno y los halógenos casi siempre están conectados a un solo átomo más, por lo que suelen ser terminales en lugar de centrales.
3. Colocar un par de electrones de unión entre cada par de átomos adyacentes para dar un enlace sencillo.
- En H 2 O, por ejemplo, hay un par de enlaces de electrones entre el oxígeno y cada hidrógeno.
4. Comenzando con los átomos terminales, añadir suficientes electrones a cada átomo para dar a cada átomo un octeto (dos para hidrógeno).
- Estos electrones suelen ser pares solitarios.
5. Si sobran electrones, colóquelos en el átomo central.
- Explicaremos más adelante que algunos átomos son capaces de acomodar más de ocho electrones.
6. Si el átomo central tiene menos electrones que un octeto, use pares solitarios de átomos terminales para formar múltiples (dobles o triples) enlaces al átomo central para lograr un octeto.
- Esto no cambiará el número de electrones en los átomos terminales.
7. Cheque final
- Asegúrese siempre de que se tengan en cuenta todos los electrones de valencia y que cada átomo tenga un octeto de electrones a excepción del hidrógeno (con dos electrones).
El átomo central suele ser el elemento menos electronegativo en la molécula o ion; el hidrógeno y los halógenos suelen ser terminales.
Ahora apliquemos este procedimiento a algunos compuestos particulares, comenzando con uno que ya hemos comentado.
Escribe la Estructura de Lewis para H 2 O.
Solución
| Pasos para escribir estructuras de Lewis | Ejemplo4.10.1: |
|---|---|
| 1. Determinar el número total de electrones de valencia en la molécula o ion. | \ (\ PageIndex {1}\):” style="vertical-align:middle; ">Cada átomo H (grupo 1) tiene 1 electrón de valencia, y el átomo O (grupo 16) tiene 6 electrones de valencia, para un total de 8 electrones de valencia. |
| 2. Organizar los átomos para mostrar conexiones específicas. | \ (\ pageIndex {1}\):” style="vertical-align:middle; ">
H O HDebido a que los átomos de H son casi siempre terminales, la disposición dentro de la molécula debe ser HOH. |
|
3. Colocar un par de electrones de unión entre cada par de átomos adyacentes para dar un enlace sencillo. 4. Comenzando con los átomos terminales, añadir suficientes electrones a cada átomo para dar a cada átomo un octeto (dos para hidrógeno). |
\ (\ pageIndex {1}\):” style="vertical-align:middle; ">
Colocar un par de electrones de unión entre el átomo de O y cada átomo de H da H -O- Hcon 4 electrones sobrantes. Cada átomo H tiene una capa de valencia completa de 2 electrones. |
| 5. Si sobran electrones, colóquelos en el átomo central. | \ (\ pageIndex {1}\):” style="vertical-align:middle; ">
Agregar los 4 electrones restantes al oxígeno (como dos pares solitarios) da la siguiente estructura:
|
| 6. Si el átomo central tiene menos electrones que un octeto, use pares solitarios de átomos terminales para formar múltiples (dobles o triples) enlaces al átomo central para lograr un octeto. | \ (\ PageIndex {1}\):” style="vertical-align:middle; ">No es necesario |
| 7. Cheque final | \ (\ PageIndex {1}\):” style="vertical-align:middle; ">La estructura de Lewis le da al oxígeno un octeto y a cada hidrógeno dos electrones, |
Escribe la estructura de Lewis para laCH2O molécula
Solución
| Pasos para escribir estructuras de Lewis | Ejemplo4.10.2 |
|---|---|
| 1. Determinar el número total de electrones de valencia en la molécula o ion. | \ (\ PageIndex {2}\) ">Cada átomo de hidrógeno (grupo 1) tiene un electrón de valencia, carbono (grupo 14) tiene 4 electrones de valencia y oxígeno (grupo 16) tiene 6 electrones de valencia, para un total de [(2) (1) + 4 + 6] = 12 electrones de valencia. |
| 2. Organizar los átomos para mostrar conexiones específicas. | \ (\ PageIndex {2}\) ">
Debido a que el carbono es menos electronegativo que el oxígeno y el hidrógeno es normalmente terminal, C debe ser el átomo central. |
| 3. Colocar un par de electrones de unión entre cada par de átomos adyacentes para dar un enlace sencillo. | \ (\ PageIndex {2}\) ">
La colocación de un par de electrones de unión entre cada par de átomos unidos da lo siguiente: 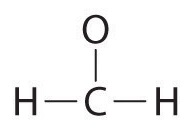 |
Se utilizan seis electrones y quedan 6.
4. Comenzando con los átomos terminales, añadir suficientes electrones a cada átomo para dar a cada átomo un octeto (dos para hidrógeno). \ (\ PageIndex {2}\) ">Agregar los 6 electrones restantes al oxígeno (como tres pares solitarios) da lo siguiente:

Aunque ahora el oxígeno tiene un octeto y cada hidrógeno tiene 2 electrones, el carbono solo tiene 6 electrones.
5. Si sobran electrones, colóquelos en el átomo central. \ (\ PageIndex {2}\) ">No es necesario
No quedan electrones para colocar sobre el átomo central.
6. Si el átomo central tiene menos electrones que un octeto, use pares solitarios de átomos terminales para formar múltiples (dobles o triples) enlaces al átomo central para lograr un octeto. \ (\ PageIndex {2}\) ">Para darle al carbono un octeto de electrones, usamos uno de los pares solitarios de electrones en el oxígeno para formar un doble enlace carbono-oxígeno:
Escriba estructuras de electrones de Lewis para CO 2 y SCl 2, un líquido rojo inestable con olor a vil que se utiliza en la fabricación de caucho.
- Respuesta CO 2
-
.


- Responder SCl 2
-
.
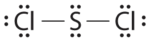
El Tribunal Supremo de Estados Unidos tiene la tarea poco envidiable de decidir cuál es la ley. Esta responsabilidad puede ser un reto importante cuando no hay un principio claro involucrado o donde hay una nueva situación no encontrada antes. La química enfrenta el mismo desafío al extender los conceptos básicos para adaptarse a una nueva situación. El dibujo de las estructuras de Lewis para iones poliatómicos utiliza el mismo enfoque, pero ajusta un poco el proceso para adaptarse a un conjunto de circunstancias algo diferente.
Estructuras de Lewis para iones poliatómicos
Recordemos que un ion poliatómico es un grupo de átomos que están unidos covalentemente entre sí y que llevan una carga eléctrica general. El ion amonio,NH+4, se forma cuando un ión hidrógeno(H+) se une al par solitario de una(NH3) molécula de amoníaco en un enlace covalente coordinado.
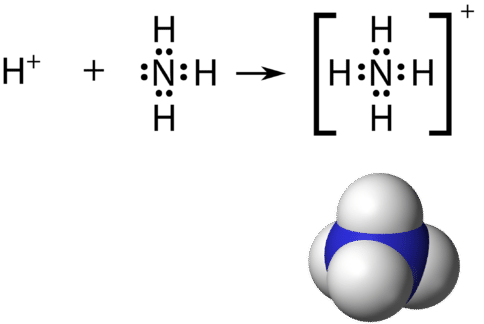
Al dibujar la estructura de Lewis de un ion poliatómico, la carga del ion se refleja en el número de electrones de valencia total en la estructura. En el caso del ion amonio:
1Nelectrones de=5 valencia de átomos
4Hátomos=4×1=4 valencia electrones
restar 1 electrón para la1+ carga del ion
total de 8 electrones de valencia en el ion
Se acostumbra poner la estructura Lewis de un ion poliatómico en un gran conjunto de corchetes, con la carga del ion como un superíndice fuera de los corchetes.
Dibuje la estructura de punto de electrones de Lewis para el ion sulfato.
- Contestar

Excepciones a la Regla del Octeto
Tan importante y útil como la regla del octeto es en la unión química, existen algunas violaciones bien conocidas. Esto no quiere decir que la regla del octeto sea inservible, sino todo lo contrario. Como ocurre con muchas reglas, hay excepciones, o violaciones.
Hay tres violaciones a la regla del octeto. Las moléculas de electrones impares representan la primera violación a la regla del octeto. Aunque son pocos, algunos compuestos estables tienen un número impar de electrones en sus conchas de valencia. Con un número impar de electrones, al menos un átomo en la molécula tendrá que violar la regla del octeto. Ejemplos de moléculas estables de electrones impares son NO, NO 2 y ClO 2. El diagrama de puntos electrónicos de Lewis para NO es el siguiente:

Aunque el átomo O tiene un octeto de electrones, el átomo de N tiene sólo siete electrones en su caparazón de valencia. Aunque el NO es un compuesto estable, es muy reactivo químicamente, como lo son la mayoría de los otros compuestos de electrones impares.
Las moléculas deficientes en electrones representan la segunda violación a la regla del octeto. Estos compuestos estables tienen menos de ocho electrones alrededor de un átomo en la molécula. Los ejemplos más comunes son los compuestos covalentes de berilio y boro. Por ejemplo, el berilio puede formar dos enlaces covalentes, dando como resultado solo cuatro electrones en su capa de valencia:

El boro comúnmente produce solo tres enlaces covalentes, lo que resulta en solo seis electrones de valencia alrededor del átomo B. Un ejemplo bien conocido es BF 3:

La tercera violación a la regla del octeto se encuentra en aquellos compuestos con más de ocho electrones asignados a su caparazón de valencia. Estas se llaman moléculas de concha de valencia expandida. Dichos compuestos están formados únicamente por átomos centrales en la tercera fila de la tabla periódica o más allá que tienen orbitales d vacíos en sus conchas de valencia que pueden participar en enlaces covalentes. Uno de esos compuestos es PF 5. El único diagrama de puntos electrónicos de Lewis razonable para este compuesto tiene el átomo de P que forma cinco enlaces covalentes:

Formalmente, el átomo P tiene 10 electrones en su caparazón de valencia.
Identificar cada violación a la regla del octeto dibujando un diagrama de puntos de Lewis.
- ClO
- SF 6
Solución
a. con un átomo de Cl y un átomo de O, esta molécula tiene 6 + 7 = 13 electrones de valencia, por lo que es una molécula de electrones impares. Un diagrama de puntos de electrones de Lewis para esta molécula es el siguiente:
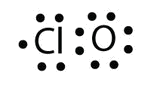
b. En SF 6, el átomo central de S forma seis enlaces covalentes a los seis átomos F circundantes, por lo que es una molécula de cubierta de valencia expandida. Su diagrama de puntos electrónicos de Lewis es el siguiente:

Identificar la violación a la regla del octeto en xEF 2 dibujando un diagrama de puntos de Lewis.
- Respuesta:
-

El átomo de Xe tiene una capa de valencia expandida con más de ocho electrones a su alrededor.
Resumen
- Los símbolos de punto de Lewis (estructuras de Lewis) proporcionan una simple racionalización de por qué los elementos forman compuestos con las estequiometrías observadas.
- En las estructuras de electrones de Lewis, encontramos pares de unión, que son compartidos por dos átomos, y pares solitarios, que no se comparten entre átomos.
- Las estructuras de Lewis para iones poliatómicos siguen las mismas reglas que las de otros compuestos covalentes.
- Hay tres violaciones a la regla del octeto: moléculas de electrones impares, moléculas deficientes en electrones y moléculas de concha de valencia expandida
Colaboradores y Atribuciones
Modified by Joshua Halpern (Howard University)
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Henry Agnew (UC Davis)



