5.2: Griseofulvin
- Page ID
- 70275
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
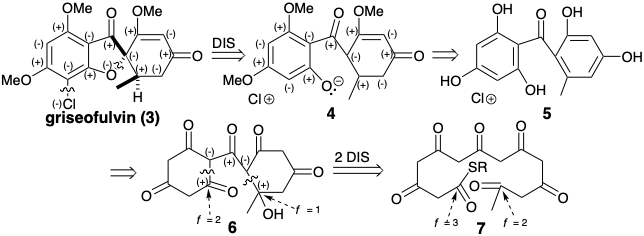
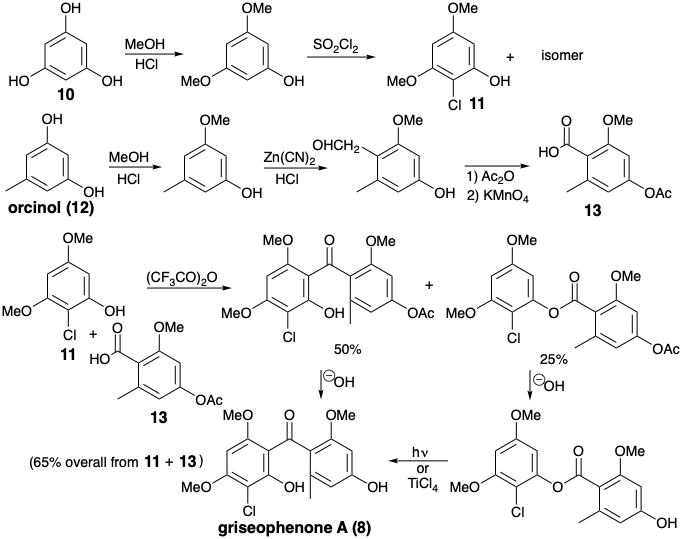
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)El análisis de reactividad polar de la griseofulvin (3) revela circuitos disonantes que involucran al sustituyente cloro y oxígeno furano. Una dislocación que escinde estos circuitos disonantes sugiere un precursor completamente consonante 4 o el pariente cercano aromático 5. Esta desconexión —entre un átomo común, el carbono espiro, y un átomo no común, el oxígeno furano— también conduce a una importante simplificación topológica. La desconexión del anillo de anillos en 5 para generar un precursor acíclico debe ir precedida por la conversión de los enlaces C=C del anillo en enlaces C-C. Así, la adición de agua o tautomerización da un precursor 6 en el que es factible la desconexión polar de enlaces simples C-C. El nivel de funcionalidad en los centros electrófilos en el precursor acíclico 7 sugerido por esta desconexión polar debe ser una unidad mayor que en el intermedio 6 si la ciclación de 6 es para producir 7 directamente.
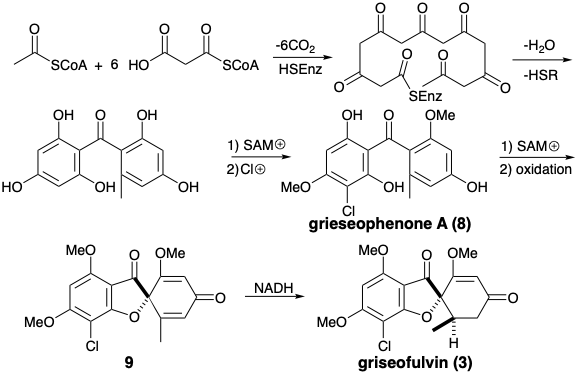
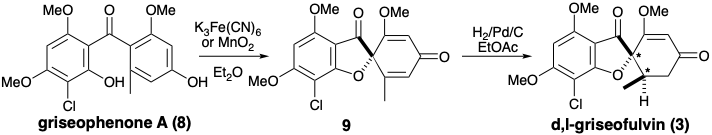
La biosíntesis de griseofulvina (3) ilustra la implicación de la sustitución aromática electrófila y el acoplamiento oxidativo en la transformación de una cadena de poli-β-cetometileno en una acetogenina funcional y esqueléticamente compleja. Así, condensaciones intramoleculares aldólicas de un tioéster de ácido 3,5,7,9,11,13-hexacetohexadecanoico unido a enzimas seguido de hidrólisis, O-metilación con S-adenosil metionina (SAM) y cloración aromática electrófila genera un intermedio, la griseofenona A (8). Una conexión disonante en el anillo furano de la griseofulvin se crea por un acoplamiento oxidativo que genera deshidrogriseofulvin (9) a partir de 8. Reducción estereoselectiva de 9 con NADH luego entrega griseofulvin (3).
Una Síntesis Biomimética de Griseofulvin
Un acoplamiento oxidativo inducido por ferricianuro de griseofenona A (8) a deshidrogriseofulvin (9) con fue explotado en una síntesis biomimética total de griseofulvin racémica. 2 Los materiales de partida simétricos, floroglucinol (10) y orcinol (12) se elaboraron en los intermedios 11 y 13 mediante sustituciones aromáticas electrófilas bien precedentes. La acilación de 11 con 13 ocurrió principalmente al carbono. El producto de O-acilación se reorganizó fácilmente al producto de acilación C, proporcionando así griseofenona A (8) con un buen rendimiento global. La conversión de 8 a d, l-griseofulvin (3) fue muy similar a la vía biosintética.
Estrategias de Anelación de Ciclohexenona Polar para Griseofulvin
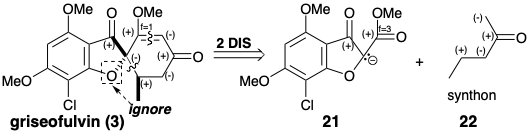
Se sugiere una estrategia para la síntesis total de griseofulvin mediante un análisis polar que ignora la activación polar proporcionada por el oxígeno furano. La desconexión de dos enlaces a un átomo común, el carbono espiro, en 3 conduce a una mayor simplificación topológica, y sugiere un precursor nucleofílico sintón 14 y un precursor biselectrofílico sintetizón 15. El eneyne 16 es un equivalente sintético de 15 que debería proporcionar 3 directamente debido a que la adición 1,4-de un nucleófilo disminuirá el nivel de instauración de cada centro electrófilo en una unidad.
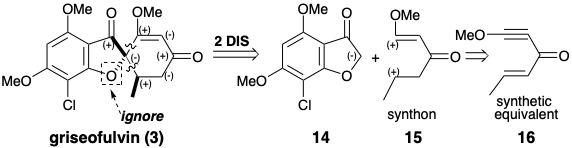
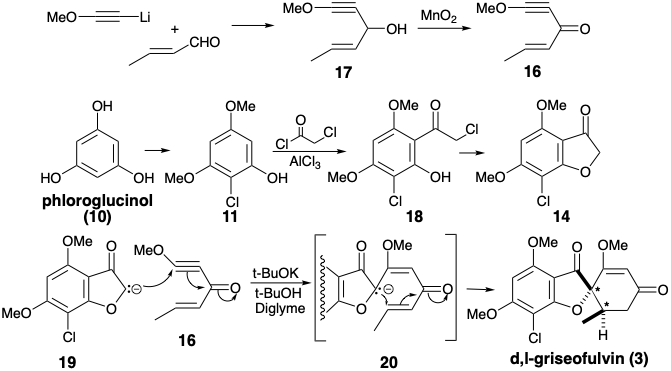
El biselectrofilo 16 se preparó a partir de metoxiacetileno y crotonaldehído, y el precursor 14 del nucleófilo disonante requerido se obtuvo del floroglucinol (10) vía 18 producido por acilación de 11 con cloruro de cloroacetilo. Cabe señalar que la disonancia en el anillo furano de 14 se deriva del precursor disonante cloruro de cloroacetilo. Tratamiento de una mezcla de 14 y 16 con base entregada 3 vía aniones 19 y 20. 3
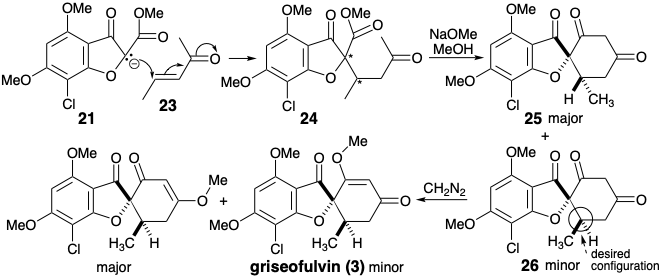
También se sugiere una estrategia diferente mediante un análisis polar que ignora la activación polar proporcionada por el oxígeno furano. La desconexión de dos enlaces del anillo de ciclohexenona como en 3 sugiere una anelación de ciclohexanodionas bien precedida que es similar a una anelación de Robinson (ver sección 4.7). En contraste con la estrategia anterior, no se produce directamente un metil enol éter. La enona 23 sirve como equivalente sintético para el sintón 22.
La condensación de 21 con 23 da dos ciclohexanodionas diastereoméricas 25 y 26. Esta síntesis es menos eficiente que la anterior debido a que el diastereómero mayor 25 es epimérico con el producto natural 3 y la metileeterificación del diastereómero menor 26 ocurre con regioselectividad desfavorable. 4
Una estrategia de cicloadición para griseofulvin
La estrategia de Danishefsky para una síntesis total de griseofulvin 5 se diseñó alrededor de su método para la anelación de ciclohexenona a través de la reacción Diels-Alder de dienos altamente oxigenados, e.g., 27.
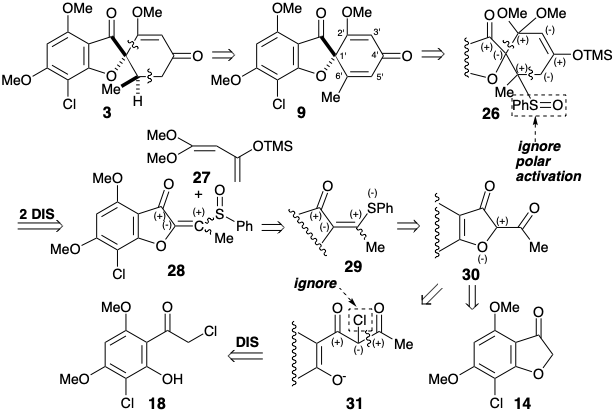
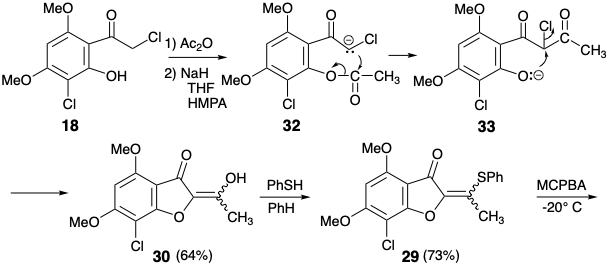
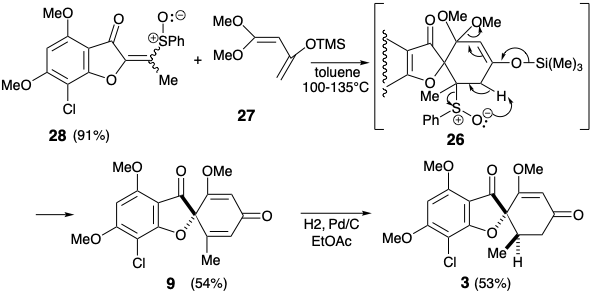
Esta condición límite guía y canaliza el análisis retrosintético para buscar una desconexión de dos enlaces del anillo de ciclohexenona a un precursor de butadieno y dienófilo. Además, se adoptó la conversión estereoselectiva de 9 para dar 3 establecidos previamente 2 para simplificar la estereoquímica de la diana. La dislocación a 9 elimina un centro asimétrico, que puede introducirse al final de la síntesis por hidrogenación estereoselectiva. Para la reacción de Diels-Alder deseada, se requiere un enlace C=C entre los carbonos 3' y 4'. Por lo tanto, los enlaces 2',3' y 5',6' C=C en 9 deben generarse después del paso clave Diels-Alder. El enlace 3',4' C=C requerido es proporcionado por dislocación de 9 al derivado enol-ceta1 26. El enlace 5',6' C=C podría ser introducido en 26 por una variedad de procesos de eliminación. La elección de un sulfóxido como grupo saliente viene dictada por la utilidad adicional del grupo sulfóxido para activar el dienófilo 28 hacia la reacción de Diels-Alder con el dieno 27 que es necesariamente rico en electrones. También se puede esperar que el sulfóxido no controle la selectividad estructural de la reacción de Diels-Alder, que será controlada por el grupo carbonilo del anillo de furanona en 28. El grupo sulfóxido aceptor de electrones es disonante con respecto al carbonilo furanona en 28, pero se puede obtener por oxidación del grupo sulfuro donador de electrones correspondiente en 29. Este sulfuro de vinilo consonante es simplemente un derivado de sulfuro de enol del precursor de diona 30. Esta diona podría estar disponible por acilación de la furanona 14 que se utilizó en una síntesis previa de griseofulvin. Alternativamente, la construcción del enlace C-O disonante en 30 podría lograrse después de completar el esqueleto de carbono, pero se requeriría un nucleófugo en 31 porque los grupos carbonilo no pueden proporcionar la electrofilia requerida. Ignorando el grupo cloro en 31, la matriz 1,3-dicarbonilo es consonante y puede construirse por acilación Claisen de la cetona 18 que también se utilizó en la síntesis estereoselectiva previa discutida anteriormente.
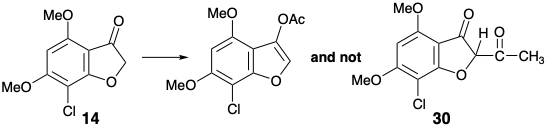
De hecho, la O-acilación del anión enolato de 14 ocurre hasta la exclusión completa de la acilación de carbono requerida para producir 30. Por otro lado, una administración intramolecular del electrófilo de acetilo en 32 sirvió para desenmascarar la O-alquilación intramolecular del fenolato intermedio 33 liberó la diona 30 deseada que existe como tautomero de enol. La conversión del sulfuro enol 29 de 30 en el sulfóxido correspondiente se completó por oxidación selectiva del sulfuro en presencia de un enlace C=C con MCPBA a baja temperatura. La adición de Diels-Alder del vinil sulfóxido 28 resultante al 1,3-dieno 27 fue seguida, in situ, por eliminación térmica de ácido fenilsulfénico y metoxitrimetilsilano de un intermedio ciclohexeno 26 para suministrar ciclohexadienona 9.