20.6: Reacciones de Aminas
- Page ID
- 76128
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Amina como nucleófilos
Las aminas rara vez sirven como grupos lábiles en las reacciones de sustitución nucleofílica o de eliminación catalizadas por bases. De hecho, son incluso menos efectivos en este papel que los grupos hidroxilo y alcoxilo. Si bien veremos otra sección en la que es posible coaxizar la amina para que sirva como grupo de salida. Como bases débiles, las aminas son buenos nucleófilos.
Amina y Carbonilos
La reacción de aldehídos y cetonas con amoníaco o 1º-aminas forma derivados de imina, también conocidos como bases de Schiff (compuestos que tienen una función C=N). El agua se elimina en la reacción, la cual es catalizada por ácido y es reversible en el mismo sentido que la formación de acetal. El pH de las reacciones que forman compuestos de imina debe controlarse cuidadosamente. La velocidad a la que se forman estos compuestos de imina es generalmente mayor cerca de un pH de 5, y cae a pH mayores e inferiores. A pH alto no habrá suficiente ácido para protonar el OH en el intermedio para permitir la eliminación como H 2 O. A pH bajo la mayor parte del reactivo amínico se amarrará como su ácido conjugado amónico y se volverá no nucleofílico.
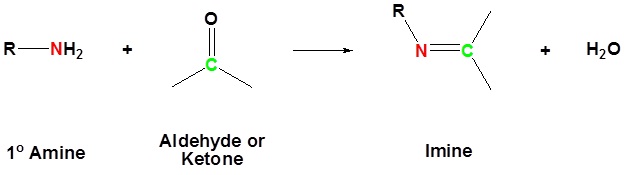
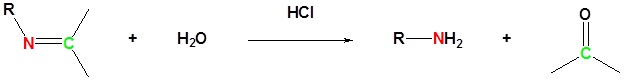
La formación de imina es reversible. Las iminas pueden hidrolizarse de nuevo a la amina primaria correspondiente en condiciones acuosas ácidas.
La mayoría de los aldehídos y cetonas reaccionan con 2º-aminas para dar productos conocidos como enaminas.
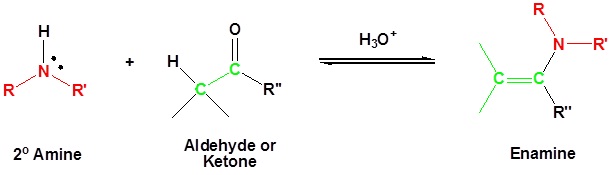
Cabe señalar que, al igual que la formación de acetal e imina, se trata de reacciones reversibles catalizadas por ácido en las que se pierde agua. En consecuencia, las enaminas se convierten fácilmente de nuevo en sus precursores de carbonilo por hidrólisis catalizada por ácido.
Aminas y Cloruros de Ácido
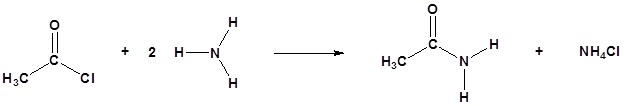
Los cloruros de ácido reaccionan con amoníaco, 1 o aminas y 2 o aminas para formar amidas.

| Ejemplos: |
|---|
|
|
Aminas y cloruro de sulfonilo
El grupo sulfonilo es el análogo de azufre al grupo carbonilo. Ambos grupos contienen un carbono carbonílico electrófilo con cloruro como un excelente grupo lábil. Debido a que el azufre es un tercer elemento de concha, puede formar “octetos expandidos”.

Las aminas reaccionan con grupos sulfonilo para formar sulfonamidas. Las sulfonamidas se utilizan como agentes antimicrobianos terapéuticamente y se denominan fármacos sulfa. La reacción para formar sulfonamidas ocurre bajo condiciones alcalinas para mantener la amina nucleófila. Cada vez que las aminas están presentes en una solución acuosa, el hidróxido medible está presente. El mecanismo para la reacción de sulfonación es análogo al mecanismo de acilación como se muestra a continuación.
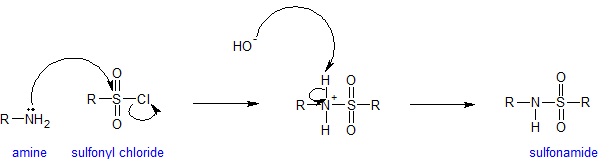
Al final de este capítulo se incluye alguna información adicional sobre las sulfonamidas.
Alquilaciones
Es instructivo examinar las reacciones de sustitución de nitrógeno usando haluros de alquilo comunes como electrófilos. Así, la reacción de un bromuro de alquilo primario con un gran exceso de amoníaco produce la 1º-amina correspondiente, presumiblemente por un mecanismo S N 2. El bromuro de hidrógeno producido en la reacción se combina con parte del exceso de amoníaco, dando bromuro de amonio como subproducto. El agua normalmente no reacciona con haluros de 1º-alquilo para dar alcoholes, por lo que se demuestra claramente la nucleofilia potenciada del nitrógeno respecto al oxígeno.
2 RCH 2 Br + NH 3 (gran exceso) RCH 2 NH 2 + NH 4 (+) Br (—) RCH 2 NH 2 + NH 4 (+) Br (—) |
De ello se deduce que las aminas simples también deberían ser más nucleofílicas que sus equivalentes de alcohol o éter. Si, por ejemplo, deseamos llevar a cabo una reacción de S N 2 de un alcohol con un haluro de alquilo para producir un éter (la síntesis de Williamson), es necesario convertir el alcohol débilmente nucleófilo en su base conjugada más nucleófila para que ocurra la reacción. Por el contrario, las aminas reaccionan directamente con haluros de alquilo para dar productos N-alquilados. Dado que esta reacción produce HBr como coproducto, también se formarán sales bromhidrato de la amina alquilada o amina de partida sin reaccionar (en equilibrio).
2 RNH 2 + C 2 H 5 Br RNHC 2 H 5 + RNH 3 (+) Br (—) RNHC 2 H 5 + RNH 3 (+) Br (—) RNH 2 C 2 H 5 (+) Br (—) + RNH 2 RNH 2 C 2 H 5 (+) Br (—) + RNH 2 |
Desafortunadamente, la alquilación directa de 1º o 2º-aminas para dar un producto más sustituido no procede limpiamente. Si se usa una relación 1:1 de amina a haluro de alquilo, solo el 50% de la amina reaccionará porque la amina restante se atará como una sal de haluro de amonio (recuerde que se produce un equivalente del ácido fuerte HX). Si se usa una relación 2:1 de amina a agente alquilante, como en la ecuación anterior, se resuelve el problema de HX, pero surge otro problema. Tanto la amina de partida como la amina producto son nucleófilos. En consecuencia, una vez iniciada la reacción, la amina producto compite con el material de partida en las últimas etapas de alquilación, y también se forman algunos productos alquilados superiores. Incluso las 3º-aminas pueden alquilarse para formar sales de amonio cuaternario (4º). Cuando se desean sales de tetraalquilamonio, como se muestra en el siguiente ejemplo, se puede usar la base de Hünig para eliminar el HI producido en las tres reacciones de S N 2. El impedimento estérico evita que esta 3º-amina (base de Hünig) se metile.
C 6 H 5 NH 2 + 3 CH 3 I + base de Hünig C 6 H 5 N (CH 3) 3 (+) I (—) + HI sal de base de Hünig
C 6 H 5 N (CH 3) 3 (+) I (—) + HI sal de base de Hünig
Obtienes una serie complicada de reacciones al calentar aminas primarias con halogenoalcanos para dar una mezcla de productos -probablemente uno de los conjuntos de reacciones más confusos que encontrarás en este nivel. Los productos de las reacciones incluyen aminas secundarias y terciarias y sus sales, y sales de amonio cuaternario.
Elaboración de aminas secundarias y sus sales
En la primera etapa de la reacción, se obtiene la sal de una amina secundaria formada. Por ejemplo, si empezaste con etilamina y bromoetano, obtendrías bromuro de dietilamonio

En presencia de exceso de etilamina en la mezcla, existe la posibilidad de una reacción reversible. La etilamina elimina un hidrógeno del ion dietilamonio para dar dietilamina libre, una amina secundaria.

Elaboración de aminas terciarias y sus sales
¡Pero no se detiene aquí! La dietilamina también reacciona con bromoetano, en las mismas dos etapas que antes. Aquí es donde comenzaría la reacción si reaccionara una amina secundaria con un halogenoalcano.
En la primera etapa, se obtiene bromuro de trietilamonio.

De nuevo existe la posibilidad de una reacción reversible entre esta sal y el exceso de etilamina en la mezcla.

La etilamina elimina un ion hidrógeno del ion trietilamonio para dejar una amina terciaria - trietilamina.
Hacer una sal de amonio cuaternario
¡La etapa final! La trietilamina reacciona con bromoetano para dar bromuro de tetraetilamonio, una sal de amonio cuaternario (una en la que los cuatro hidrógenos han sido reemplazados por grupos alquilo).

Esta vez no queda ningún hidrógeno en el nitrógeno a eliminar. La reacción se detiene aquí.
Ejercicio
10. Dibuja los productos de las siguientes reacciones.

11. Dibujar la estructura del reactivo necesario para producir el producto indicado.
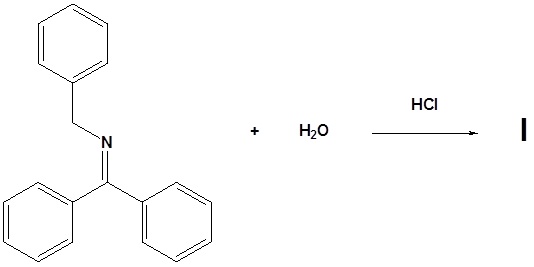
12. Dibuja los productos para las siguientes reacciones.

13. Dibuja el reactivo faltante para completar cada reacción a continuación.

Contestar
-
10.
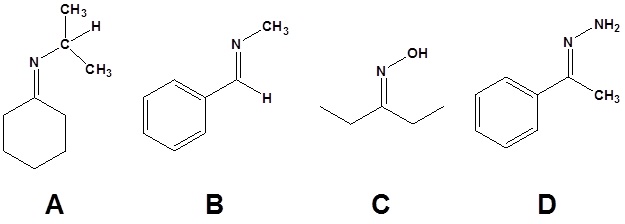
11.

12.
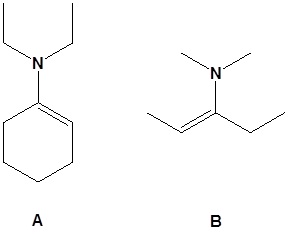
13.
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry