2.5: Interacciones no covalentes
- Page ID
- 72338
Hasta ahora nos hemos estado enfocando en comprender los enlaces covalentes que mantienen unidas las moléculas individuales. Pasamos a continuación a una revisión sobre el tema de las interacciones no covalentes entre moléculas, o entre diferentes grupos funcionales dentro de una sola molécula. Probablemente ya hayas aprendido todos estos conceptos en tu curso de química general, pero esta revisión se centrará en aplicaciones a la química orgánica y biológica, y específicamente nos permitirá explicar las diferencias en las propiedades físicas -tales como puntos de ebullición, puntos de fusión y solubilidad- entre diferentes compuestos orgánicos. La comprensión de las interacciones no covalentes también es fundamental para observar el ambiente dentro del sitio activo de una enzima, donde tiene lugar gran parte de la química que estudiaremos en este libro.
Dipolos
Para comprender la naturaleza de las interacciones no covalentes, primero debemos regresar a los enlaces covalentes y profundizar en el tema de los dipolos. Muchos de los enlaces covalentes que hemos visto —entre dos carbonos, por ejemplo, o entre un carbono y un hidrógeno— implican la distribución aproximadamente igual de electrones entre los dos átomos en el enlace. En estos ejemplos, los dos átomos tienen aproximadamente la misma electronegatividad. Recuerda de tu curso de química general que la electronegatividad se refiere a “el poder de un átomo en una molécula para atraer electrones hacia sí misma” (esta es la definición que ofrece Linus Pauling, el eminente químico estadounidense del siglo XX que fue el principal responsable de desarrollar muchos de los vínculos conceptos que venimos aprendiendo).
Sin embargo, muy a menudo en la química orgánica tratamos de enlaces covalentes entre dos átomos con diferentes electronegatividades, y en estos casos el reparto de electrones no es igual: cuanto más núcleo electronegativo acerca a los dos electrones. En el enlace carbono-oxígeno de un alcohol, por ejemplo, los dos electrones en el enlace s igma se mantienen más estrechamente al oxígeno que al carbono, porque el oxígeno es significativamente más electronegativo que el carbono. Lo mismo ocurre con el enlace oxígeno-hidrógeno, ya que el hidrógeno es ligeramente menos electronegativo que el carbono, y mucho menos electronegativo que el oxígeno.
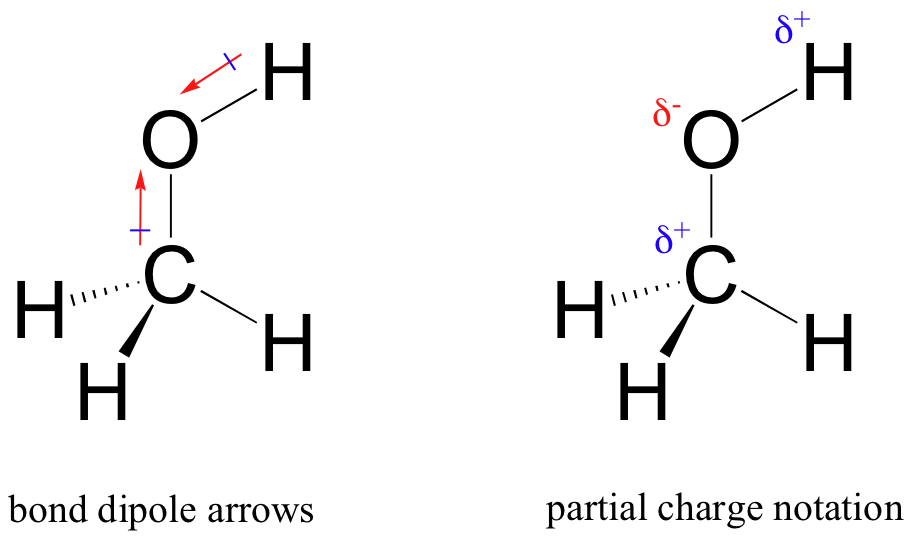
El resultado de este reparto desigual es lo que llamamos un dipolo de enlace, que existe en un enlace covalente polar. Un dipolo de enlace tiene extremos negativos y positivos, o polos, donde la densidad de electrones es menor (el polo positivo) y mayor (el polo negativo). La diferencia en la densidad de electrones se puede expresar usando la letra griega delta para denotar carga 'positiva parcial' y 'negativa parcial' en los átomos. Las 'flechas dipolos', con un signo positivo en la cola, también se utilizan para indicar la dirección negativa (mayor densidad de electrones) del dipolo.
El grado de polaridad en un enlace covalente depende de la diferencia de electronegatividad entre los dos átomos. La electronegatividad es una tendencia periódica: aumenta yendo de izquierda a derecha a través de una fila de la tabla periódica de los elementos, y también aumenta a medida que subimos una columna. Por lo tanto, el oxígeno es más electronegativo que el nitrógeno, que a su vez es más electronegativo que el carbono. El oxígeno también es más electronegativo que el azufre. El flúor, en la esquina superior derecha de la tabla periódica, es el más electronegativo de los elementos. El hidrógeno es ligeramente menos electronegativo que el carbono.
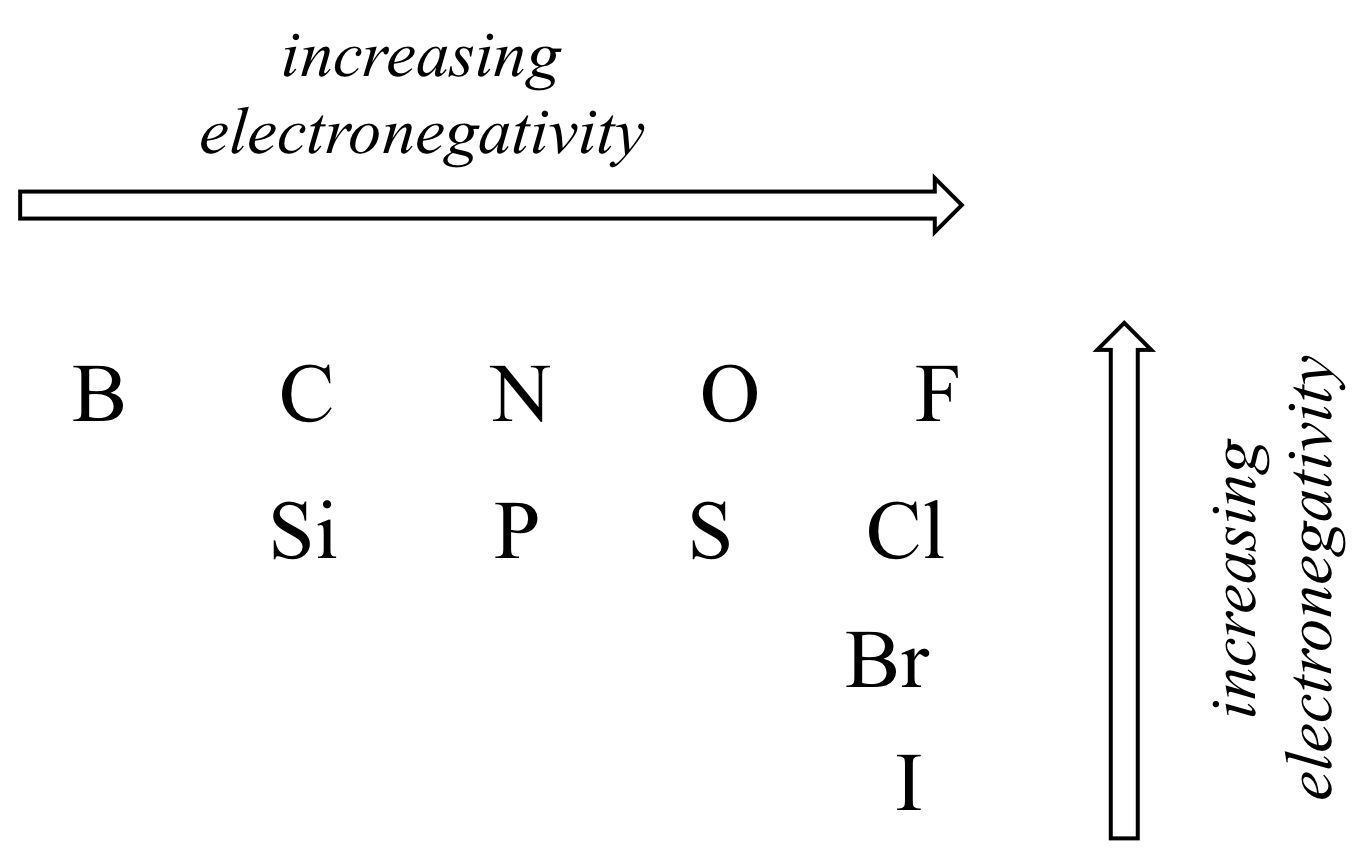
Usando lo que tú sobre los orbitales atómicos, racionaliza las tendencias periódicas en la electronegatividad. ¿Por qué aumenta de izquierda a derecha y disminuye de arriba a abajo? Esta es una buena pregunta para platicar con compañeros de clase y un instructor o tutor.
Soluciones a ejercicios
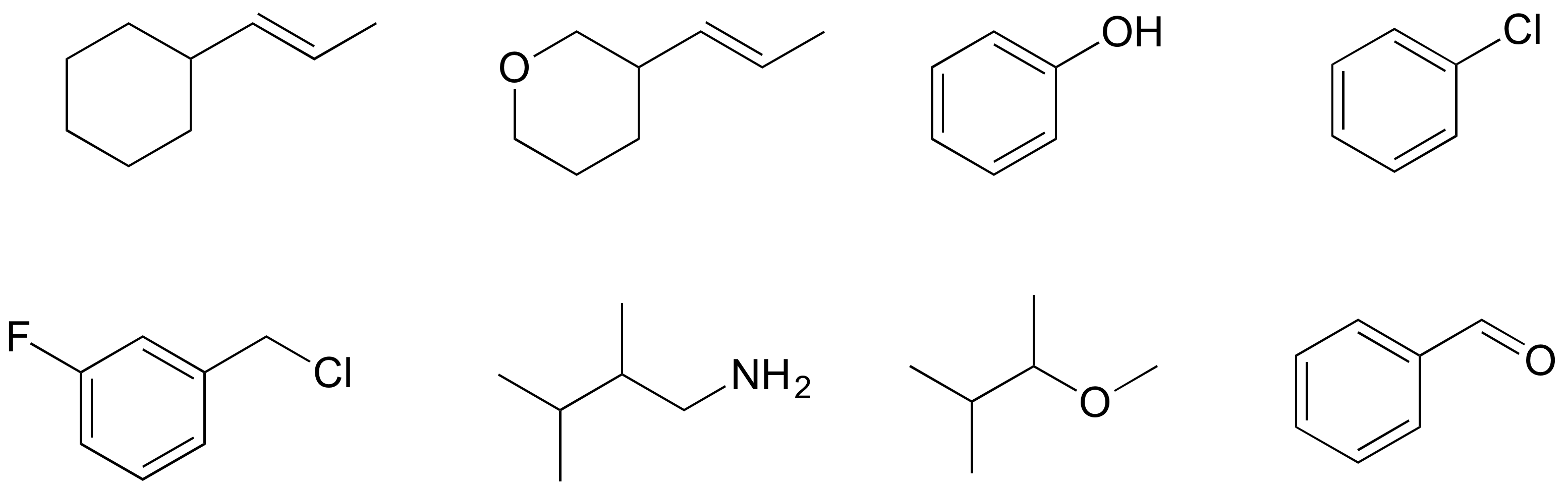
La mayoría de las moléculas contienen enlaces covalentes polares y no polares. Dependiendo de la ubicación de los enlaces polares y la geometría de unión, las moléculas pueden poseer una polaridad neta, llamada momento dipolo molecular. El agua, como probablemente recordarás, tiene un momento dipolar que resulta de los dipolos combinados de sus dos enlaces oxígeno-hidrógeno. El fluorometano también tiene un momento dipolar.
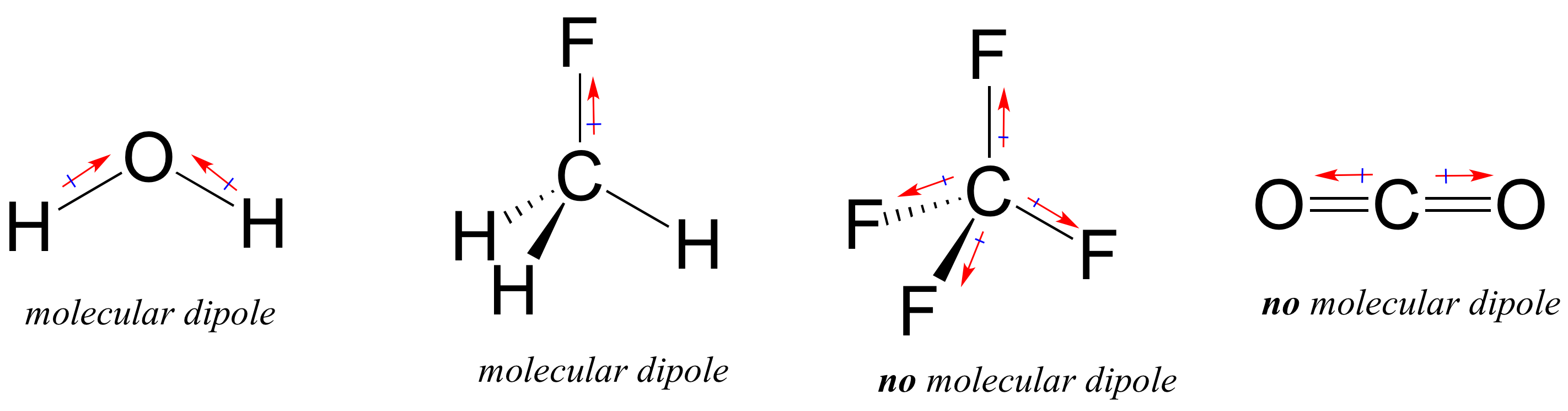
El tetrafluorometano, sin embargo, tiene cuatro enlaces polares que atraen por igual a las cuatro esquinas de un tetaedro, lo que significa que aunque hay cuatro dipolos de enlace, no hay un momento dipolar molecular general. El dióxido de carbono también carece de un momento dipolar molecular.
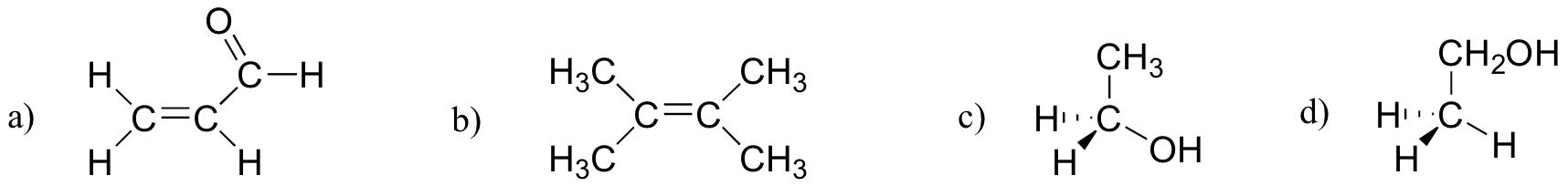
¿Cuál de las moléculas de abajo tiene momentos dipolares moleculares?
Soluciones a ejercicios
Interacciones ión-ion, dipolo-dipolo e ión-dipolo
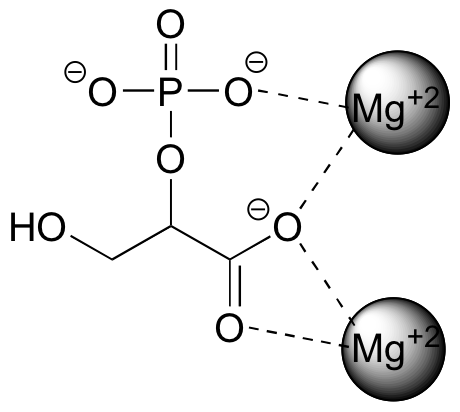
El tipo más fuerte de interacción no covalente es entre dos grupos iónicos de carga opuesta (una interacción ión-ion o carga-carga). Probablemente viste muchos ejemplos de enlaces iónicos en compuestos inorgánicos en tu curso de química general: por ejemplo, la sal de mesa está compuesta por cationes de sodio y aniones cloruro, mantenidos en una red cristalina por interacciones ión-ion. Uno de los ejemplos más comunes en química orgánica biológica es la interacción entre un catión magnesio (Mg +2) y un grupo carboxilato o fosfato aniónico. La siguiente figura muestra el 2-fosfoglicerato, un intermedio en la vía de la glucólisis, interactuando con dos iones Mg +2 en el sitio activo de una enzima glucolítica llamada enolasa.
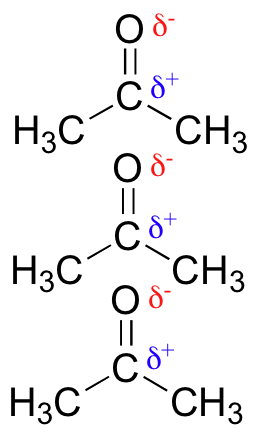
Las moléculas polares —aquellas con un momento dipolar general, como la acetona— pueden alinearse de tal manera que permitan que sus respectivos polos positivo y negativo interactúen entre sí. Esto se llama interacción dipolo-dipolo.
Cuando una especie cargada (un ion) interactúa favorablemente con una molécula polar o grupo funcional, el resultado se denomina interacción ión-dipolo. Un ejemplo común de interacción ión-dipolo en la química orgánica biológica es la que se encuentra entre un catión metálico, la mayoría de las veces Mg +2 o Zn +2, y el oxígeno parcialmente negativo de un carbonilo.
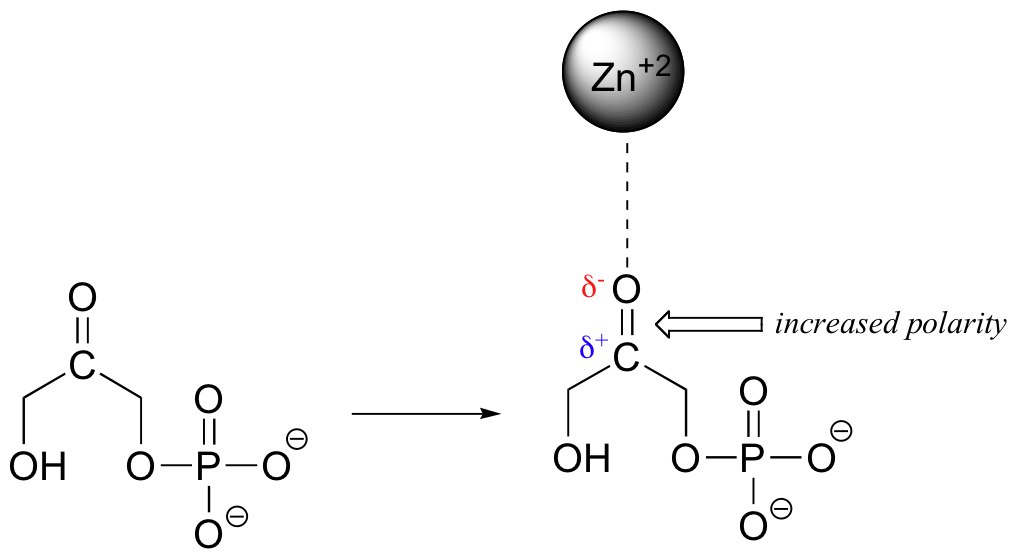
Debido a que el catión metálico es muy electronegativo, esta interacción tiene el efecto de tirar de la densidad electrónica en el doble enlace carbonilo aún más hacia el lado del oxígeno, aumentando la carga positiva parcial sobre el carbono. Como lo haremos posteriormente, esto tiene importantes implicaciones en términos de la reactividad de los grupos carbonilo en las reacciones bioquímicas.
Fuerzas de Van der Waals
Las moléculas no polares como los hidrocarburos también están sujetas a fuerzas no covalentes relativamente débiles pero aún significativas atractivas. Las fuerzas de Van der Waals (también llamadas fuerzas de dispersión de Londres o interacciones no polares) resultan de la densidad electrónica en constante cambio en cualquier molécula. Incluso una molécula no polar tendrá, en cualquier momento dado, un dipolo débil y de corta duración. Este dipolo transitorio inducirá a una molécula no polar vecina a desarrollar su propio dipolo transitorio correspondiente, con el resultado final de que se forma una interacción transitoria dipolo-dipolo. Estas fuerzas de van der Waals son relativamente débiles, pero se forman y disipan constantemente entre moléculas no polares estrechamente empaquetadas, y cuando se suman el efecto acumulativo puede llegar a ser significativo.
Enlaces de hidrógeno
Los enlaces de hidrógeno son el resultado de la interacción entre un hidrógeno unido a un heteroátomo electronegativo, específicamente un nitrógeno, oxígeno o flúor, y electrones de pares solidos en un nitrógeno, oxígeno o flúor, una molécula vecina o grupo funcional. Debido a que un átomo de hidrógeno es solo un solo protón y un solo electrón, cuando pierde densidad electrónica en un enlace polar se convierte esencialmente en una aproximación de un protón 'desnudo', capaz de formar una fuerte interacción con un par solitario en un átomo electronegativo vecino.
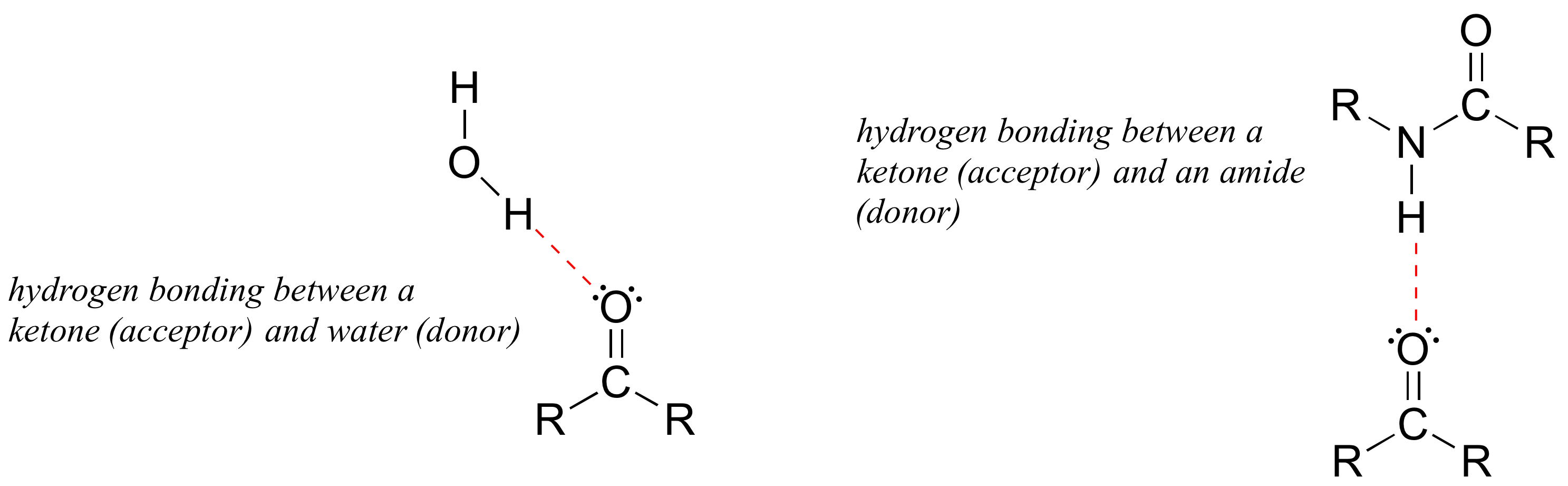
Los enlaces de hidrógeno generalmente se representan con líneas punteadas en estructuras químicas. Se dice que un grupo que proporciona un protón a un enlace de hidrógeno actúa como donador de enlaces de hidrógeno. Se dice que un grupo que proporciona un par solitario de oxígeno o nitrógeno actúa como aceptor de enlaces de hidrógeno. Muchos grupos funcionales orgánicos comunes pueden participar en la formación de enlaces de hidrógeno, ya sea como donantes, aceptores o ambos. El agua y los alcoholes, por ejemplo, pueden ser tanto donantes como aceptores de enlaces de hidrógeno. Un carbonilo, al carecer de hidrógeno unido a un oxígeno o nitrógeno, solo puede actuar como aceptor de enlaces de hidrógeno.
Clasifique las siguientes estructuras como:
- capaz de ser tanto un donador como un aceptor de enlaces de hidrógeno
- capaz de ser un aceptor de enlaces de hidrógeno, pero no un donante
- no capaces de participar en enlaces de hidrógeno.
Ejercicio 2.29
Dibuja figuras que muestren los enlaces de hidrógeno que se describen a continuación.
- Un enlace de hidrógeno entre metanol (donador) y agua (aceptor).
- Un enlace de hidrógeno entre metanol (aceptor) y agua (donante).
- Dos posibles enlaces de hidrógeno entre acetato de metilo y metilamina.
Soluciones a ejercicios
En general, los enlaces de hidrógeno son más fuertes que las interacciones dipolo-dipolo, pero también mucho más débiles que los enlaces covalentes. La fuerza de los enlaces de hidrógeno tiene enormes implicaciones en biología. La copia del ADN en la célula, por ejemplo, se basa en arreglos de enlaces de hidrógeno muy específicos entre bases de ADN en cadenas complementarias: la adenina se empareja con timina, mientras que la guanina se empareja con citosina:

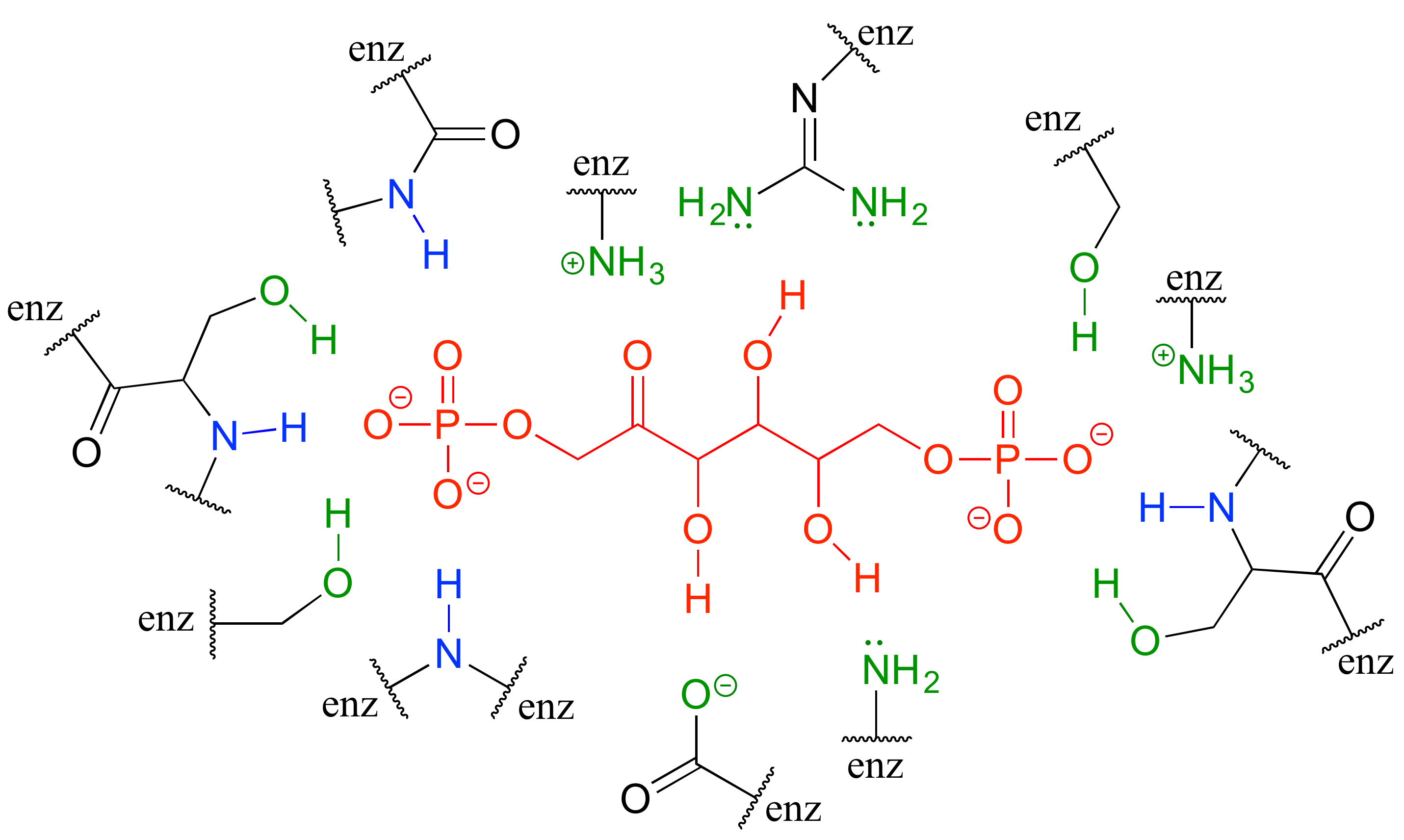
Los enlaces de hidrógeno, así como los otros tipos de interacciones no covalentes, son muy importantes en términos de la unión de un ligando a una proteína. En la sección 1.3, vimos una imagen 'llena de espacio' de una enzima con su sustrato unido en su sitio activo. Aquí, en una aproximación bidimensional, hay una imagen del mismo par sustrato-enzima que muestra cómo los grupos de cadena lateral de aminoácidos (verde) y cadena parental (azul) rodean e interactúan con grupos funcionales en el sustrato (rojo).
Video tutorial de Khan Academy sobre interacciones intermoleculares no covalentes


