12.5: Reacciones α-Carbono en el Laboratorio de Síntesis - Productos de Alquilación Cinética vs Termodinámica
- Page ID
- 72817
Si bien las reacciones de adición de aldol están muy extendidas en las vías bioquímicas como una forma de formar enlaces carbono-carbono, los químicos orgánicos sintéticos que trabajan en el laboratorio también hacen uso de reacciones similares al aldol para el mismo propósito. Considera esta reacción:
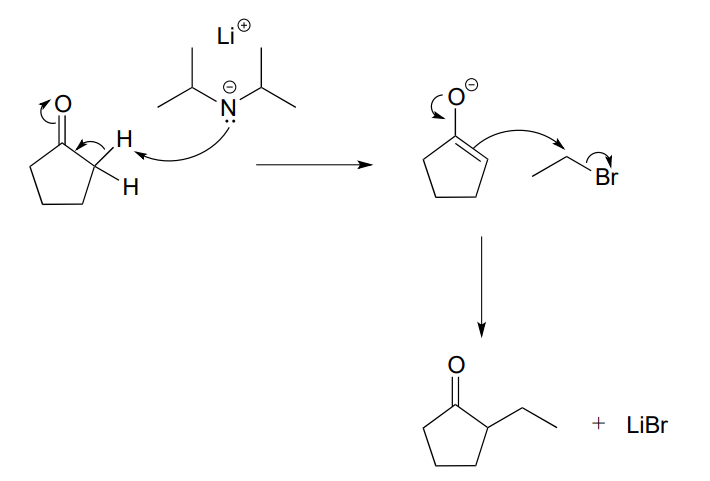
Aquí, la ciclopentanona es desprotonada en un\(\alpha\) carbono por diisopropilamida de litio (LDA), una base muy fuerte comúnmente utilizada en el laboratorio de síntesis. La adición a la mezcla de reacción de un electrófilo en forma de bromuro de alquilo primario da como resultado la formación de un nuevo enlace carbono-carbono. Observe que esta es una especie de '\(S_N2\)variación' en las reacciones de adición de aldol que vimos anteriormente, porque el nucleófilo enolado está atacando de\(S_N2\) manera más que en una manera de adición de carbonilo.
Sin embargo, ¿qué pasaría si empezáramos con 2-etilciclopentantona? Debido a que la cetona inicial ya no es simétrica, hipotéticamente podríamos obtener dos productos diferentes:
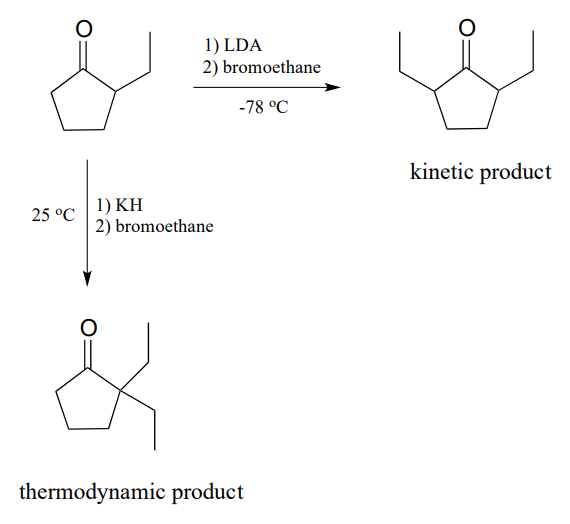
Resulta que podemos controlar qué producto obtenemos seleccionando la base utilizada en la reacción, y la temperatura de reacción. Si usamos LDA y sumergimos el matraz de reacción en un baño de hielo seco-acetona (\(-78^{\circ}C\)), we get mainly 2,5-diethyl cyclopentanone. If we use potassium hydride (\(KH\)) and run the reaction at room temperature, we get mainly 2,2-diethylcyclopentanone.
LDA is a very hindered base: the basic nitrogen atom is surrounded by two bulky isopropyl groups, and thus it is more difficult for it to come into contact with an \(\alpha\)-proton. The \(\alpha\)-protons on the less substituted side of 2-ethylcyclopentanone are less hindered and more accessible to the base. In addition, the cold reaction temperature means that the deprotonation step is irreversible: the system does not have enough energy to overcome the energy barrier for the reverse (reprotonation) reaction. The less substituted enolate forms faster, and once it forms it goes on to attack the bromoethane rather then reversing back to the ketone form. Because it is the rate of enolate formation that determines the major product under these conditions, we say that this reaction is under kinetic control, and the less substituted enolate intermediate is called the kinetic enolate.
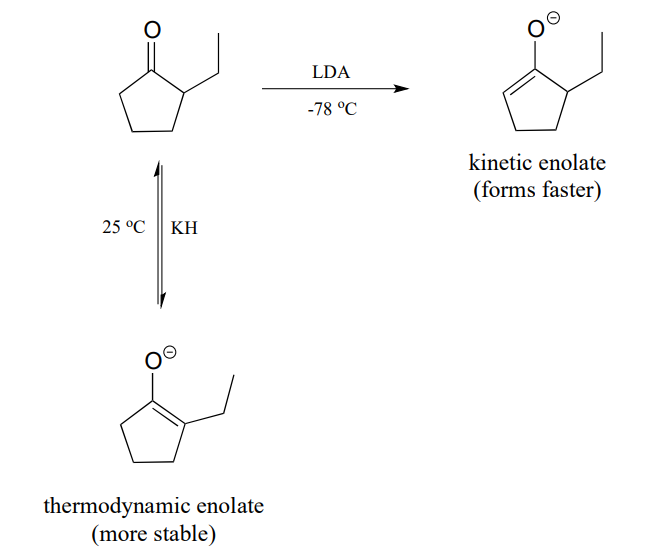
Si, por otro lado, usamos\(KH\) como base, el impedimento ya no es un problema porque la base es un ion hidruro. Realizamos esta reacción a temperatura ambiente, por lo que el sistema tiene suficiente energía para superar la barrera energética para la reprotonación, y la formación de enolados es reversible. El enolado en mayor abundancia en equilibrio, por lo tanto, no es el que se forma más rápido, sino el que es más estable. El enolato más sustituido es más estable (recordemos que los alquenos son más estables cuando están más sustituidos; aquí se aplica la misma idea). El enolato más sustituido conduce al producto de 2,2-dietil ciclopentanona. Debido a que es la estabilidad del intermedio enolato lo que determina el producto principal bajo estas condiciones, decimos que esta reacción está bajo control termodinámico, y el intermedio enolato más sustituido es el enolato termodinámico.


