12.4: Adición de Aldol
- Page ID
- 72791
Llegamos ahora a uno de los mecanismos más importantes en el metabolismo: la adición de aldol.
Junto con las reacciones de condensación de Claisen, que estudiaremos en el próximo capítulo, las adiciones de aldol son responsables de la mayoría de los eventos formadores de enlaces carbono-carbono que ocurren en una célula viva. Debido a que las biomoléculas se construyen sobre un marco de enlaces carbono-carbono, ¡es difícil exagerar la importancia de la adición de aldol y las reacciones de condensación de Claisen en la química de los seres vivos!
Descripción general de la reacción de adición de aldol
Considere las vías potenciales disponibles para un intermedio de enolato reactivo una vez que el protón a ha sido abstraído. Usaremos acetaldehído como ejemplo sencillo. El oxígeno, que lleva la mayor parte de la carga negativa, podría actuar como base, (paso 2 a continuación) y el resultado sería un enol.
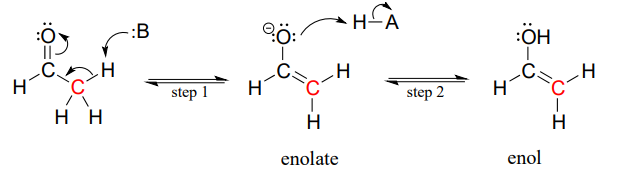
Alternativamente, el carbono enolado, que porta un grado de carga negativa, podría actuar como base, que es simplemente lo contrario de la etapa inicial de desprotonación que formó el enolado en primer lugar. Esto por supuesto solo nos lleva de vuelta al aldehído de partida.
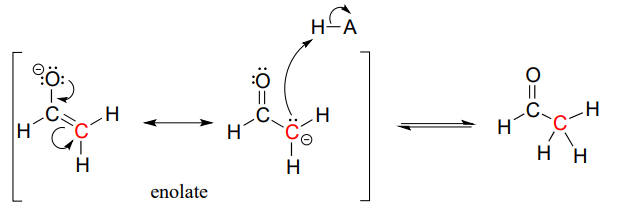
En ambos casos, la especie pobre en electrones atacada por el enolato es un protón ácido. ¿Y si la especie pobre en electrones -el electrófilo- no es un protón sino un carbono carbonilo? En otras palabras, ¿y si el enolato no actúa como base sino como nucleófilo en una reacción de adición de carbonilo? Por ejemplo, el enolato de acetaldehído podría atacar al grupo carbonilo de una segunda molécula de acetaldehído. El resultado es la formación de un nuevo enlace carbono-carbono:
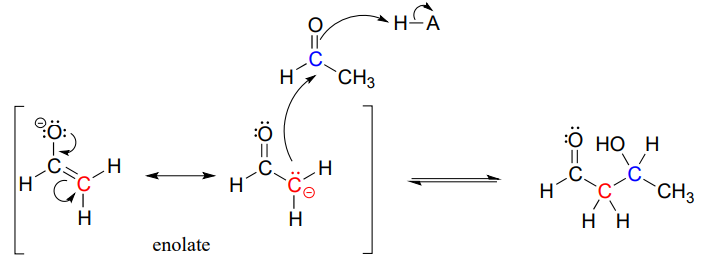
Este tipo de reacción se denomina adición aldólica. Puede ser muy útil pensar en una reacción de adición de aldol simplemente como una reacción de adición de carbonilo nucleófilo (Capítulo 10) con un enolato de a-carbono (en lugar de un alcohol, oxígeno o nitrógeno de amina) como nucleófilo.
Una reacción de adición aldólica:
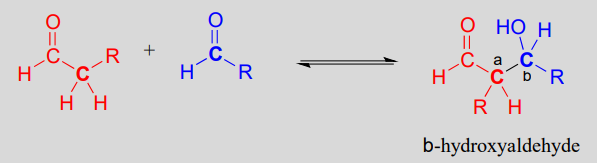
Mecanismo:
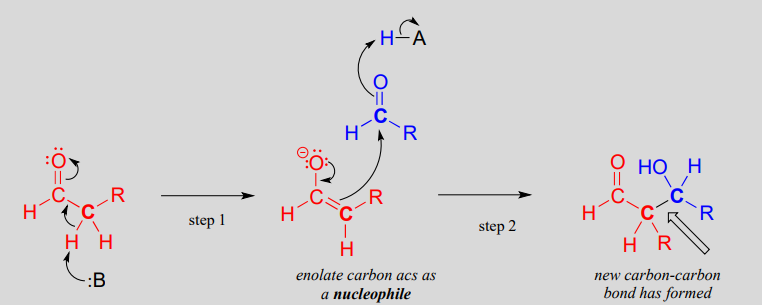
Históricamente, los primeros ejemplos de este tipo de mecanismo a estudiar involucraron reacciones muy similares a lo mostrado anteriormente: un aldehído que reacciona consigo mismo. Debido a que el producto resultante contenía tanto un grupo funcional aldehído como un grupo funcional alcohol, la reacción se denominó adición de 'aldol', terminología que se ha convertido en estándar para reacciones de este tipo, esté o no involucrado un aldehído. Más generalmente, una adición aldólica se caracteriza como una adición nucleofílica a un electrófilo de aldehído, cetona o imina donde el nucleófilo es el carbono a en un aldehído, cetona, imina, éster o tioéster. Las enzimas que catalizan las reacciones aldólicas se denominan, como era de esperar, aldolasas.
Obsérvese que la reacción aldólica da como resultado un producto en el que un grupo hidróxido está a dos carbonos del carbonilo, en la\(\beta\) posición. Se puede pensar en el grupo\(\beta\) -hidroxi como una especie de 'firma' para un producto de adición de aldol.
Dependiendo de los reactivos de partida, las reacciones aldólicas no enzimáticas pueden tomar más de una ruta para formar diferentes productos. Por ejemplo, una reacción entre acetaldehído y 2-butanona podría dar como resultado tres productos de adición de aldol diferentes, dependiendo de cuál de los tres carbonos a (carbonos 2, 3 y 5 siguientes) se convierta en el nucleófilo atacante.
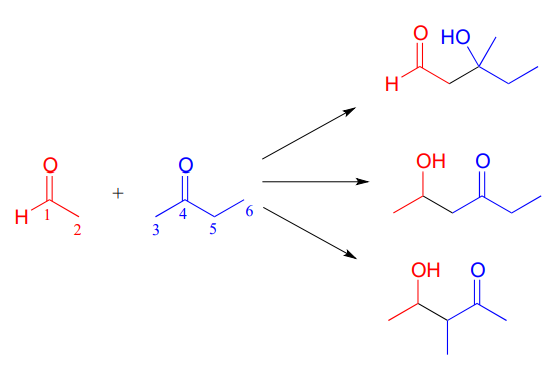
- Rellene los números de carbono apropiados para cada uno de los tres posibles productos de adición de aldol mostrados arriba.
- Dibuje flechas para la etapa de formación del enlace carbono-carbono que conduce a cada uno de los tres productos.
- Pista
-
F o cada reacción, ¡primero identifique los átomos de carbono nucleofílicos y electrofílicos en los compuestos de partida!
Reacciones bioquímicas de adición de aldol
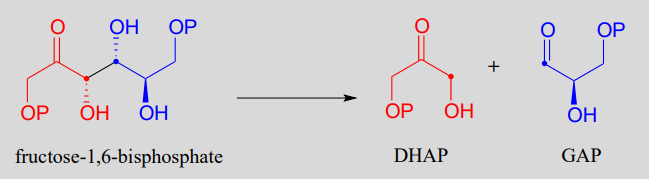
La fructosa 1,6-bisfosfato aldolasa (EC 4.1.2.13) es una enzima que participa tanto en las vías bioquímicas glicolíticas (catabolismo del azúcar) como en la gluconeogénesis (síntesis de azúcar). La reacción catalizada por fructosa 1,6-bisfosfato aldolasa une dos azúcares de 3 carbonos, gliceraldehído-3-fosfato (GAP, el electrófilo en la reacción) y dihidroxiacetona fosfato (DHAP, el nucleófilo), formando un producto de 6 carbonos. En las siguientes figuras, los carbonos nucleofílicos y electrófilos se identifican con puntos.
La reacción de fructosa 1,6-bisfosfato aldolasa
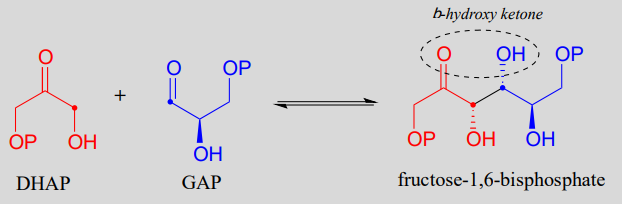
Mecanismo:
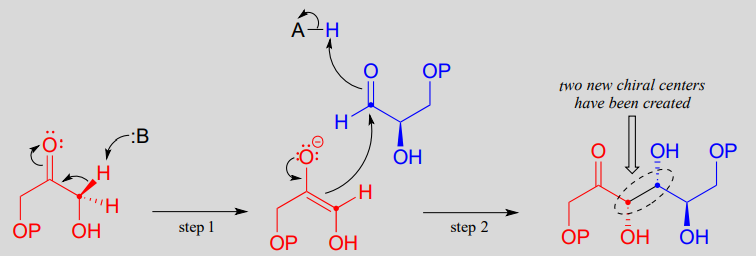
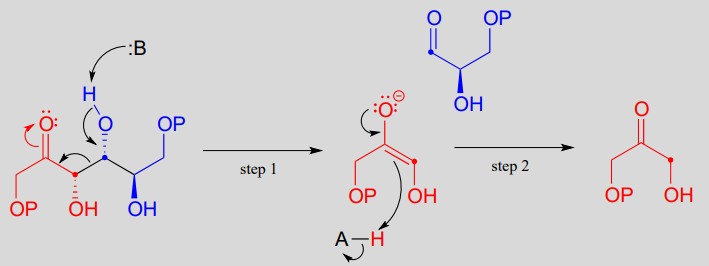
En la etapa 1 de la reacción, se desprotonó un carbono a sobre DHAP, lo que lleva a un intermediario enolado. esta y muchas otras reacciones de aldolasa, un catión de zinc (\(Zn^{+2}\)) se posiciona en el sitio activo de la enzima para interactuar estrechamente con - y estabilizar - el oxígeno cargado negativamente del enolato intermedio. Esta es una forma importante en la que la enzima baja la barrera energética a la reacción.
A continuación, (etapa 2), el carbono a desprotonado ataca el carbono carbonilo de GAP en una reacción de adición nucleofílica, conduciendo al producto de fructosa 1,6-bisfosfato.
Observe que en esta reacción se crean dos nuevos centros quirales. Esta reacción, al ser catalizada por enzimas, es altamente estereoselectiva debido a la posición precisa de los dos sustratos en el sitio activo: solo se observa uno de los cuatro posibles productos estereoisoméricos. La enzima también exhibe un estricto control de regioquímica: GAP y DHAP podrían formar otros dos productos aldólicos que son isómeros constitucionales de fructosa 1,6-bisfosfato.
- Rellene los espacios en blanco con el término correcto: (Pro-R, Pro-S, re, si). Es posible que desee revisar la terminología en la sección 3.11.
En la reacción de fructosa 1,6-bisfosfato aldolasa, se abstrae el protón ______ en el carbono a de DHAP, luego la cara ______ del enolato a-carbono resultante ataca la cara ______ del carbono aldehído de GAP.
- Dibujar estructuras de los otros dos isómeros constitucionales que hipotéticamente podrían formarse en reacciones de adición aldólica entre GAP y DHAP. ¿Cuántos estereoisómeros existen para estos dos productos alternativos?
Junto con aldehídos y cetonas, los ésteres y tioésteres también pueden actuar como socios nucleofílicos en las reacciones aldólicas. En el primer paso del ciclo del ácido cítrico (Krebs), acetilo\(CoA\) (un nucleófilo tioéster) se agrega al oxaloacetato (un electrófilo de cetona) (EC 2.3.3.8).
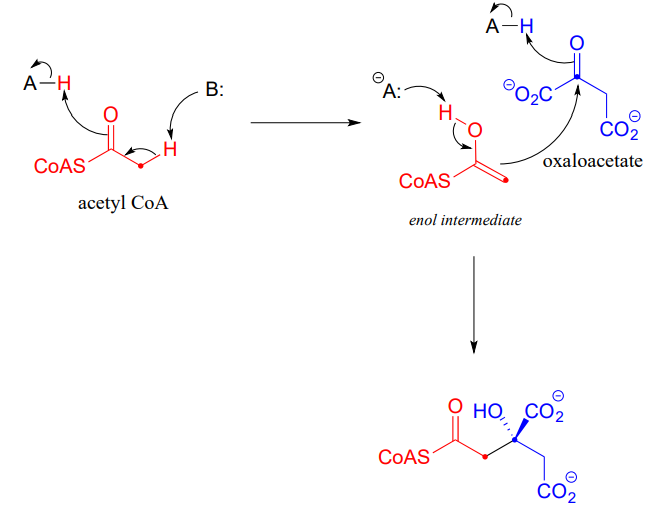
Observe que el intermedio nucleofílico es un enol, más que un enolato estabilizado con zinc como fue el caso de la reacción de fructosa 1,6-bisfosfato aldolasa. A menudo se observa un intermedio enol cuando el sustrato nucleofílico es un tioéster en lugar de una cetona o aldehído.
Hacia atrás: la reacción de escisión retro-aldólica
Si bien las reacciones aldólicas juegan un papel muy importante en la formación de nuevos enlaces carbono-carbono en las vías metabólicas, es importante enfatizar que también pueden ser reversibles: en la mayoría de los casos, el nivel de energía de los compuestos y productos de partida está muy cerca. Esto significa que, dependiendo de las condiciones metabólicas, las aldolasas también pueden catalizar reacciones retro-aldólicas: la inversa de las reacciones aldólicas, en las que se rompen los enlaces carbono-carbono.
Una reacción de escisión retro-aldólica:
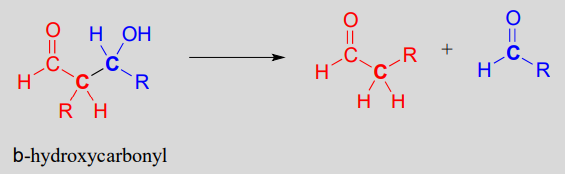
Mecanismo:
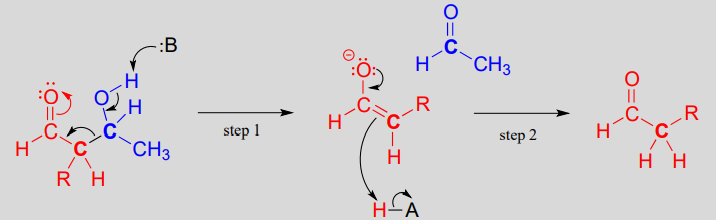
En la reacción de escisión retro-aldólica el grupo\(\beta\) -hidroxi es desprotonado (paso 1 anterior), para formar un carbonilo, al mismo tiempo expulsando el carbono enolato, que ahora es un grupo lábil en lugar de un nucleófilo.
¿Es un enolato un grupo de salida lo suficientemente bueno para que este paso sea químicamente razonable? Claro que es: los mismos factores estabilizadores que explican por qué se puede formar como un intermedio en la dirección hacia adelante (deslocalización por resonancia de la carga negativa al oxígeno, interacción con un catión zinc) también explican por qué es una base relativamente débil, y por lo tanto un grupo de salida relativamente bueno (recuerde, base débil = ¡buen grupo de salida!). Todo lo que tenemos que hacer para terminar la reacción es reprotonar el enolato (paso 2) para producir el aldehído de partida, y estamos de vuelta donde empezamos.
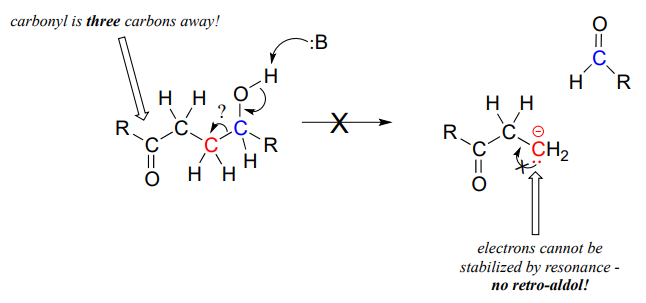
Lo clave a tener en cuenta al mirar un mecanismo retro-aldólico es que, cuando se rompe el enlace carbono-carbono, los electrones deben tener 'algún lugar adonde ir' donde serán estabilizados por resonancia. Muy a menudo, el sustrato para una reacción retro-aldólica es un\(\beta\) -hidroxialdehído, cetona, éster o tioéster.
Si los electrones que salen no pueden estabilizarse, es muy poco probable que se produzca una etapa de escisión retro-aldólica.
La reacción de fructosa 1,6-bisfosfato aldolasa que vimos en la sección anterior es un excelente ejemplo de una enzima cuyo papel metabólico es catalizar tanto la dirección directa como la inversa (retro) de una reacción aldólica. La misma enzima participa tanto como aldolasa en la vía de la gluconeogénesis generadora de azúcar, como como retro-aldolasa en la vía de glucólisis que rompe el azúcar. Ya lo hemos visto en acción como una aldolasa en la vía de la gluconeogénesis. Aquí está en la dirección glicolítica, catalizando la escisión retro-aldólica del bisfosfato de fructosa en DHAP y GAP:
La reacción de fructosa 1,6-bisfosfato aldolasa (dirección retro-aldol)
Mecanismo:
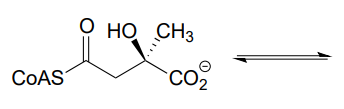
Predecir los productos de una reacción retro-aldólica con el sustrato dado.
Reacciones de adición de aldol con intermedios de enamina ligados a enzimas
Anteriormente analizamos el mecanismo para la reacción de fructosa 1,6-bisfosfato aldolasa en bacterias. Curiosamente, parece que la enzima que cataliza exactamente la misma reacción en plantas y animales evolucionó de manera diferente: en lugar de pasar por un intermedio enolato estabilizado con zinc, en plantas y animales el intermedio clave es una enamina. El sustrato nucleofílico se une primero a la enzima a través de la formación de un iminio con un residuo de lisina en el sitio activo de la enzima (consulte la sección 10.5 para conocer el mecanismo de formación de iminio). Esto forma efectivamente un “sumidero de electrones”, en el que el nitrógeno de iminio cargado positivamente juega el mismo papel que el\(Zn^{+2}\) ion en la enzima bacteriana.
Mecanismo para una reacción de adición aldólica con un intermedio de enamina ligada a enzimas
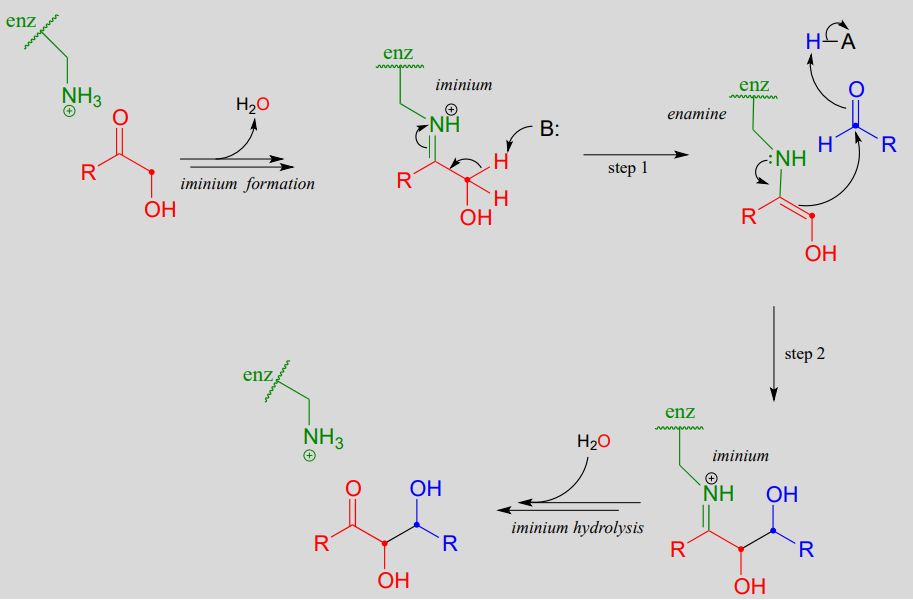
El\(\alpha\) -protón, hecho más ácido por el efecto de extracción de electrones del nitrógeno del iminio, es luego abstraído por una base de sitio activo para formar una enamina (paso 1). En la etapa 2, el\(\alpha\) carbono ataca al carbono carbonilo de un aldehído, y se forma el nuevo enlace carbono-carbono. Para liberar el producto del sitio activo de la enzima y liberar la enzima para catalizar otra reacción, el iminio se hidroliza de nuevo a un grupo cetona (ver sección 10.5 para revisar el mecanismo de hidrólisis imina/iminio).
Hay muchos más ejemplos de reacciones aldol/retroaldol en las que el intermedio clave es una imina ligada a lisina. Muchas bacterias son capaces de incorporar formaldehído, un compuesto tóxico, en el metabolismo de los carbohidratos al vincularlo al monofosfato de ribulosa. La reacción (EC 4.1.2.43) procede a través de intermedios imina y enamina.
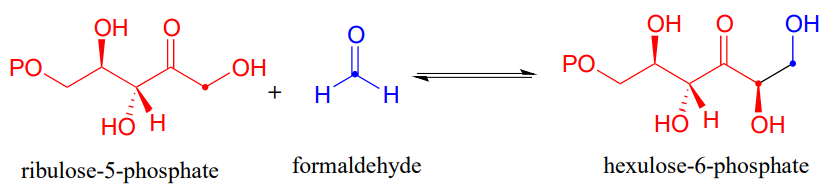
Dibujar la etapa de formación del enlace carbono-carbono para la reacción de hexulosa-6-fosfato aldolasa mostrada anteriormente.
Aquí hay un ejemplo de una reacción retro-aldólica intermedia de enamina a partir del metabolismo bacteriano de carbohidratos (EC 4.1.2.14). Observe que las estructuras se dibujan aquí en la notación de proyección Fischer; es importante practicar el trabajo con esta convención de dibujo, ya que los biólogos y bioquímicos la utilizan ampliamente para ilustrar la química de carbohidratos. Proc. Natl. Acad. Sci. 2001, 98, 3679
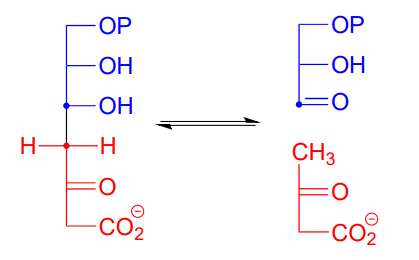
Dibuje la etapa de ruptura del enlace carbono-carbono en la reacción anterior. Utilice la notación de proyección Fischer.


