12.E: Reacciones en el α-Carbono, Parte I (Ejercicios)
- Page ID
- 72792
P12.1: La enzima ribulosa-5-fosfato isomerasa (EC 5.3.1.6), que es activa tanto en el ciclo de Calvin como en la vía de pentosa fosfato, cataliza una isomerización de aldehído a cetona entre dos azúcares de cinco carbonos.
- Dibuja un mecanismo para este paso.
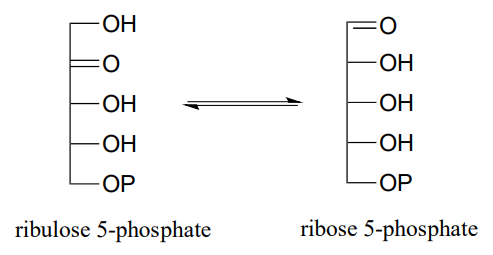
- ¿Qué\(^1H-NMR\) señal diferenciaría más claramente la aldosa de la cetosa en esta reacción?
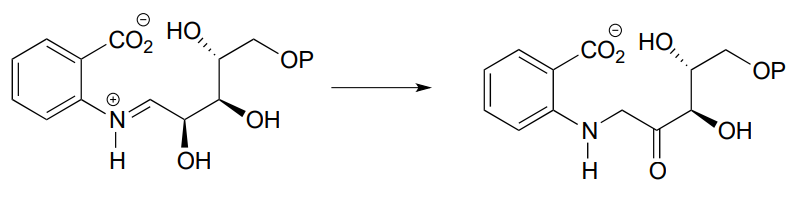
P12.2: Proporcionar un mecanismo probable para la reacción a continuación, a partir de la biosíntesis de triptófano (EC 5.3.1.24) Sugerencia: esto es mecanísticamente muy similar a una reacción de isomerización de carbonilo.
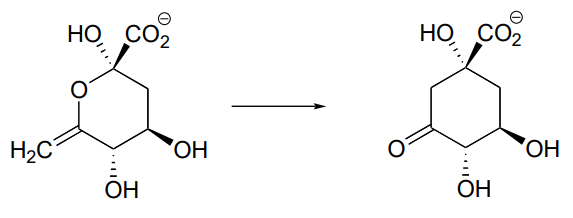
P12.3:
- Extracción del producto de una reacción de adición aldólica entre piruvato y glioxilato (EC 4.1.3.16):
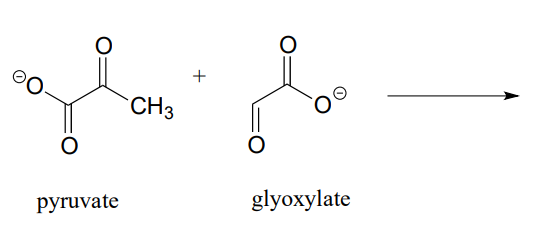
- Dibujar el producto de una reacción de adición aldólica entre dos moléculas de piruvato (EC 4.1.3.17).
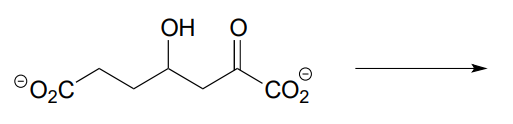
- La molécula de abajo experimenta una reacción de escisión retroaldólica en E. coli (J. Biol. Chem. 2012, 287, 36208). Dibujar la estructura de los productos.
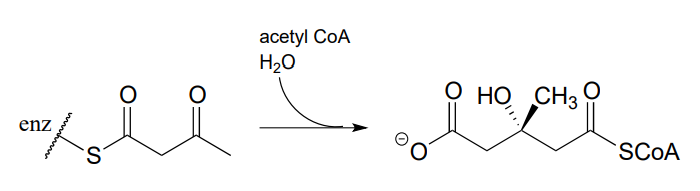
- Proponer un mecanismo para esta reacción temprana en la biosíntesis de isoprenoides (EC 2.3.3.10). Sugerencia: se trata de una reacción aldólica, seguida de hidrólisis de tioéster.
- Se reportó que la reacción de escisión de enlaces carbono-carbono a continuación tuvo lugar en muchas especies de bacterias. Predecir la estructura del producto X y dibujar un mecanismo para la reacción. Supongamos que una unión imina a un residuo enzimático de lisina no juega un papel en el mecanismo. (J. Bacteriol. 2009, 191, 4158).
P12.4: A continuación se muestra un paso en la biosíntesis de triptófano. Dibuja un mecanismo probable. Sugerencia: primero deberá mostrar un paso de tautomerización de enamina a imina, luego será posible el paso de ruptura del enlace carbono-carbono.
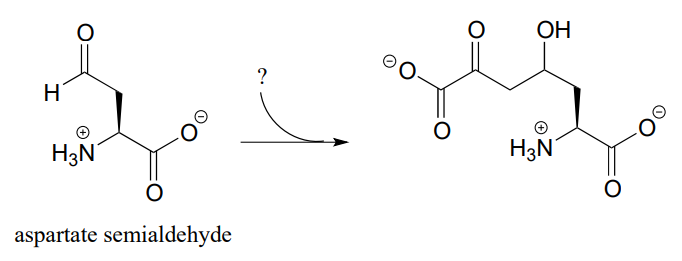
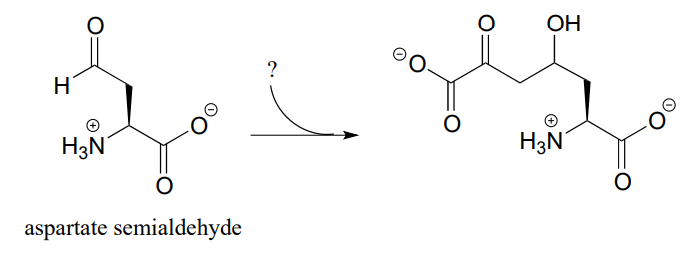
P12.5: El siguiente paso en la biosíntesis de lisina establece una conexión entre el aspartato semialdehído y un intermedio metabólico común. Identificar el intermedio y proponer un mecanismo para la reacción.
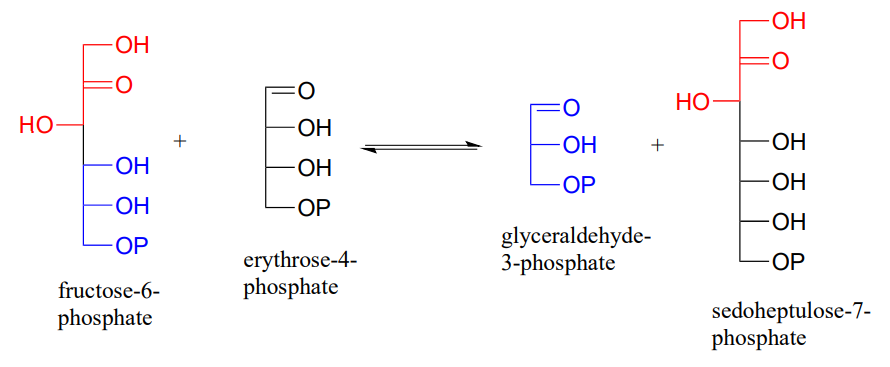
P12.6: Las reacciones transaldólicas interconvertidoras de azúcar juegan un papel importante en el metabolismo del azúcar. En una reacción de transaldolasa, una cetosa (por ejemplo, fructosa-6-fosfato) primero se rompe en una etapa retro-aldólica para liberar una aldosa (por ejemplo, gliceraldehído-3-fosfato) del sitio activo. Luego, en una etapa de aldol directo, una segunda aldosa (por ejemplo, eritrosa-4-fosfato) ingresa al sitio activo y se conecta con lo que queda de la cetosa original (la parte roja en la figura siguiente) para formar una nueva cetosa (por ejemplo, sedoheptulosa-7-fosfato). Las enzimas transaldolasas generalmente tienen una lisina en el sitio activo que se une covalentemente al sustrato a lo largo del ciclo de reacción.
Dibujar diagramas de flecha curva mostrando
- la etapa de ruptura del enlace carbono-carbono del ciclo de reacción
- El paso de formación de enlaces carbono-carbono.
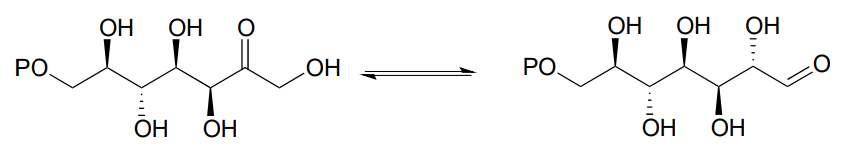
P12.7: Los científicos están investigando la reacción enzimática a continuación, que forma parte de la biosíntesis de la membrana externa de bacterias gramnegativas, como objetivo potencial para nuevos antibióticos. Dibujar un mecanismo probable para la reacción. (J. Biol. Chem. 2008, 283, 2835).
P12.8: La siguiente reacción, catalizada por la enzima malato sintasa, forma parte del ciclo de glioxilato de plantas y algunas bacterias. Es el ciclo del glioxilato el que permite a estos organismos convertir acetil CoA, derivado del metabolismo de los aceites, en glucosa.
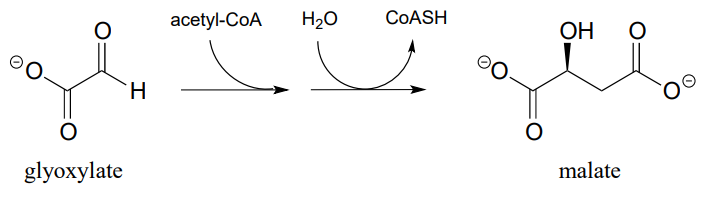
- Proponer un mecanismo.
- Predice las señales que esperarías ver en un\(^1H-NMR\) espectro de malato.
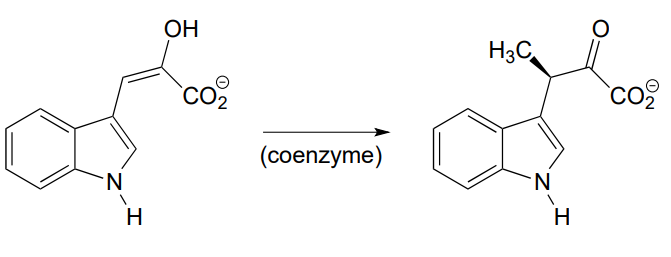
P12.9: La reacción a continuación, de la vía biosintética para el aminoácido triptófano, depende de una coenzima de la que aprendimos en un capítulo anterior. Con base en la reacción, identificar esta coenzima y proponer un mecanismo.
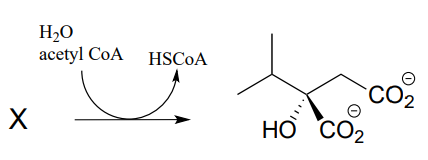
P12.10: En la biosíntesis de leucina, el acetilo\(CoA\) se condensa con otro intermedio metabólico 'X” para formar 1-isopropilmalato (EC 2.3.3.13). Dar la estructura para el sustrato X, y proporcionar un mecanismo para la reacción.
P12.11:
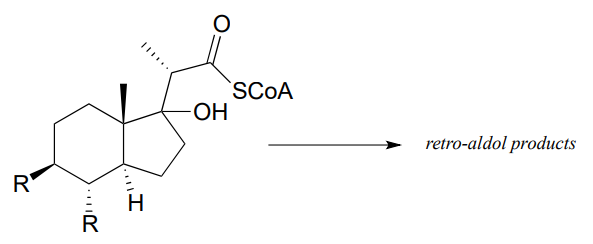
- Mycobacterium tuberculosis, el microbio causante de la tuberculosis, deriva energía del metabolismo del colesterol de pacientes infectados. Se predice que el siguiente compuesto sea un intermedio en esa vía metabólica y que se someta a una reacción de escisión retro-aldólica. Predecir los productos retro-aldólicos y mostrar el mecanismo involucrado. (Crit. Rev. Bioquímica. Mol. Biol. 2014, 49, 269, fig 5).
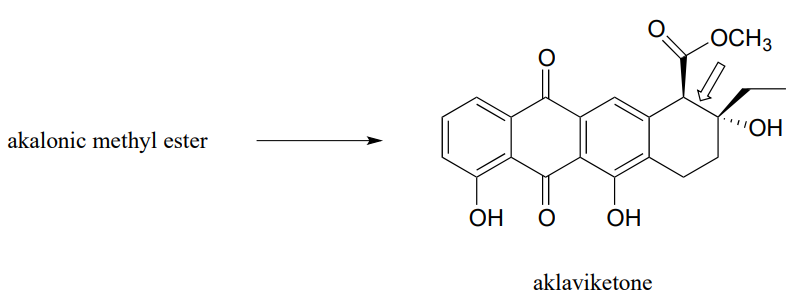
- Los policétidos son una clase estructuralmente diversa de biomoléculas producidas por casi todos los seres vivos. Muchos fármacos se derivan de precursores de policétida. El medicamento contra el cáncer doxorrubicina (nombre comercial Adriamycin) se deriva de un policétido bacteriano llamado rodomicinona. La aklavicetona, un intermedio en la biosíntesis de la rodomicinona, se deriva en una sola etapa enzimática a partir del éster metílico acalónico, en una reacción en la que se forma el enlace carbono-carbono indicado por una flecha. Predecir la estructura del éster metílico acalónico.
P12.12: La inusual reacción de isomerización que se muestra a continuación se ha reportado recientemente que ocurre en algunas bacterias. Proponer un mecanismo que comience con la formación de un intermedio enolado. (J. Biol. Chem. 2012, 287, 37986).
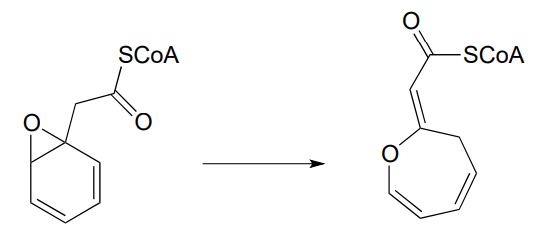
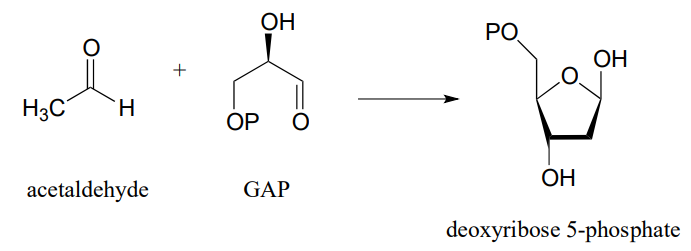
P12.13: Las reacciones en las partes a) y b) siguientes proceden a través de intermedios enamina ligados a lisina. Mostrar la etapa de formación del enlace carbono-carbono para cada reacción. Sugerencia: querrás considerar la forma de cadena recta (es decir, aldosis/cetosa) de los azúcares en ambos casos.
- (J. Bacteriol. 2004, 186, 4185)
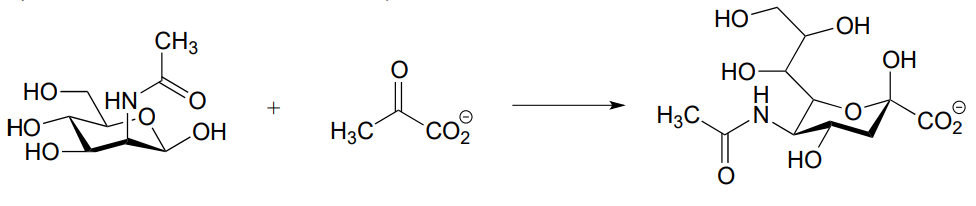
- (J. Biol. Chem. 2011, 286, 14057)
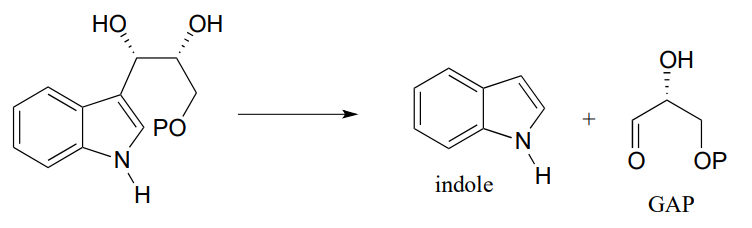
P12.14: Sugerir un mecanismo para la siguiente transformación a partir de la biosíntesis de aminoácidos aromáticos (EC 4.2.3.4). Pista: solo se requieren dos pasos mecanicistas.