13.2: Descarboxilación
- Page ID
- 72686
Muchos procesos de formación de enlaces carbono-carbono y ruptura de enlaces en química biológica implican la ganancia o pérdida, por una molécula orgánica, de un solo átomo de carbono en forma de\(CO_2\). Indudablemente has visto esta ecuación química antes en una clase introductoria de biología o química:
\[\ce{CO2 (g) + 6H2O (l) + energy \rightarrow C6H12O6 (aq) + 6O2 (g)}\]
Esto, por supuesto, representa el proceso fotosintético, mediante el cual las plantas (y algunas bacterias) aprovechan la energía del sol para construir glucosa a partir de moléculas individuales de dióxido de carbono. El paso químico clave en las plantas en las que se 'fija' una molécula de dióxido de carbono (unida a una molécula orgánica más grande) es una reacción de carboxilación, y es catalizada por la enzima ribulosa 1,5-bisfosfato carboxilasa, comúnmente conocida como Rubisco.
La ecuación química inversa también es probablemente familiar para usted:
\[\ce{C6H12O6(aq) + 6O2(g) \rightarrow 6CO2(g) + 6H2O(l) + energy}\]
Esta ecuación expresa lo que sucede en el proceso conocido como respiración: la descomposición oxidativa de la glucosa para formar dióxido de carbono, agua y energía (en un entorno no biológico, también es la ecuación para la combustión no catalizada de glucosa). En la respiración, cada uno de los átomos de carbono de la glucosa se convierte eventualmente en una\(CO_2\) molécula. El proceso por el cual un átomo de carbono -en forma de dióxido de carbono- se separa de una molécula orgánica más grande se llama descarboxilación.
Ahora veremos el mecanismo bioquímico de las reacciones de descarboxilación. Más adelante en el capítulo, veremos la reacción de carboxilación catalizada por la enzima Rubisco.
Las etapas de descarboxilación ocurren en muchos puntos a lo largo del metabolismo central. Muy a menudo, el sustrato para una etapa de descarboxilación es una\(\beta\) -carboxi cetona o aldehído.
Descarboxilación de una b -carboxi cetona o aldehído:

Mecanismo:

Al igual que en una reacción retro-aldólica, se rompe un enlace carbono-carbono, y los electrones del enlace roto deben estabilizarse para que se produzca el paso. Muy a menudo, los electrones son estabilizados por la formación de un enolato, como es el caso en el mecanismo general que se muestra arriba.
Los electrones del enlace de ruptura carbono-carbono también pueden estabilizarse mediante un grupo imina conjugada y/o por un carbonilo conjugado más extensamente.

La clave para entender las reacciones de descarboxilación es primero 'empujar' mentalmente a los electrones lejos del grupo carboxilato, luego preguntarse: ¿a dónde van estos electrones? Si los electrones no pueden 'aterrizar' en una posición donde se estabilizan, generalmente por resonancia con un oxígeno o nitrógeno, entonces una descarboxilación es muy poco probable.
No es probable que el siguiente compuesto sufra descarboxilación:
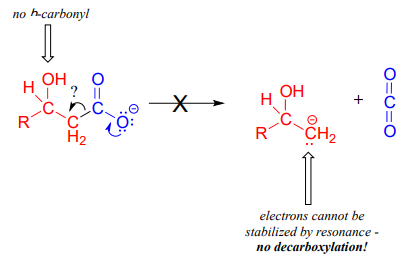
Tenga especial cuidado, al dibujar mecanismos de descarboxilación, para resistir la tentación de tratar el\(CO_2\) molecule as the leaving group in a mechanistic sense:
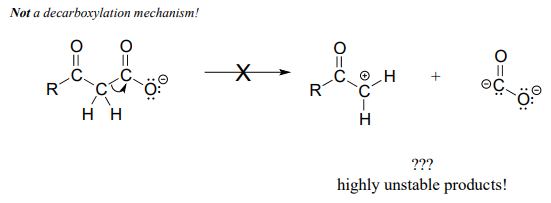
¡Lo anterior no es lo que parece una descarboxilación! (¡Se han deducido muchos puntos de un examen de química orgánica precisamente por este error!) Recuerde que en una etapa de descarboxilación, es el resto de la molécula el que es, de hecho, el grupo de salida, 'empujado por los electrones en el carboxilato.
Las reacciones de descarboxilación son generalmente termodinámicamente favorables debido al factor entrópico: una molécula se convierte en dos, una de las cuales es un gas - esto representa un aumento del trastorno (entropía). Las etapas de descarboxilación enzimática en las vías metabólicas también son generalmente irreversibles.
A continuación se presentan dos etapas de descarboxilación (EC 1.1.1.42; EC 1.1.43) en el metabolismo catabólico central (específicamente el ciclo del ácido cítrico y el catabolismo de la vía de pentosa fosfato, respectivamente). Cada paso representa un punto en el que un átomo de carbono derivado de los alimentos que comemos se libera como dióxido de carbono:

Dibuje flechas mecanicistas que muestren el paso de ruptura del enlace carbono-carbono en cada una de las reacciones mostradas anteriormente.
La reacción catalizada por acetoacetato descarboxilasa (EC 4.1.1.4) se basa en un enlace imminium (imina protonada) que se forma temporalmente entre el sustrato y un residuo de lisina en el sitio activo, en una estrategia similar a la de las reacciones enamina-aldolasa intermedia que vimos en el capítulo 12. (Recordemos de la sección 7.5 que\(pK_a\) of an imminium cation is approximately 7, so it is generally accurate to draw either the protonated imminium or the neutral imine in a biological organic mechanism).

Dibujar un mecanismo para la etapa de ruptura del enlace carbono-carbono en la reacción de acetoacetato descarboxilasa.
¿Cuál de los siguientes compuestos podría esperarse que se someta potencialmente a descarboxilación? Dibuja las flechas mecanicistas para el paso de descarboxilación de cada uno que elijas, mostrando cómo los electrones del enlace de ruptura carbono-carbono pueden estabilizarse por resonancia.



