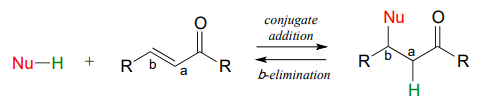
13.5: Adición y eliminación de conjugados
- Page ID
- 72725
En esta sección, veremos dos reacciones bioquímicas más comunes que proceden a través de intermedios enolatos. En una adición típica de conjugado, se 'añaden' un nucleófilo y un protón a los dos carbonos de un alqueno que se conjuga con un carbonilo (es decir, en la\(\alpha-\beta\) posición). una etapa de\(\beta\) eliminación, ocurre el proceso inverso:
En el capítulo 9 aprendimos acerca de las reacciones nucleofílicas de adición de carbonilo, incluyendo la formación de hemiacetales, hemicetales e iminas. En todas estas reacciones, un nucleófilo ataca directamente a un carbono carbonilo.

Sin embargo, si el carbonilo electrófilo es\(\beta\)-unsaturated - if, in other words, it contains a double bond conjugated to the carbonyl - a different reaction pathway is possible. A resonance structure can be drawn in which the \(\beta\)-carbon has a positive charge, meaning that the \(\beta\)-carbon also has the potential to be an electrophilic target.
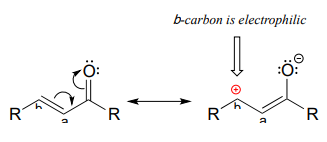
If a nucleophile attacks at the b-carbon, an enol or enolate intermediate results (step 1 below). In many cases this intermediate collapses and the a-carbon is protonated (step 2). This type of reaction is known as a conjugate addition.
Mechanism of a conjugate addition reaction
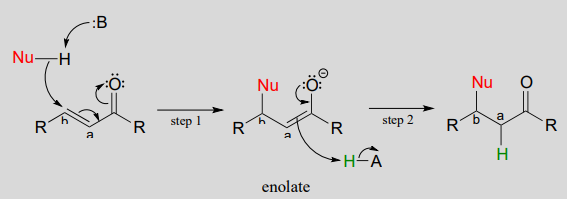
The reverse of a conjugate addition is a \(\beta\)-elimination, and is referred to mechanistically the abbreviation \(E1cb\).
Mechanism of an E1cB elimination

The \(E\) stands for 'elimination'; the numeral 1 refers to the fact that, like the \(S_N1\) mechanism, it is a stepwise reaction with first order kinetics. '\(cB\)' designation refers to the intermediate, which is the conjugate base of the starting compound. In step 1, an \(\alpha\)-carbon is deprotonated to produce an enolate, just like in aldol and Claisen reactions we have already seen. In step 2, the excess electron density on the enolate expels a leaving group at the \(\beta\) position (designated 'X' in the figure above). Notice that the \(\alpha\) and \(\beta\) carbons change from \(sp^3\) to \(sp^2\) hybridization with the formation of a conjugated double bond.
(In chapter 14 we will learn about alternate mechanisms for alkene addition and \(\beta\)-elimination reactions in which there is not an adjacent carbonyl (or imine) group, and in which the key intermediate species is a resonance-stabilized carbocation. )
Step II of fatty acid degradation is a conjugate addition of water, or hydration.

Obsérvese el resultado estereoquímico específico: en el sitio activo, el agua nucleofílica se une detrás del plano del sistema conjugado (como se dibuja en la figura anterior), y el resultado es la\(S\) configuración en el producto\(\beta\) -hidroxitioéster.
En la etapa III del ciclo de síntesis de ácidos grasos vimos una\(E1cb\)\(\beta\) -eliminación del agua (deshidratación):

Observe que la estereoquímica en el\(\beta \)-carbon of the starting alcohol is R, whereas the hydration pathway (step II) reaction in the fatty acid degradation cycle pathway results in the \(S\) stereoisomer. These two reactions are not the reverse of one another!
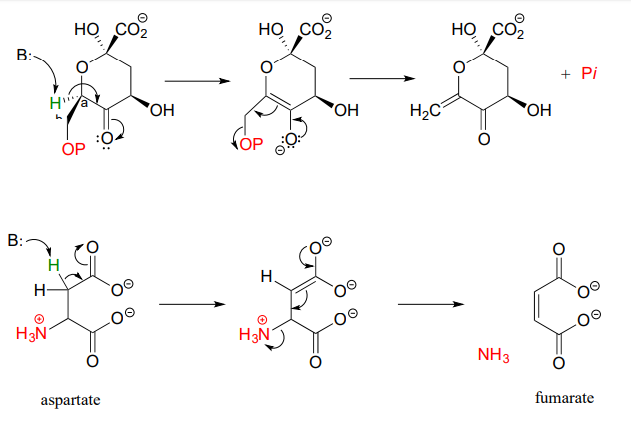
Here are two more examples of \(\beta \)-elimination reactions, with phosphate and ammonium respectively, as leaving groups. The first, 3-dehydroquinate synthase (EC 4.2.3.4) is part of the biosynthesis of aromatic amino acids, the second, aspartate ammonia lyase (EC 4.3.1.1) is part of amino acid catabolism.
En la vía de la glucólisis, la enzima 'enolasa' (EC 4.2.1.11) cataliza la\(E1cb\) deshidratación del 2-fosfoglicerato. Predecir el producto de este paso enzimático.

La N-etilmaleimida (NEM) es un inhibidor irreversible de muchas enzimas que contienen restos de cisteína del sitio activo. La inactivación se produce a través de la adición conjugada de cisteína a NEM: mostrar la estructura del residuo marcado. (Michael además)

La argininosuccinato liasa (4.3.2.1), una enzima en la vía metabólica que sirve para eliminar el nitrógeno de tu cuerpo en forma de urea en la orina, cataliza este paso\(\beta\) de eliminación:
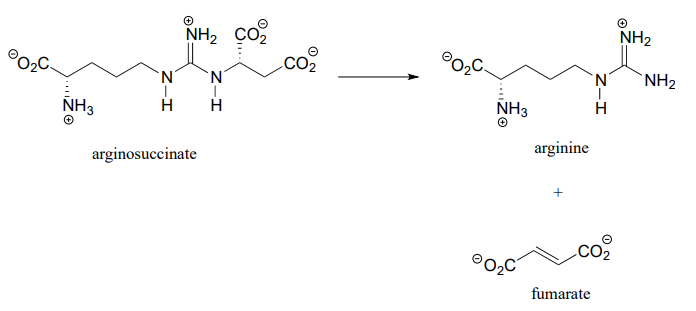
Proponer un mecanismo completo.
- Pista
-
No se deje intimidar por el tamaño o complejidad del sustrato - revisar el mecanismo\(\beta\) -elim ination, luego identificar el grupo saliente y romper el enlace, el\(\alpha\) -carbono que pierde un protón, el carbonilo que sirve para estabilizar negativamente- intermedio cargado (enolato), y el doble enlace que se forma como resultado de la eliminación. Es posible que desee designar un grupo 'R' apropiado para reducir la cantidad de dibujo.


