2.1: Átomos, Isótopos, Iones y Moléculas - Los Bloques de Construcción
- Page ID
- 59164
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Habilidades para Desarrollar
- Definir materia y elementos
- Describir la interrelación entre protones, neutrones y electrones
- Comparar las formas en que los electrones pueden ser donados o compartidos entre átomos
- Explicar las formas en que los elementos naturales se combinan para crear moléculas, células, tejidos, sistemas de órganos y organismos
En su nivel más fundamental, la vida está conformada por la materia. La materia es cualquier sustancia que ocupa espacio y tiene masa. Los elementos son formas únicas de materia con propiedades químicas y físicas específicas que no se pueden descomponer en sustancias más pequeñas mediante reacciones químicas ordinarias. Hay 118 elementos, pero sólo 92 ocurren de forma natural. Los elementos restantes se sintetizan en laboratorios y son inestables.
Cada elemento es designado por su símbolo químico, que es una sola letra mayúscula o, cuando la primera letra ya está “tomada” por otro elemento, una combinación de dos letras. Algunos elementos siguen el término inglés para el elemento, como C para carbono y Ca para calcio. Los símbolos químicos de otros elementos derivan de sus nombres latinos; por ejemplo, el símbolo para el sodio es Na, refiriéndose al sodio, la palabra latina para sodio.
Los cuatro elementos comunes a todos los organismos vivos son oxígeno (O), carbono (C), hidrógeno (H) y nitrógeno (N). En el mundo no vivo, los elementos se encuentran en diferentes proporciones, y algunos elementos comunes a los organismos vivos son relativamente raros en el conjunto de la tierra, como se muestra en la Tabla\(\PageIndex{1}\). Por ejemplo, la atmósfera es rica en nitrógeno y oxígeno pero contiene poco carbono e hidrógeno, mientras que la corteza terrestre, aunque contiene oxígeno y una pequeña cantidad de hidrógeno, tiene poco nitrógeno y carbono. A pesar de sus diferencias en abundancia, todos los elementos y las reacciones químicas entre ellos obedecen las mismas leyes químicas y físicas independientemente de que formen parte del mundo vivo o no vivo.
| Element | Vida (Humanos) | Atmósfera | Corteza terrestre |
|---|---|---|---|
| Oxígeno (O) | 65% | 21% | 46% |
| Carbono (C) | 18% | trazar | trazar |
| Hidrógeno (H) | 10% | trazar | 0.1% |
| Nitrógeno (N) | 3% | 78% | trazar |
La estructura del átomo
Para entender cómo se unen los elementos, primero debemos discutir el componente o bloque de construcción más pequeño de un elemento, el átomo. Un átomo es la unidad de materia más pequeña que conserva todas las propiedades químicas de un elemento. Por ejemplo, un átomo de oro tiene todas las propiedades del oro en que es un metal sólido a temperatura ambiente. Una moneda de oro es simplemente un número muy grande de átomos de oro moldeados en forma de moneda y que contienen pequeñas cantidades de otros elementos conocidos como impurezas. Los átomos de oro no se pueden descomponer en nada más pequeño sin dejar de conservar las propiedades del oro.
Un átomo está compuesto por dos regiones: el núcleo, que está en el centro del átomo y contiene protones y neutrones, y la región más externa del átomo que mantiene sus electrones en órbita alrededor del núcleo, como se ilustra en la Figura\(\PageIndex{1}\). Los átomos contienen protones, electrones y neutrones, entre otras partículas subatómicas. La única excepción es el hidrógeno (H), que está hecho de un protón y un electrón sin neutrones.
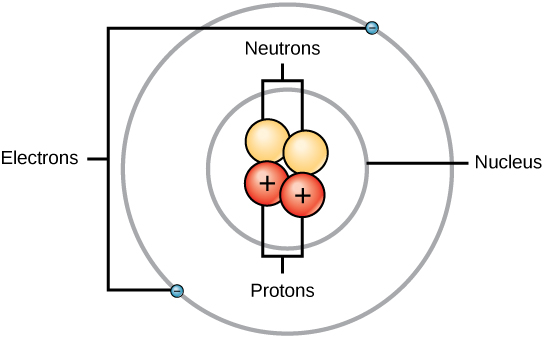
Los protones y neutrones tienen aproximadamente la misma masa, aproximadamente 1.67 × 10 -24 gramos. Los científicos definen arbitrariamente esta cantidad de masa como una unidad de masa atómica (amu) o un Dalton, como se muestra en la Tabla\(\PageIndex{2}\). Aunque similares en masa, los protones y neutrones difieren en su carga eléctrica. Un protón está cargado positivamente mientras que un neutrón está sin carga. Por lo tanto, el número de neutrones en un átomo contribuye significativamente a su masa, pero no a su carga. Los electrones son mucho más pequeños en masa que los protones, pesan solo 9.11 × 10-28 gramos, o aproximadamente 1/1800 de una unidad de masa atómica. De ahí que no contribuyan mucho a la masa atómica general de un elemento. Por lo tanto, al considerar la masa atómica, se acostumbra ignorar la masa de cualquier electrón y calcular la masa del átomo basándose únicamente en el número de protones y neutrones. Aunque no contribuyen significativamente a la masa, los electrones sí contribuyen en gran medida a la carga del átomo, ya que cada electrón tiene una carga negativa igual a la carga positiva de un protón. En los átomos neutros no cargados, el número de electrones que orbitan el núcleo es igual al número de protones dentro del núcleo. En estos átomos, las cargas positivas y negativas se cancelan entre sí, conduciendo a un átomo sin carga neta.
Contabilizando los tamaños de protones, neutrones y electrones, la mayor parte del volumen de un átomo, mayor del 99 por ciento, es, de hecho, espacio vacío. Con todo este espacio vacío, uno podría preguntarse por qué los llamados objetos sólidos no se limitan a atravesar unos a otros. La razón por la que no lo hacen es que los electrones que rodean a todos los átomos están cargados negativamente y las cargas negativas se repelen entre sí.
| Cargar | Masa (amu) | Ubicación | |
|---|---|---|---|
| Protón | +1 | 1 | núcleo |
| Neutrón | 0 | 1 | núcleo |
| Electron | —1 | 0 | orbitales |
Número atómico y masa
Los átomos de cada elemento contienen un número característico de protones y electrones. El número de protones determina el número atómico de un elemento y se utiliza para distinguir un elemento de otro. El número de neutrones es variable, dando como resultado isótopos, que son diferentes formas del mismo átomo que varían sólo en el número de neutrones que poseen. En conjunto, el número de protones y el número de neutrones determinan el número de masa de un elemento, como se ilustra en la Figura\(\PageIndex{2}\). Obsérvese que la pequeña contribución de masa de los electrones no se tiene en cuenta en el cálculo del número de masa. Esta aproximación de masa se puede utilizar para calcular fácilmente cuántos neutrones tiene un elemento simplemente restando el número de protones del número de masa. Dado que los isótopos de un elemento tendrán números de masa ligeramente diferentes, los científicos también determinan la masa atómica, que es la media calculada del número de masa para sus isótopos naturales. A menudo, el número resultante contiene una fracción. Por ejemplo, la masa atómica del cloro (Cl) es 35.45 porque el cloro está compuesto por varios isótopos, algunos (la mayoría) con masa atómica 35 (17 protones y 18 neutrones) y algunos con masa atómica 37 (17 protones y 20 neutrones).
Conexión de arte
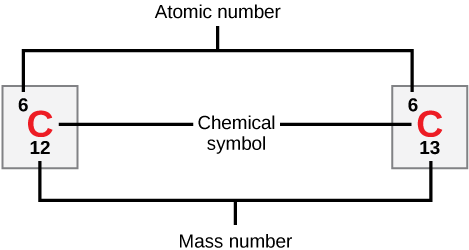
¿Cuántos neutrones tienen el carbono-12 y el carbono-13, respectivamente?
Isótopos
Los isótopos son formas diferentes de un elemento que tienen el mismo número de protones pero un número diferente de neutrones. Algunos elementos, como el carbono, el potasio y el uranio, tienen isótopos naturales. El carbono-12 contiene seis protones, seis neutrones y seis electrones; por lo tanto, tiene un número de masa de 12 (seis protones y seis neutrones). El carbono-14 contiene seis protones, ocho neutrones y seis electrones; su masa atómica es 14 (seis protones y ocho neutrones). Estas dos formas alternas de carbono son isótopos. Algunos isótopos pueden emitir neutrones, protones y electrones, y alcanzar una configuración atómica más estable (menor nivel de energía potencial); estos son isótopos radiactivos, o radioisótopos. La desintegración radiactiva (carbono-14 que pierde neutrones para finalmente convertirse en carbono-12) describe la pérdida de energía que ocurre cuando el núcleo de un átomo inestable libera radiación.
Conexión de evolución: Datación por carbono
El carbono normalmente está presente en la atmósfera en forma de compuestos gaseosos como el dióxido de carbono y el metano. El carbono-14 (\(\ce C^{14}\)) es un radioisótopo natural que se crea en la atmósfera a partir de la atmósfera\(\ce N^{14}\) (nitrógeno) por la adición de un neutrón y la pérdida de un protón a causa de los rayos cósmicos. Este es un proceso continuo, por lo que siempre\(\ce C^{14}\) se está creando más. Como organismo vivo incorpora\(\ce C^{14}\) inicialmente como dióxido de carbono fijado en el proceso de fotosíntesis, la cantidad relativa de\(\ce C^{14}\) en su cuerpo es igual a la concentración de\(\ce C^{14}\) en la atmósfera. Cuando un organismo muere, ya no está ingiriendo\(\ce C^{14}\), por lo que la relación entre\(\ce C^{14}\) y\(\ce C^{12}\) disminuirá a medida que\(\ce C^{14}\) decae gradualmente a\(\ce N^{14}\) por un proceso llamado decaimiento beta, la emisión de electrones o positrones. Esta decadencia desprende energía en un proceso lento.
Después de aproximadamente 5,730 años, la mitad de la concentración inicial de\(\ce C^{14}\) habrá vuelto a ser convertida\(\ce N^{14}\). El tiempo que tarda la mitad de la concentración original de un isótopo en decaer de nuevo a su forma más estable se llama su vida media. Debido a que la vida media de\(\ce C^{14}\) es larga, se utiliza para fechar objetos anteriormente vivos como huesos viejos o madera. Al comparar la relación de la\(\ce C^{14}\) concentración encontrada en un objeto con la cantidad de\(\ce C^{14}\) detectada en la atmósfera, se puede determinar la cantidad del isótopo que aún no se ha descompuesto. Sobre la base de esta cantidad, la edad del material, como el mamut pigmeo que se muestra en la Figura\(\PageIndex{3}\), se puede calcular con precisión si no es mucho mayor que alrededor de 50,000 años. Otros elementos tienen isótopos con diferentes vidas medias. Por ejemplo,\(\ce K^{40}\) (potasio-40) tiene una vida media de 1.25 mil millones de años, y\(\ce U^{235}\) (Uranio 235) tiene una vida media de aproximadamente 700 millones de años. Mediante el uso de la datación radiométrica, los científicos pueden estudiar la edad de los fósiles u otros restos de organismos extintos para comprender cómo han evolucionado los organismos a partir de especies anteriores.

Enlace al aprendizaje

Video: Para conocer más sobre átomos, isótopos y cómo distinguir un isótopo de otro, visite este sitio y ejecute la simulación.
La Tabla Periódica
Los diferentes elementos se organizan y muestran en la tabla periódica. Ideada por el químico ruso Dmitri Mendeleev (1834—1907) en 1869, la tabla agrupa elementos que, aunque únicos, comparten ciertas propiedades químicas con otros elementos. Las propiedades de los elementos son responsables de su estado físico a temperatura ambiente: pueden ser gases, sólidos o líquidos. Los elementos también tienen reactividad química específica, la capacidad de combinarse y unirse químicamente entre sí.
En la tabla periódica, mostrada en la Figura
Video: Mira esta animación visual para ver la disposición espacial de los orbitales p y s.
Reacciones químicas y moléculas
Todos los elementos son más estables cuando su caparazón más externo está lleno de electrones de acuerdo con la regla del octeto. Esto se debe a que es energéticamente favorable que los átomos estén en esa configuración y los hace estables. Sin embargo, dado que no todos los elementos tienen suficientes electrones para llenar sus capas más externas, los átomos forman enlaces químicos con otros átomos obteniendo así los electrones que necesitan para lograr una configuración electrónica estable. Cuando dos o más átomos se unen químicamente entre sí, la estructura química resultante es una molécula. La familiar molécula de agua, H 2 O, consiste en dos átomos de hidrógeno y un átomo de oxígeno; estos se unen para formar agua, como se ilustra en la Figura\(\PageIndex{8}\). Los átomos pueden formar moléculas donando, aceptando o compartiendo electrones para llenar sus capas externas.
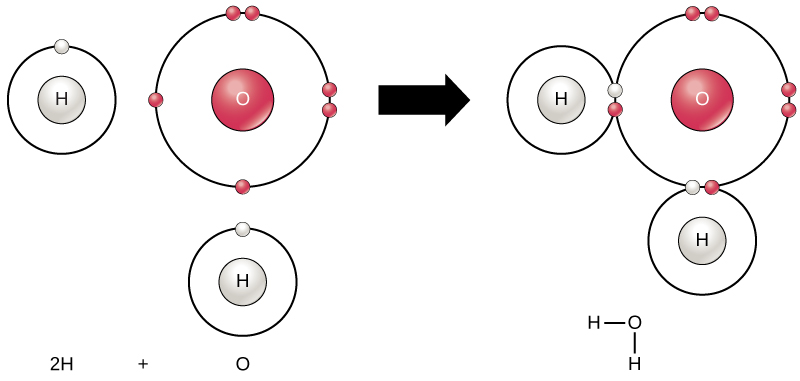
Las reacciones químicas ocurren cuando dos o más átomos se unen para formar moléculas o cuando los átomos unidos se rompen. Las sustancias utilizadas al inicio de una reacción química se denominan los reactivos (generalmente se encuentran en el lado izquierdo de una ecuación química), y las sustancias que se encuentran al final de la reacción se conocen como los productos (generalmente se encuentran en el lado derecho de una ecuación química). Normalmente se dibuja una flecha entre los reactivos y los productos para indicar la dirección de la reacción química; esta dirección no siempre es una “calle unidireccional”. Para la creación de la molécula de agua mostrada anteriormente, la ecuación química sería:
\[\ce{2H + O \rightarrow H_2O} \nonumber\]
Un ejemplo de una reacción química simple es la descomposición de las moléculas de peróxido de hidrógeno, cada una de las cuales consiste en dos átomos de hidrógeno unidos a dos átomos de oxígeno (H 2 O 2). El reactivo peróxido de hidrógeno se descompone en agua, que contiene un átomo de oxígeno unido a dos átomos de hidrógeno (H 2 O), y oxígeno, que consiste en dos átomos de oxígeno unidos (O 2). En la siguiente ecuación, la reacción incluye dos moléculas de peróxido de hidrógeno y dos moléculas de agua. Este es un ejemplo de una ecuación química equilibrada, en donde el número de átomos de cada elemento es el mismo en cada lado de la ecuación. De acuerdo con la ley de conservación de la materia, el número de átomos antes y después de una reacción química debe ser igual, de tal manera que ningún átomo sea, en circunstancias normales, creado o destruido.
\[\ce{2H_2O_2\: (hydrogen\: peroxide) \rightarrow 2H_2O\: (water) + O_2\: (oxygen)} \nonumber\]
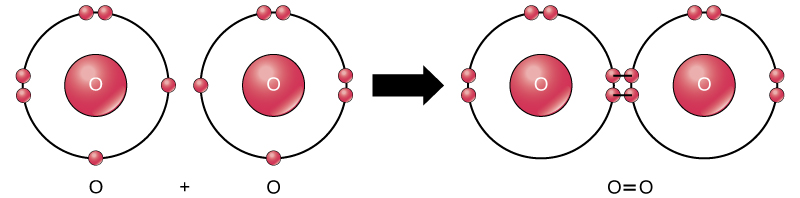
A pesar de que todos los reactivos y productos de esta reacción son moléculas (cada átomo permanece unido a al menos otro átomo), en esta reacción solo el peróxido de hidrógeno y el agua son representantes de los compuestos: contienen átomos de más de un tipo de elemento. El oxígeno molecular, por otro lado, como se muestra en la Figura\(\PageIndex{9}\), consiste en dos átomos de oxígeno doblemente unidos y no se clasifica como un compuesto sino como una molécula mononuclear.
Algunas reacciones químicas, como la mostrada anteriormente, pueden continuar en una dirección hasta que todos los reactivos se agotan. Las ecuaciones que describen estas reacciones contienen una flecha unidireccional y son irreversibles. Las reacciones reversibles son aquellas que pueden ir en cualquier dirección. En las reacciones reversibles, los reactivos se convierten en productos, pero cuando la concentración de producto va más allá de cierto umbral (característico de la reacción particular), algunos de estos productos se convertirán de nuevo en reactivos; en este punto, se invierten las designaciones de productos y reactivos. Esto de ida y vuelta continúa hasta que se produce un cierto equilibrio relativo entre los reactivos y los productos, un estado llamado equilibrio. Estas situaciones de reacciones reversibles a menudo se denotan por una ecuación química con una flecha de doble punta apuntando tanto hacia los reactivos como hacia los productos.
Por ejemplo, en sangre humana, el exceso de iones de hidrógeno (H +) se unen a iones bicarbonato (HCO 3 -) formando un estado de equilibrio con ácido carbónico (H 2 CO 3). Si se agregara ácido carbónico a este sistema, parte del mismo se convertiría en bicarbonato e iones hidrógeno.
\[\ce{HCO^{-}_3 + H^+ \leftrightarrow H_2CO_3} \nonumber\]
En las reacciones biológicas, sin embargo, rara vez se obtiene equilibrio debido a que las concentraciones de los reactivos o productos o ambos cambian constantemente, a menudo siendo un producto de una reacción un reactivo para otra. Para volver al ejemplo del exceso de iones de hidrógeno en la sangre, la formación de ácido carbónico será la dirección principal de la reacción. Sin embargo, el ácido carbónico también puede salir del cuerpo como gas dióxido de carbono (vía exhalación) en lugar de convertirse de nuevo en ion bicarbonato, impulsando así la reacción a la derecha por la ley química conocida como ley de acción masiva. Estas reacciones son importantes para mantener la homeostasis de nuestra sangre.
\[\ce{HCO_3^- + H^+ \leftrightarrow H_2CO_3 \leftrightarrow CO_2 + H_2O} \nonumber\]
Iones y enlaces iónicos
Algunos átomos son más estables cuando ganan o pierden un electrón (o posiblemente dos) y forman iones. Esto llena su capa de electrones más externa y los hace energéticamente más estables. Debido a que el número de electrones no es igual al número de protones, cada ion tiene una carga neta. Los cationes son iones positivos que se forman al perder electrones. Los iones negativos se forman ganando electrones y se llaman aniones. Los aniones son designados por su nombre elemental siendo alterado para terminar en “-ide”: el anión del cloro se llama cloruro, y el anión de azufre se llama sulfuro, por ejemplo.
Este movimiento de electrones de un elemento a otro se conoce como transferencia de electrones. Como\(\PageIndex{10}\) ilustra la Figura, el sodio (Na) solo tiene un electrón en su capa externa de electrones. Se necesita menos energía para que el sodio done ese electrón que para aceptar siete electrones más para llenar la capa externa. Si el sodio pierde un electrón, ahora tiene 11 protones, 11 neutrones, y sólo 10 electrones, dejándolo con una carga general de +1. Ahora se le conoce como un ion de sodio. El cloro (Cl) en su estado de energía más baja (llamado estado fundamental) tiene siete electrones en su capa externa. Nuevamente, es más eficiente energéticamente que el cloro gane un electrón que perder siete. Por lo tanto, tiende a ganar un electrón para crear un ion con 17 protones, 17 neutrones y 18 electrones, dándole una carga neta negativa (—1). Ahora se le conoce como un ion cloruro. En este ejemplo, el sodio donará su único electrón para vaciar su caparazón, y el cloro aceptará ese electrón para llenar su caparazón. Ambos iones ahora satisfacen la regla del octeto y tienen conchas más externas completas. Debido a que el número de electrones ya no es igual al número de protones, cada uno es ahora un ion y tiene una carga +1 (catión sodio) o —1 (anión cloruro). Tenga en cuenta que estas transacciones normalmente solo pueden realizarse simultáneamente: para que un átomo de sodio pierda un electrón, debe estar en presencia de un receptor adecuado como un átomo de cloro.
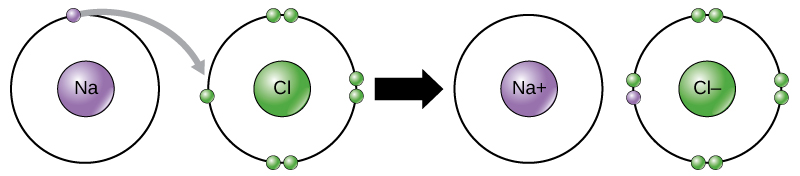
Se forman enlaces iónicos entre iones con cargas opuestas. Por ejemplo, los iones de sodio cargados positivamente y los iones de cloruro cargados negativamente se unen para hacer cristales de cloruro de sodio, o sal de mesa, creando una molécula cristalina con carga neta cero.
Ciertas sales son referidas en fisiología como electrolitos (incluyendo sodio, potasio y calcio), iones necesarios para la conducción del impulso nervioso, contracciones musculares y equilibrio hídrico. Muchas bebidas deportivas y suplementos dietéticos proporcionan estos iones para reemplazar los perdidos del cuerpo a través de la sudoración durante el ejercicio.
Enlaces Covalentes y Otros Enlaces e Interacciones
Otra forma en que se puede satisfacer la regla del octeto es compartiendo electrones entre átomos para formar enlaces covalentes. Estos enlaces son más fuertes y mucho más comunes que los enlaces iónicos en las moléculas de los organismos vivos. Los enlaces covalentes se encuentran comúnmente en moléculas orgánicas basadas en carbono, como nuestro ADN y proteínas. Los enlaces covalentes también se encuentran en moléculas inorgánicas como H 2 O, CO 2 y O 2. Uno, dos o tres pares de electrones pueden ser compartidos, formando enlaces simples, dobles y triples, respectivamente. Cuantos más enlaces covalentes entre dos átomos, más fuerte es su conexión. Así, los enlaces triples son los más fuertes.
La fuerza de los diferentes niveles de enlace covalente es una de las principales razones por las que los organismos vivos tienen dificultades para adquirir nitrógeno para su uso en la construcción de sus moléculas, aunque el nitrógeno molecular, N 2, es el gas más abundante en la atmósfera. El nitrógeno molecular consiste en dos átomos de nitrógeno triples unidos entre sí y, como con todas las moléculas, la compartición de estos tres pares de electrones entre los dos átomos de nitrógeno permite el llenado de sus capas externas de electrones, haciendo que la molécula sea más estable que los átomos de nitrógeno individuales. Este fuerte triple enlace dificulta que los sistemas vivos rompan este nitrógeno para usarlo como constituyentes de proteínas y ADN.
La formación de moléculas de agua proporciona un ejemplo de unión covalente. Los átomos de hidrógeno y oxígeno que se combinan para formar moléculas de agua están unidos entre sí por enlaces covalentes, como se muestra en la Figura\(\PageIndex{8}\). El electrón del hidrógeno divide su tiempo entre la capa externa incompleta de los átomos de hidrógeno y la capa externa incompleta de los átomos de oxígeno. Para llenar completamente la capa externa de oxígeno, que tiene seis electrones en su capa externa pero que sería más estable con ocho, se necesitan dos electrones (uno de cada átomo de hidrógeno): de ahí la conocida fórmula H 2 O. Los electrones se comparten entre los dos elementos para llenar la capa externa de cada uno, haciendo que ambos elementos sean más estables.
Enlace al aprendizaje
Video: Vea este breve video para ver una animación de unión iónica y covalente.
Enlaces Covalentes Polares
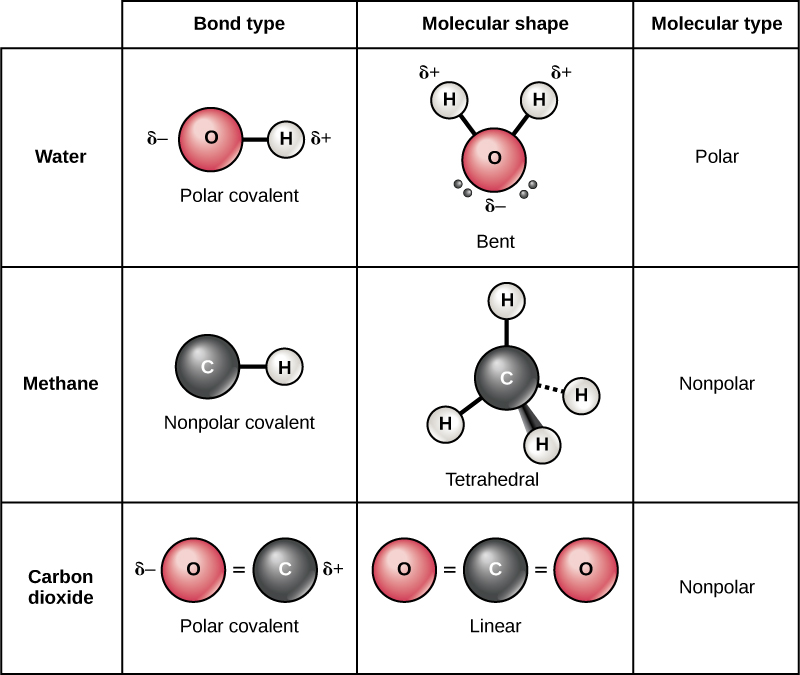
Existen dos tipos de enlaces covalentes: polares y no polares. En un enlace covalente polar, mostrado en la Figura\(\PageIndex{11}\), los electrones son desigualmente compartidos por los átomos y son atraídos más a un núcleo que al otro. Debido a la distribución desigual de electrones entre los átomos de diferentes elementos, se desarrolla una carga ligeramente positiva (δ +) o ligeramente negativa (δ —). Esta carga parcial es una propiedad importante del agua y da cuenta de muchas de sus características.
El agua es una molécula polar, con los átomos de hidrógeno adquiriendo una carga positiva parcial y el oxígeno una carga parcial negativa. Esto ocurre porque el núcleo del átomo de oxígeno es más atractivo para los electrones de los átomos de hidrógeno que el núcleo de hidrógeno para los electrones del oxígeno. Así, el oxígeno tiene una electronegatividad mayor que el hidrógeno y los electrones compartidos pasan más tiempo en las proximidades del núcleo de oxígeno que cerca del núcleo de los átomos de hidrógeno, dando a los átomos de oxígeno e hidrógeno cargas ligeramente negativas y positivas, respectivamente. Otra forma de afirmar esto es que la probabilidad de encontrar un electrón compartido cerca de un núcleo de oxígeno es más probable que encontrarlo cerca de un núcleo de hidrógeno. De cualquier manera, la electronegatividad relativa del átomo contribuye al desarrollo de cargas parciales siempre que un elemento sea significativamente más electronegativo que el otro, y las cargas generadas por estos enlaces polares pueden ser utilizadas para la formación de enlaces de hidrógeno basados en la atracción de opuestos cargos parciales. (Los enlaces de hidrógeno, que se discuten en detalle a continuación, son enlaces débiles entre átomos de hidrógeno ligeramente cargados positivamente y átomos ligeramente cargados negativamente en otras moléculas). Dado que las macromoléculas a menudo tienen átomos dentro de ellas que difieren en la electronegatividad, los enlaces polares a menudo están presentes en las moléculas orgánicas.
Enlaces covalentes no polares
Se forman enlaces covalentes no polares entre dos átomos del mismo elemento o entre diferentes elementos que comparten electrones por igual. Por ejemplo, el oxígeno molecular (O 2) es no polar porque los electrones estarán igualmente distribuidos entre los dos átomos de oxígeno.
Otro ejemplo de un enlace covalente no polar es el metano (CH 4), también mostrado en la Figura\(\PageIndex{11}\). El carbono tiene cuatro electrones en su caparazón más externo y necesita cuatro más para llenarlo. Obtiene estos cuatro de cuatro átomos de hidrógeno, cada átomo proporciona uno, haciendo una capa exterior estable de ocho electrones. El carbono y el hidrógeno no tienen la misma electronegatividad pero son similares; así, se forman enlaces no polares. Cada uno de los átomos de hidrógeno necesita un electrón para su capa más externa, que se llena cuando contiene dos electrones. Estos elementos comparten los electrones por igual entre los carbonos y los átomos de hidrógeno, creando una molécula covalente no polar.
Enlaces de hidrógeno e interacciones de Van Der Waals
Los enlaces iónicos y covalentes entre elementos requieren energía para romperse. Los enlaces iónicos no son tan fuertes como los covalentes, lo que determina su comportamiento en sistemas biológicos. Sin embargo, no todos los enlaces son enlaces iónicos o covalentes. También se pueden formar enlaces más débiles entre las moléculas. Dos enlaces débiles que ocurren con frecuencia son los enlaces de hidrógeno y las interacciones de van der Waals. Sin estos dos tipos de vínculos, la vida como la conocemos no existiría. Los enlaces de hidrógeno proporcionan muchas de las propiedades críticas de mantenimiento de la vida del agua y también estabilizan las estructuras de las proteínas y el ADN, el bloque de construcción de las células.
Cuando se forman enlaces covalentes polares que contienen hidrógeno, el hidrógeno en ese enlace tiene una carga ligeramente positiva porque el electrón del hidrógeno es arrastrado más fuertemente hacia el otro elemento y lejos del hidrógeno. Debido a que el hidrógeno es ligeramente positivo, se sentirá atraído por las cargas negativas vecinas. Cuando esto sucede, se produce una interacción débil entre el δ + del hidrógeno de una molécula y la δ — carga en los átomos más electronegativos de otra molécula, generalmente oxígeno o nitrógeno, o dentro de la misma molécula. Esta interacción se llama un enlace de hidrógeno. Este tipo de enlace es común y ocurre regularmente entre las moléculas de agua. Los enlaces individuales de hidrógeno son débiles y se rompen fácilmente; sin embargo, ocurren en cantidades muy grandes en el agua y en los polímeros orgánicos, creando una fuerza importante en combinación. Los enlaces de hidrógeno también son responsables de unir la doble hélice de ADN.
Al igual que los enlaces de hidrógeno, las interacciones de van der Waals son débiles atracciones o interacciones entre moléculas. Las atracciones de Van der Waals pueden ocurrir entre dos o más moléculas cualesquiera y dependen de ligeras fluctuaciones de las densidades de electrones, que no siempre son simétricas alrededor de un átomo. Para que estas atracciones sucedan, las moléculas necesitan estar muy cerca unas de otras. Estos enlaces, junto con los enlaces iónicos, covalentes y de hidrógeno, contribuyen a la estructura tridimensional de las proteínas en nuestras células que es necesaria para su correcto funcionamiento.
Conexión de Carrera: Químico Farmacéutico
Los químicos farmacéuticos son los responsables del desarrollo de nuevos fármacos y de tratar de determinar el modo de acción tanto de los medicamentos antiguos como de los nuevos. Están involucrados en cada paso del proceso de desarrollo de medicamentos. Los medicamentos se pueden encontrar en el medio natural o pueden sintetizarse en el laboratorio. En muchos casos, las drogas potenciales que se encuentran en la naturaleza se cambian químicamente en el laboratorio para hacerlas más seguras y efectivas, y en ocasiones las versiones sintéticas de las drogas sustituyen a la versión que se encuentra en la naturaleza.
Después del descubrimiento o síntesis inicial de un fármaco, el químico desarrolla entonces el medicamento, tal vez alterándolo químicamente, probándolo para ver si el medicamento es tóxico, y luego diseñando métodos para una producción eficiente a gran escala. Entonces, comienza el proceso de obtener el medicamento aprobado para uso humano. En Estados Unidos, la aprobación de medicamentos es manejada por la Administración de Alimentos y Medicamentos (FDA) e implica una serie de experimentos a gran escala con sujetos humanos para asegurarse de que el medicamento no sea dañino y trate de manera efectiva la afección que pretende tratar. Este proceso suele llevar varios años y requiere la participación de médicos y científicos, además de químicos, para completar las pruebas y obtener la aprobación.
Un ejemplo de un medicamento que fue descubierto originalmente en un organismo vivo es Paclitaxel (Taxol), un medicamento anticanceroso que se usa para tratar el cáncer de mama. Esta droga fue descubierta en la corteza del tejo del Pacífico. Otro ejemplo es la aspirina, originalmente aislada de corteza de sauce. Encontrar drogas a menudo significa probar cientos de muestras de plantas, hongos y otras formas de vida para ver si se encuentran compuestos biológicamente activos dentro de ellos. A veces, la medicina tradicional puede dar pistas a la medicina moderna sobre dónde se puede encontrar un compuesto activo. Por ejemplo, el uso de la corteza de sauce para hacer medicina se conoce desde hace miles de años, que se remonta al antiguo Egipto. No fue hasta finales del siglo XIX, sin embargo, que la molécula de aspirina, conocida como ácido acetilsalicílico, fue purificada y comercializada para uso humano.
Ocasionalmente, se encuentra que los medicamentos desarrollados para un solo uso tienen efectos imprevistos que permiten que estos medicamentos se usen de otras formas no relacionadas. Por ejemplo, el medicamento minoxidil (Rogaine) se desarrolló originalmente para tratar la presión arterial alta. Cuando se probó en humanos, se notó que las personas que tomaban el medicamento crecerían cabello nuevo. Eventualmente la droga fue comercializada a hombres y mujeres con calvicie para restaurar el cabello perdido.
La carrera del químico farmacéutico puede implicar trabajo de detective, experimentación y desarrollo de medicamentos, todo con el objetivo de hacer que los seres humanos sean más saludables.
Resumen
La materia es cualquier cosa que ocupa espacio y tiene masa. Se compone de elementos. Todos los 92 elementos que ocurren naturalmente tienen cualidades únicas que les permiten combinarse de diversas maneras para crear moléculas, que a su vez se combinan para formar células, tejidos, sistemas de órganos y organismos. Los átomos, que consisten en protones, neutrones y electrones, son las unidades más pequeñas de un elemento que conservan todas las propiedades de ese elemento. Los electrones pueden transferirse, compartirse o causar disparidades de carga entre los átomos para crear enlaces, incluidos los enlaces iónicos, covalentes e hidrógeno, así como las interacciones de van der Waals.
Conexiones de arte
Figura\(\PageIndex{2}\): ¿Cuántos neutrones tienen el carbono-12 y el carbono-13, respectivamente?
- Contestar
-
El carbono-12 tiene seis neutrones. El Carbono-13 tiene siete neutrones.
Figura\(\PageIndex{6}\): Un átomo puede dar, tomar o compartir electrones con otro átomo para lograr una capa de valencia completa, la configuración electrónica más estable. Al observar esta cifra, ¿cuántos electrones necesitan perder los elementos del grupo 1 para lograr una configuración electrónica estable? ¿Cuántos electrones necesitan ganar los elementos de los grupos 14 y 17 para lograr una configuración estable?
- Contestar
-
Los elementos del grupo 1 necesitan perder un electrón para lograr una configuración electrónica estable. Los elementos de los grupos 14 y 17 necesitan ganar cuatro y uno electrones, respectivamente, para lograr una configuración estable.
Glosario
- anión
- ión negativo que está formado por un átomo que gana uno o más electrones
- átomo
- la unidad de materia más pequeña que conserva todas las propiedades químicas de un elemento
- masa atómica
- media calculada del número de masa para los isótopos de un elemento
- número atómico
- número total de protones en un átomo
- ecuación química equilibrada
- declaración de una reacción química con el número de cada tipo de átomo igualado tanto para los productos como para los reactivos
- catión
- ión positivo que está formado por un átomo que pierde uno o más electrones
- enlace químico
- interacción entre dos o más átomos iguales o diferentes que da como resultado la formación de moléculas
- reacción química
- proceso que conduce a la reorganización de los átomos en las moléculas
- reactividad química
- la capacidad de combinar y unirse químicamente entre sí
- compuesto
- sustancia compuesta por moléculas que consisten en átomos de al menos dos elementos diferentes
- enlace covalente
- tipo de enlace fuerte formado entre dos elementos iguales o diferentes; formas cuando los electrones se comparten entre átomos
- electrolito
- iones necesarios para la conducción del impulso nervioso, las contracciones musculares y el equilibrio hídrico
- electrón
- partícula subatómica cargada negativamente que reside fuera del núcleo en el orbital electrónico; carece de masa funcional y tiene una carga negativa de —1 unidad
- configuración de electrones
- disposición de electrones en la capa de electrones de un átomo (por ejemplo, 1s 2 2s 2 2p 6)
- electrón orbital
- cómo se distribuyen espacialmente los electrones alrededor del núcleo; el área donde es más probable que se encuentre un electrón
- transferencia de electrones
- movimiento de electrones de un elemento a otro; importante en la creación de enlaces iónicos
- electronegatividad
- capacidad de algunos elementos para atraer electrones (a menudo de átomos de hidrógeno), adquirir cargas negativas parciales en las moléculas y crear cargas positivas parciales en los átomos de hidrógeno
- elemento
- una de 118 sustancias únicas que no se pueden descomponer en sustancias más pequeñas; cada elemento tiene propiedades únicas y un número específico de protones
- equilibrio
- estado estacionario de reactivo relativo y concentración de producto en reacciones químicas reversibles en un sistema cerrado
- enlace de hidrógeno
- enlace débil entre átomos de hidrógeno ligeramente cargados positivamente y átomos ligeramente cargados negativamente en otras moléculas
- gas inerte
- (también, gas noble) elemento con capa externa llena de electrones que no es reactiva con otros átomos
- ion
- átomo o grupo químico que no contenga el mismo número de protones y electrones
- enlace iónico
- enlace químico que se forma entre iones con cargas opuestas (cationes y aniones)
- reacción química irreversible
- reacción química donde los reactivos proceden unidireccionalmente para formar productos
- isótopo
- una o más formas de un elemento que tienen diferentes números de neutrones
- ley de acción masiva
- ley química que establece que la velocidad de una reacción es proporcional a la concentración de las sustancias reaccionantes
- número de masa
- número total de protones y neutrones en un átomo
- materia
- cualquier cosa que tenga masa y ocupe espacio
- molécula
- dos o más átomos unidos químicamente entre sí
- neutrones
- partícula sin carga que reside en el núcleo de un átomo; tiene una masa de una amu
- gas noble
- ver gas inerte
- enlace covalente no polar
- tipo de enlace covalente que se forma entre los átomos cuando los electrones se comparten por igual entre ellos
- núcleo
- núcleo de un átomo; contiene protones y neutrones
- regla del octeto
- gobiernan que los átomos son más estables cuando contienen ocho electrones en sus conchas más externas
- orbital
- región que rodea el núcleo; contiene electrones
- tabla periódica
- organigrama de los elementos que indican el número atómico y la masa atómica de cada elemento; proporciona información clave sobre las propiedades de los elementos
- enlace covalente polar
- tipo de enlace covalente que se forma como resultado de la distribución desigual de electrones, lo que resulta en la creación de regiones cargadas ligeramente positivas y ligeramente negativas de la molécula
- producto
- molécula encontrada en el lado derecho de una ecuación química
- protón
- partícula cargada positivamente que reside en el núcleo de un átomo; tiene una masa de un amu y una carga de +1
- radioisótopo
- isótopo que emite radiación compuesta por partículas subatómicas para formar elementos más estables
- reactante
- molécula encontrada en el lado izquierdo de una ecuación química
- Reacción química reversible
- reacción química que funciona bidireccionalmente, donde los productos pueden convertirse en reactivos si su concentración es lo suficientemente grande
- concha de valencia
- caparazón más exterior de un átomo
- Interacción de van der Waals
- interacción muy débil entre moléculas debido a cargas temporales que atraen átomos que están muy cerca


