3.5: Carbohidratos
- Page ID
- 53621
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)La última clase de macromoléculas que consideraremos estructuralmente aquí son los carbohidratos. Construidos con azúcares o azúcares modificados, los carbohidratos tienen varias funciones importantes, incluyendo integridad estructural, identificación celular y almacenamiento de energía.
Monosacáridos
Los azúcares simples, también conocidos como monosacáridos, generalmente se pueden escribir en la forma\(C_x(H_2O)_x\). Es por esta razón que se les conoce como carbohidratos. Por convención, las letras 'ose' al final de un nombre bioquímico señalan una molécula como azúcar. Así, hay glucosa, galactosa, sacarosa, y muchos otros '-oses'. Otra nomenclatura descriptiva implica el uso de un prefijo que indica cuántos carbonos contiene el azúcar. Por ejemplo, la glucosa, que contiene seis carbonos, se describe como una hexosa. La siguiente lista muestra los prefijos para números de carbonos en un azúcar:
- Tri- = 3
- Tetr- = 4
- Pent- = 5
- Hex- =6
- Hept- = 7
- Oct- = 8
Otros prefijos identifican si el azúcar contiene un grupo aldehído (aldo-) o un grupo cetona (cetónico). Los prefijos se pueden combinar. La glucosa, que contiene un grupo aldehído, puede describirse como una aldo-hexosa. La lista que sigue da algunos azúcares comunes y algunos descriptores.
- Ribosa = aldo-pentosa
- Glucosa = aldo-hexosa
- Galactosa = aldo-hexosa
- Manosa = aldo-hexosa
- Gliceraldehído = aldo-triosa
- Eritrosa — aldo-tetrosa
- Fructosa = ceto-hexosa
- Ribulosa = ceto-pentosa
- Sedoheptulosa = ceto-heptosa
- Dihidroxiacetona = ceto-triosa
Nomenclatura de estereoisómeros
Los azúcares de una categoría determinada (hexosas, por ejemplo) difieren entre sí en la configuración estereoisomérica de sus carbonos. Dos azúcares que tienen el mismo número de carbonos (hexosas, por ejemplo) y la misma forma química (aldosas, por ejemplo), pero que difieren en la configuración estereoisomérica de sus carbonos se denominan diastereómeros. Los bioquímicos utilizan la nomenclatura D y L para describir los azúcares, como se explica a continuación.
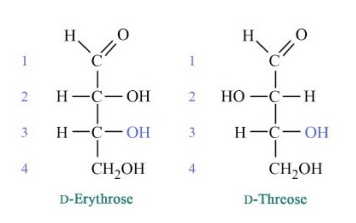
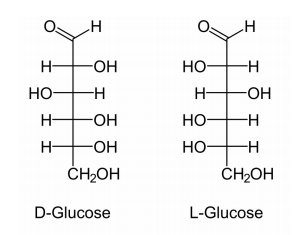
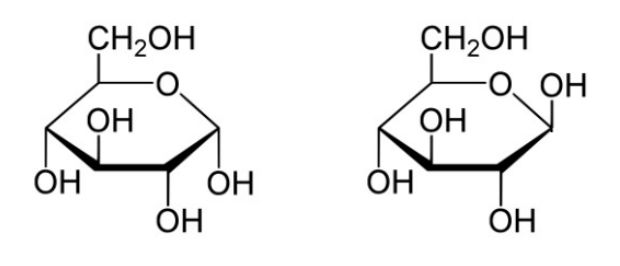
Los D-azúcares predominan en la naturaleza, aunque existen formas L de algunos azúcares, como la fucosa. La designación D y L es un poco más complicada de lo que aparecería en la superficie. Para determinar si un azúcar es un D-azúcar o un L-azúcar, simplemente se examina la configuración del carbono asimétrico numerado más alto. Si el hidroxilo está escrito a la derecha, es un D-azúcar. Si el hidroxilo está a la izquierda, es un L-azúcar. Esa parte es simple. La confusión sobre D y L surge porque los azúcares L de un nombre dado (glucosa, por ejemplo) son imágenes especulares de azúcares D del mismo nombre. La figura de la página anterior muestra la estructura de D- y L- glucosa. Observe que la D-glucosa no se convierte en L-glucosa simplemente por .ipping la configuración del quinto carbono en la molécula. Hay otro nombre para los azúcares que son imágenes especulares entre sí. Se les llama enantiómeros. Así, L-glucosa y D-glucosa son enantiómeros, pero D-Eritrosa y D-Treosa son diastereómeros.
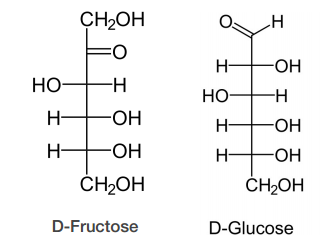
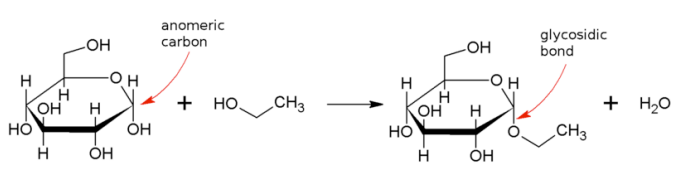
Los azúcares de 5-7 carbonos pueden formar fácilmente estructuras de anillo (llamadas estructuras Haworth). Para las aldosas como la glucosa, esto implica la formación de un hemi-acetal. Para las cetosas como la fructosa, implica la formación de un hemicetal. La conclusión para ambos es que el oxígeno que formaba parte del grupo aldehído o cetona es el que se convierte en parte del anillo. Más importante que el oxígeno, sin embargo, es el hecho de que el carbono unido a él (carbono #1 en aldosas o #2 en cetosas) se vuelve asimétrico como subproducto de la ciclación. Este nuevo carbono asimétrico se llama carbono anomérico y tiene dos configuraciones posibles, llamadas alfa y beta.
Una solución de glucosa contendrá una mezcla de formas alfa y beta. El hecho de que el alfa o el beta surja tras la ciclación está determinado en parte por la geometría y en parte al azar. Así, uno puede encontrar un sesgo por una forma, pero generalmente no esa forma exclusivamente. Una molécula dada de azúcar cambiará entre alfa y beta con el tiempo. Un requisito para esto es que el hidroxilo en el carbono anomérico esté inalterado, facilitando así el volteo a la forma de cadena recta seguido de la reciclación. Si el hidroxilo se altera químicamente de alguna manera (por ejemplo, la sustitución de su hidrógeno por un grupo metilo), se forma un glucósido. Los glucósidos están bloqueados en la misma configuración alfa o beta en la que se encontraban cuando se realizó la modificación. Los glucósidos se encuentran comúnmente en la naturaleza. La sacarosa, por ejemplo, es un diglicósido —tanto la glucosa como la fructosa han tenido sus hidroxilos anoméricos alterados al unirse entre sí.
Las últimas consideraciones para los azúcares en relación con su estructura son su reactividad química y modificación. El grupo aldehído de las aldosas es susceptible a la oxidación, mientras que las cetosas lo son menos. Los azúcares que se oxidan fácilmente se denominan “azúcares reductores” porque su oxidación hace que se reduzcan otras moléculas reaccionantes. Los azúcares reductores se pueden identificar fácilmente en una prueba química. La modificación química de los azúcares ocurre fácilmente en las células. Como veremos, la fosforilación de azúcares ocurre de manera rutinaria durante el metabolismo. También puede ocurrir la oxidación de azúcares para crear grupos carboxilo. La reducción de los grupos aldehído/cetona de azúcares crea lo que se llama alcoholes de azúcar, y también ocurren fácilmente otras modificaciones, como la adición de sulfatos y aminas.
Conformaciones de barcos/sillas
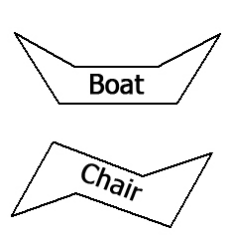
Independientemente de la estereoisomerización, los azúcares en forma de anillo de un tipo dado (como la glucosa) pueden “retorcerse” en conformaciones alternativas llamadas barco y silla. Obsérvese que este reordenamiento no cambia las posiciones relativas de los grupos hidroxilo. Todo lo que ha cambiado es la forma de la molécula. Como se muestra para la glucosa, se puede ver que el beta-hidroxilo de la glucosa está más cerca del\(CH_2OH\) (carbono #6) en forma de bote que en forma de silla. El impedimento estérico puede ser un factor para favorecer una configuración sobre otra.
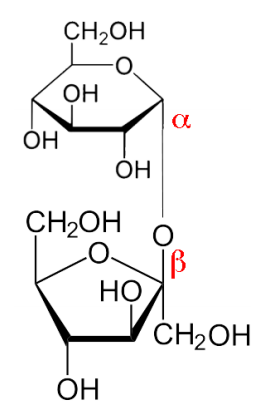
Disacáridos
Los azúcares se unen fácilmente (y se rompen) en las células. La sacarosa (Figura\(\PageIndex{7}\)), que es azúcar de mesa común, se elabora uniendo el hidroxilo anomérico de alfa-D-glucosa al hidroxilo anomérico de beta-D-fructosa. No todos los disacáridos se unen a los hidroxilos anoméricos de ambos azúcares. Por ejemplo, la lactosa (azúcar de la leche) se elabora uniendo el hidroxilo anomérico de galactosa en la configuración beta al hidroxilo del carbono #4 de la glucosa.
Oligosacáridos
El término 'oligosacárido' se usa para describir polímeros de azúcares de 5-15 unidades, típicamente. Los oligosacáridos no se encuentran comúnmente libres en las células, sino que se encuentran unidos covalentemente a proteínas, que luego se dice que están glicosiladas. Los oligosacáridos unidos a las proteínas pueden estar unidos a N (a través de asparagina) o unidos a O (a través de serina o treonina). Los azúcares ligados a O se agregan solo en el aparato de Golgi mientras que los azúcares ligados a N se unen comenzando en el retículo endoplásmico y luego completados en el Golgi.
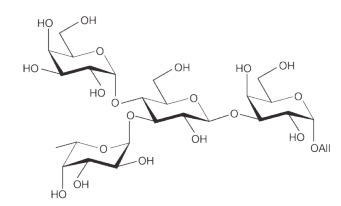
Los oligosacáridos a menudo funcionan como marcadores de identidad, tanto de células como de proteínas. En la superficie celular, las glicoproteínas con oligosacáridos distintivos unidos establecen la identidad de cada célula. Los tipos de oligosacáridos que se encuentran en la superficie de las células sanguíneas es un determinante del tipo de sangre. Los oligosacáridos que se unen a las proteínas también pueden determinar sus destinos celulares. Los patrones inadecuados de glicosilación o modificación del azúcar pueden resultar en el fracaso de las proteínas para alcanzar el compartimento celular correcto. Por ejemplo, la enfermedad de células de inclusión (células I) surge de una fosfotransferasa defectuosa en el Golgi. Esta enzima normalmente cataliza la adición de un fosfato a un azúcar de manosa unido a una proteína destinada al lisosoma. En ausencia de una enzima funcional, la glicoproteína no fosforilada nunca llega al lisosoma y en su lugar se exporta fuera de la célula donde se acumula en la sangre y se excreta en la orina. Los individuos con enfermedad de células I sufren retrasos en el desarrollo, desarrollo esquelético anormal y restricción del movimiento articular.
Polisacáridos
Los polisacáridos, como su nombre lo indica, se elaboran uniendo muchos azúcares. Las funciones de los polisacáridos son variadas. Incluyen almacenamiento de energía, resistencia estructural y lubricación. Los polisacáridos involucrados en el almacenamiento de energía incluyen los polisacáridos vegetales, amilosa y amilopectina. El polisacárido involucrado en el almacenamiento de energía en los animales se llama glucógeno y se encuentra principalmente en los músculos y el hígado.
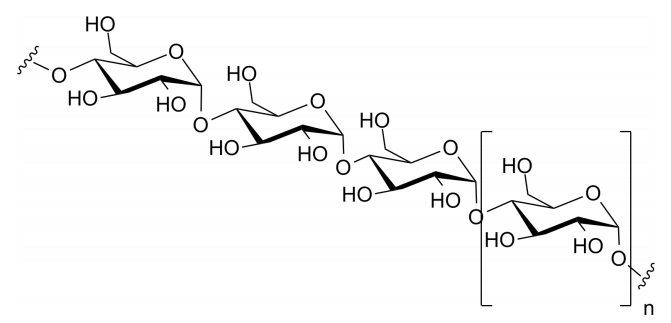
Amilosa/Amilopectina
La amilosa es el más simple de los polisacáridos, estando compuesta únicamente por unidades de glucosa unidas en un enlace alfa 1-4. La amilosa es descompuesta por la enzima alfa-amilasa, que se encuentra en la saliva. La amilopectina se relaciona con la amilosa al estar compuesta solo por glucosa, pero difiere en cómo se unen las unidades de glucosa. Predominan los enlaces alfa 1-4, pero cada 30-50 residuos, una 'rama' surge de un enlace alfa 1-6. Las ramas hacen que la estructura de la amilopectina sea más compleja que la de la amilosa.
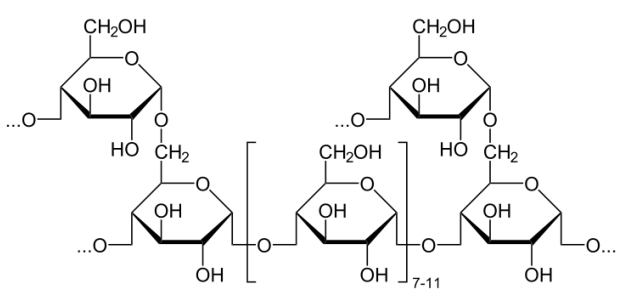
Glucógeno
El glucógeno es un polisacárido que se relaciona físicamente con la amilopectina al estar construido solo de glucosa y en tener una mezcla de enlaces alfa 1-4 y alfa 1-6. El glucógeno, sin embargo, tiene muchas más ramas alfa 1-6 que la amilopectina, con tales enlaces que ocurren aproximadamente cada 10 residuos. Uno podría preguntarse por qué tal ramificación ocurre más abundantemente en los animales que en las plantas. Una explicación plausible se basa en el método por el cual se descomponen estas moléculas. La descomposición de estos polisacáridos es catalizada por enzimas, conocidas como fosforilasas, que recortan los residuos de glucosa de los extremos de las cadenas de glucógeno y les unen un fosfato en el proceso, produciendo glucosa-1-fosfato. Los polisacáridos más altamente ramificados tienen más extremos para recortar, y esto se traduce en más glucosa-1-fosfatos que pueden ser eliminados simultáneamente por numerosas fosforilasas. Dado que la glucosa es utilizada como energía por los músculos, las concentraciones de glucosa pueden aumentarse más rápido cuanto más ramificado sea el glucógeno. Las plantas, que son inmóviles no tienen necesidad de tal liberación inmediata de glucosa y por lo tanto tienen menos necesidad de polisacáridos altamente ramificados.
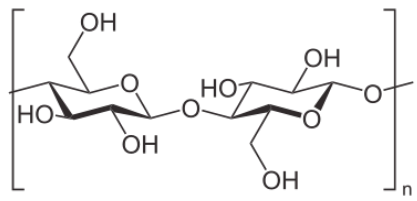
Celulosa
Otro polisacárido importante que contiene solo glucosa es la celulosa. Es un polímero de glucosa utilizado para dar integridad estructural a las paredes celulares vegetales y tiene las unidades individuales unidas únicamente en una configuración beta 1-4. Ese simple cambio estructural hace una diferencia radical en su digestibilidad. Los humanos son incapaces de descomponer la celulosa y ésta pasa a través del sistema digestivo como forraje. Los animales rumiantes, como el ganado bovino, sin embargo tienen bacterias en sus rumenes que contienen la enzima celulasa. Rompe los enlaces beta 1-4 de las glucosas en la celulosa para liberar los azúcares para obtener energía.
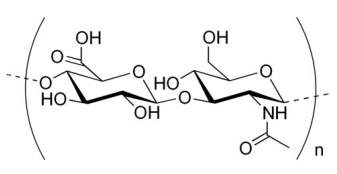
Otro polisacárido utilizado para la integridad estructural se conoce como quitina. La quitina constituye el exoesqueleto de insectos y es un polímero de una forma modificada de glucosa conocida como N-acetil-glucosamina.
Glicosaminoglicanos
Otra categoría más de polisacáridos son los glicosaminoglicanos (también llamados mucopolisacáridos), algunos ejemplos de los cuales incluyen sulfato de queratano, heparina, ácido hialurónico (derecha) y sulfato de condroitina. Los compuestos polisacáridos están unidos a proteínas, pero difieren de las glicoproteínas en tener un contingente mucho mayor de residuos de azúcar y, además, los azúcares están considerablemente más modificados químicamente. Cada uno de ellos contiene una unidad repetitiva de un disacárido que contiene al menos un residuo cargado negativamente. El resultado es una sustancia polianiónica que, en sus interacciones con el agua, genera una sensación “baba”. Los glicosaminoglicanos se encuentran en los mocos, y en el líquido sinovial, que lubrica las articulaciones. La heparina es un glicosaminoglicano que ayuda a prevenir la coagulación de la sangre.