12.4: Ley de Gas Ideal
- Page ID
- 128331
objetivos de aprendizaje
- Describir cómo se derivó la ley de gas ideal.
La ley del gas ideal es la ecuación de estado de un gas ideal hipotético (se ofrece una ilustración en). En un gas ideal, no hay interacción molécula-molécula, y solo se permiten colisiones elásticas. Es una buena aproximación al comportamiento de muchos gases bajo muchas condiciones, aunque tiene varias limitaciones. Fue declarado por primera vez por Émile Clapeyron en 1834 como una combinación de la ley de Boyle y la ley de Charles.
Átomos y Módulos en un Gas: Los átomos y moléculas en un gas suelen estar ampliamente separados, como se muestra. Debido a que las fuerzas entre ellos son bastante débiles a estas distancias, a menudo son descritas por la ley ideal del gas.
Derivación empírica
La ley de Boyle establece que la presión P y el volumen V de una masa dada de gas confinado son inversamente proporcionales:
\[\mathrm{P∝\dfrac{1}{V},}\]
mientras que la ley de Charles establece que el volumen de un gas es proporcional a la temperatura absoluta T del gas a presión constante
\[\mathrm{V∝T.}\]
Al combinar las dos leyes, obtenemos
\[\mathrm{\dfrac{PV}{T}=C,}\]
donde C es una constante que es directamente proporcional a la cantidad de gas, n (que representa el número de moles).
El factor de proporcionalidad es la constante universal del gas, R, i.e\(\mathrm{C = nR}\).
De ahí la ley de gas ideal
\[\mathrm{PV=nRT}\]
Equivalentemente, puede escribirse como\(\mathrm{PV=NkT}\),
donde k es la constante de Boltzmann y N es el número de moléculas.
(Desde N = nN A, se puede ver eso\(\mathrm{R=N_{Ak}}\), donde N A es el número de Avogadro.)
Nótese que la derivación empírica no considera detalles microscópicos. Sin embargo, la ecuación puede derivarse de los primeros principios de la termodinámica clásica (que va más allá del alcance de este Átomo).
Versión microscópica
Hemos visto en el Átomo sobre “Origen de la Presión” que
\[\mathrm{P=\dfrac{Nm\bar{v^2}}{3V},}\]
donde P es la presión, N es el número de moléculas, m es la masa de la molécula, v es la velocidad de las moléculas y V es el volumen del gas. Por lo tanto, derivamos una versión microscópica de la ley de gas ideal
\[\mathrm{PV=\dfrac{1}{3}Nm\bar{v^2}}\]
Isotermas
Un proceso isotérmico es un cambio de un sistema en el que la temperatura permanece constante:\(\mathrm{ΔT = 0}\).
objetivos de aprendizaje
- Identificar las condiciones en las que pueden ocurrir procesos isotérmicos.
Un proceso isotérmico es un cambio de un sistema en el que la temperatura permanece constante: ΔT = 0. Normalmente esto ocurre cuando un sistema está en contacto con un depósito térmico exterior (baño de calor), y el cambio ocurre lo suficientemente lento como para permitir que el sistema se ajuste continuamente a la temperatura del depósito a través del intercambio de calor. En contraste, un proceso adiabático ocurre cuando un sistema no intercambia calor con su entorno (Q = 0). Es decir, en un proceso isotérmico, el valor ΔT = 0 pero Q ≠ 0, mientras que en un proceso adiabático, ΔT ≠ 0 pero Q = 0.
Para un gas ideal, el producto PV (P: presión, V: volumen) es una constante si el gas se mantiene en condiciones isotérmicas (ley de Boyle). Según la ley de gas ideal, el valor de la constante es NKt, donde N es el número de moléculas de gas y k es la constante de Boltzmann.
Esto significa que\(\mathrm{p=\frac{NkT}{V}=\frac{Constant}{V}}\) sostiene.
La familia de curvas generada por esta ecuación se muestra en la gráfica presentada en. Cada curva se llama isoterma. Dichos gráficos se denominan diagramas indicadores, utilizados primero por James Watt y otros para monitorear la eficiencia de los motores. La temperatura correspondiente a cada curva en la figura aumenta de la parte inferior izquierda a la superior derecha.
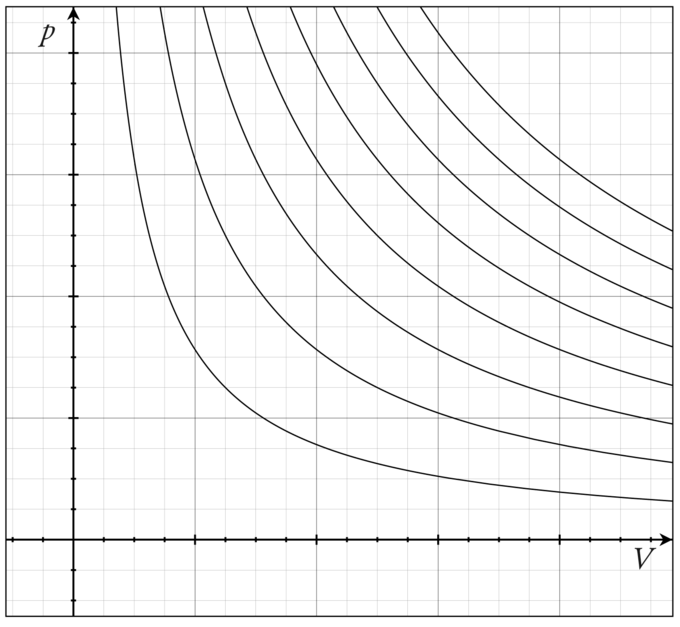
Isotermas de un Gas Ideal: Varias isotermas de un gas ideal en un diagrama PV.
Cálculo de Obra
En la termodinámica, el trabajo que implica cuando un gas cambia del estado A al estado B es simplemente:
\[\mathrm{W_{A \rightarrow B}=∫_{V_A}^{V_B}PdV.}\]
(Esta ecuación se deriva en nuestro Átomo sobre “Presión Constante” bajo la teoría cinética. Tenga en cuenta que\(\mathrm{P = \frac{F}{A}}\). Esta definición es consistente con nuestra definición de trabajo siendo fuerza tiempos distancia.)
Para un proceso isotérmico reversible, esta integral equivale al área bajo la isoterma presión-volumen relevante, y se indica en azul para un gas ideal. Nuevamente,\(\mathrm{P = \frac{nRT}{V}}\) aplica y con T siendo constante (ya que este es un proceso isotérmico), tenemos:
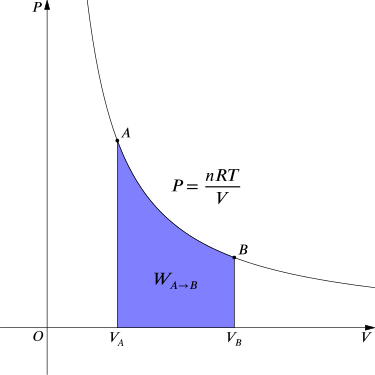
Trabajo realizado por gas durante la expansión: El área azul representa el “trabajo” realizado por el gas durante la expansión para este cambio isotérmico.
\[ \begin{align} \mathrm{W_{A \rightarrow B}} & \mathrm{=∫_{V_A}^{V_B}pdV=∫_{V_A}^{V_B} \dfrac{NkT}{V}dV} \\ & \mathrm{=NkT \ln \dfrac{V_B}{V_A}.}\end{align} \]
Por convención, el trabajo se define como el trabajo que el sistema realiza en su entorno. Si, por ejemplo, el sistema se expande por un pistón moviéndose en la dirección de la fuerza aplicada por la presión interna de un gas, entonces el trabajo se cuenta como positivo. Como este trabajo se realiza mediante el uso de energía interna del sistema, el resultado es que la energía interna disminuye. Por el contrario, si el ambiente sí trabaja en el sistema para que su energía interna aumente, el trabajo se cuenta como negativo (para detalles sobre la energía interna, consulte nuestro Átomo en “Energía Interna de un Gas Ideal”).
Presión Constante
Proceso isobárico es un proceso termodinámico en el que la presión se mantiene constante (a presión constante, el trabajo realizado por un gas es\(\mathrm{PΔV}\)).
objetivos de aprendizaje
- Describir el comportamiento del gas monatómico durante los procesos isobáricos.
Bajo cierta restricción (por ejemplo, presión), los gases pueden expandirse o contraerse; dependiendo del tipo de restricción, el estado final del gas puede cambiar. Por ejemplo, un gas ideal que se expande mientras su temperatura se mantiene constante (llamado proceso isotérmico) existirá en un estado diferente al de un gas que se expande mientras la presión permanece constante (llamado proceso isobárico). Este átomo aborda el proceso isobárico y los términos correlacionados. Discutiremos el proceso isotérmico en un átomo posterior.
Proceso isobárico
Un proceso isobárico es un proceso termodinámico en el que la presión se mantiene constante:\(\mathrm{ΔP = 0}\). Para un gas ideal, esto significa que el volumen de un gas es proporcional a su temperatura (históricamente, esto se llama ley de Charles). Consideremos un caso en el que un gas sí funciona sobre un pistón a presión constante P, refiriéndose a la Fig. 1 como ilustración. Dado que la presión es constante, la fuerza ejercida es constante y el trabajo realizado se da como W=Fd, donde F (=PA) es la fuerza sobre el pistón aplicada por la presión y d es el desplazamiento del pistón. Por lo tanto, el trabajo realizado por el gas (W) es:
\[\mathrm{W=PAd}\]
Debido a que el cambio de volumen de un cilindro es su área de sección transversal A veces el desplazamiento d, vemos que Ad=ΔV, el cambio de volumen. Por lo tanto,
\[\mathrm{W=PΔV}\]
(como se ve en la Fig 2—proceso isobárico). Nota: si ΔV es positivo, entonces W es positivo, lo que significa que el trabajo lo realiza el gas en el mundo exterior. Usando la ley de gas ideal\(\mathrm{PV=NkT (P=const)}\),
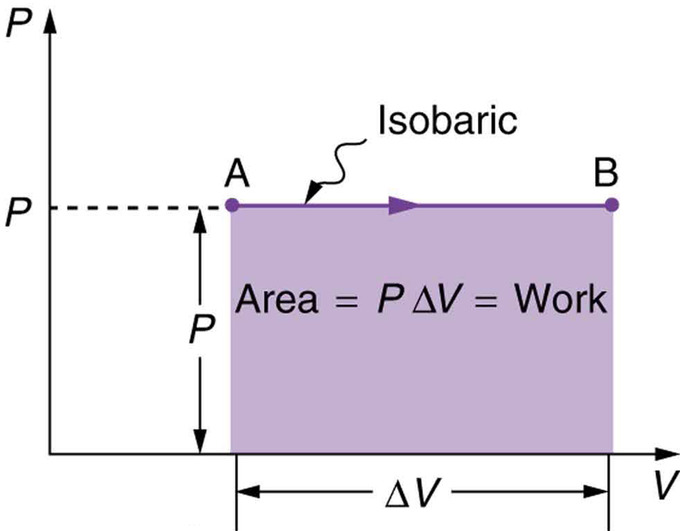
Fig 2: Un gráfico de presión versus volumen para un proceso de presión constante o isobárico. El área bajo la curva es igual al trabajo realizado por el gas, ya que W=PΔV.
\[\mathrm{W=NkΔT}\]
(Ec. 1) para un gas ideal sometido a un proceso isobárico.
Gas Monatómico
Según la primera ley de la termodinámica,
\[\mathrm{Q=ΔU+W}\]
(Ecuación 2), donde W es el trabajo realizado por el sistema, U es energía interna y Q es calor. La ley dice que el calor transferido al sistema sí funciona pero también cambia la energía interna del sistema. Dado que,
\(\mathrm{U=\frac{3}{2}NkT}\)para un gas monatómico, obtenemos\(\mathrm{ΔU=\frac{3}{2}NkΔT}\)
(Ecuación 3; para los detalles sobre la energía interna, consulte nuestro Átomo sobre “Energía Interna de un Gas Ideal”). Mediante el uso de las Ecuaciones 1 y 3, la Ecuación 2 se puede escribir como:
\(\mathrm{Q=\frac{5}{2}NkΔT}\)para gas monatómico en un proceso isobárico.
Calor Específico
El calor específico a presión constante se define por la siguiente ecuación:
\(\mathrm{Q=ncPΔT}\)
Aquí n es la cantidad de partículas en un gas representado en moles. Al señalar que\(\mathrm{N = N_An}\) y\(\mathrm{R = kN_A}\) (N A: número de Avogadro, R: constante de gas universal), derivamos:
\(\mathrm{c_P=\frac{5}{2}kN_A=\frac{5}{2}R}\)para un gas monatómico.
Resolución de problemas
Con la ley de gas ideal podemos calcular presión, volumen o temperatura, y el número de moles de gases en condiciones termodinámicas ideales.
objetivos de aprendizaje
- Identificar los pasos utilizados para resolver la ecuación de gas ideal.
La Ley del Gas Ideal es la ecuación de estado de un hipotético gas ideal. Es una buena aproximación al comportamiento de muchos gases bajo muchas condiciones, aunque tiene varias limitaciones. Es más preciso para gases monatómicos a altas temperaturas y bajas presiones.
La ley de gas ideal tiene la forma:
\[\mathrm{PV=nRT,}\]
donde R es la constante universal del gas, y con ella podemos encontrar valores de la presión P, volumen V, temperatura T, o número de moles n bajo cierta condición termodinámica ideal. Por lo general, se le dan parámetros suficientes para calcular lo desconocido. Las variaciones de la ecuación de gas ideal pueden ayudar a resolver el problema fácilmente. Aquí hay algunos consejos generales.
La ley de gas ideal también puede venir en la forma:
\[\mathrm{PV=NkT,}\]
donde N es el número de partículas en el gas y k es la constante de Boltzmann.
Para resolver la ecuación de gas ideal:
- Anota toda la información que conozcas sobre el gas.
- Si es necesario, convierta los valores conocidos a unidades SI.
- Elija una ecuación de ley de gas relevante que le permita calcular la variable desconocida.
- Sustituir los valores conocidos en la ecuación. Calcular la variable desconocida.
Recuerde que la ecuación general del gas sólo se aplica si la cantidad molar del gas es fija. Por ejemplo, si un gas se mezcla con otro gas, es posible que tenga que aplicar la ecuación por separado para gases individuales.
Ejemplo
Imaginemos que al inicio de un viaje una llanta de camión tiene un volumen de 30,000 cm 3 y una presión interna de 170 kPa. La temperatura de la llanta es de 16° C. Al final del viaje, el volumen del neumático ha aumentado a 32,000 cm 3 y la temperatura del aire dentro de la llanta es de 40 ° C. ¿Cuál es la presión del neumático al final del recorrido?

Presión de las llantas: La presión de las llantas puede cambiar significativamente durante la operación del vehículo. Esto se debe principalmente al cambio de temperatura del aire en las llantas.
Solución:
Paso 1. Anota toda la información que conozcas sobre el gas: P 1 = 170 kPa y P 2 es desconocido. V 1 = 30,000 cm 3 y V 2 = 32.000 cm 3. T 1 = 16 ° C y T 2 = 40 ° C.
Paso 2. Convertir los valores conocidos a unidades SI si es necesario: Aquí, la temperatura debe convertirse en Kelvin. Por lo tanto, T 1 = 16 + 273 = 289 K, T 2 = 40 + 273 = 313 K
Paso 3. Elija una ecuación de ley de gas relevante que le permita calcular la variable desconocida: Podemos usar la ecuación general de gas para resolver este problema:\(\mathrm{\frac{P_1V_1}{T_1}=\frac{P_2V_2}{T_2}}\).
Por lo tanto,\(\mathrm{P_2= \frac{P_1 \times V_1 \times T_2}{ T_1 \times V_2}}\).
Paso 4. Sustituir los valores conocidos en la ecuación. Calcular la variable desconocida:
\[\mathrm{P_2=\dfrac{170 \times 30,000 \times 313}{289 \times 32,000}=173 \; kPa}\]
La presión de la llanta al final del recorrido es de 173 kPa.
Tenga en cuenta que en el Paso 2 no nos molestamos en convertir los valores de volumen a m 3. En el Paso 4, la presión aparece tanto en el numerador como en el denominador. En este caso la conversión no fue necesaria.
Número de Avogador
El número de moléculas en un mol se denomina número de Avogadro (N A) —definido como 6.02x 10 23 mol -1.
objetivos de aprendizaje
- Explicar la relación entre el número de Avogadro y el topo.
Al medir la cantidad de sustancia, a veces es más fácil trabajar con una unidad que no sea el número de moléculas. Un mol (mol abreviado) es una unidad base en el Sistema Internacional de Unidades (SI). Se define como cualquier sustancia que contenga tantos átomos o moléculas como haya en exactamente 12 gramos (0.012 kg) de carbono-12. El número real de átomos o moléculas en un mol se llama constante de Avogadro (N A), en reconocimiento del científico italiano Amedeo Avogadro.

Amadeo Avogadro: Amedeo Avogadro (1776—1856). Estableció la relación entre las masas del mismo volumen de diferentes gases (a la misma temperatura y presión) corresponde a la relación entre sus respectivos pesos moleculares.
El número de Avogadro (N) se refiere al número de moléculas en una gramo-molécula de oxígeno. Esto indica una cantidad de sustancia en contraposición a una dimensión de medición independiente. En 1811 Amedeo Avogadro propuso por primera vez que el volumen de un gas (a una presión y temperatura dadas) es proporcional al número de átomos o moléculas, independientemente de la naturaleza del gas (es decir, este número es universal e independiente del tipo de gas). En 1926, Jean Perrin ganó el Premio Nobel de Física, en gran parte por su trabajo en la determinación de la constante Avogadro (por varios métodos diferentes). Se ha encontrado que el valor de la constante de Avogadro, N A, es igual a 6.02×10 23 mol −1.
Papel en la ciencia
La constante de Avogadro es un factor de escala entre observaciones macroscópicas y microscópicas (escala atómica) de la naturaleza. Como tal, proporciona la relación entre otras constantes físicas y propiedades. Por ejemplo, establece una relación entre la constante de gas R y la constante de Boltzmann k,
\[\mathrm{R=kN_A=8.314472(15) J \; mol^{−1}K^{−1};}\]
y la constante de Faraday F y la carga elemental e,
\[\mathrm{F=N_Ae=96485.3383(83) C \; mol^{−1}.}\]
Medición N A
La determinación de N A es crucial para el cálculo de la masa de un átomo, ya que este último se obtiene dividiendo la masa de un mol del gas por la constante de Avogadro. En su estudio sobre el movimiento browniano en 1905, Albert Einstein propuso que esta constante pudiera determinarse a partir de las cantidades observables en el movimiento browniano. Posteriormente, se verificó la idea de Einstein, lo que llevó a la primera determinación de N A en 1908 a través del trabajo experimental de Jean Baptiste Perrin.
Temperatura Absoluta
La temperatura absoluta es la unidad de temperatura termodinámica más commoly utilizada y es la unidad estándar de temperatura.
objetivos de aprendizaje
- Describir la relación entre la temperatura absoluta y la energía cinética.
La temperatura termodinámica es la medida absoluta de la temperatura. Es uno de los principales parámetros de la termodinámica y la teoría cinética de los gases. La temperatura termodinámica es una escala “absoluta” porque es la medida de la propiedad fundamental subyacente a la temperatura: su punto nulo o cero (“cero absoluto”) es la temperatura a la que los constituyentes de las partículas de la materia tienen un movimiento mínimo y no pueden llegar a ser más fríos. Es decir, tienen un movimiento mínimo, reteniendo solo el movimiento mecánico cuántico, como se diagramó en.
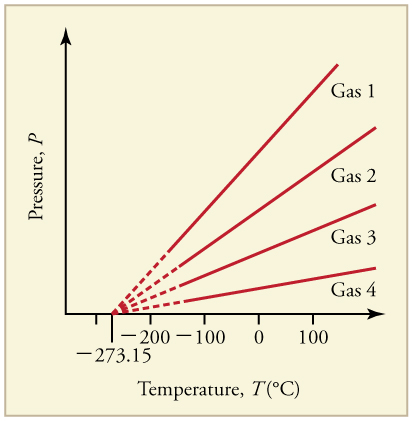
Gráfica de Presión Versus Temperatura: Gráfica de presión versus temperatura para diversos gases mantenidos a un volumen constante. Tenga en cuenta que todas las gráficas extrapolan a presión cero a la misma temperatura
En su forma más simple, la “temperatura” surge de la energía cinética de los movimientos aleatorios de los constituyentes de las partículas de la materia tales como moléculas o átomos, como se ve en. Por lo tanto, es razonable elegir el cero absoluto, donde cesa todo movimiento clásico, como punto de referencia (T=0) de nuestro sistema de temperatura. Mediante el uso de la escala de temperatura absoluta (sistema Kelvin), que es la temperatura termodinámica más utilizada, hemos demostrado que la energía cinética traslacional promedio (KE) de una partícula en un gas tiene una relación simple con la temperatura:
Movimiento Traslacional del Helio: Los gases reales no siempre se comportan de acuerdo con el modelo ideal bajo ciertas condiciones, como la alta presión. Aquí, el tamaño de los átomos de helio en relación con su espaciamiento se muestra a escala bajo 1950 atmósferas de presión.
\[\mathrm{\bar{KE}=\dfrac{3}{2}kT.}\]
Tenga en cuenta que esta ecuación no se vería tan elegante si en su lugar se usara la escala Fahrenheit.
La escala Kelvin
El kelvin (o “temperatura absoluta”) es la unidad de temperatura termodinámica estándar. Es una de las siete unidades base en el Sistema Internacional de Unidades (SI) y se le asigna el símbolo de unidad K. Por acuerdo internacional, la unidad kelvin y su escala se definen por dos puntos: cero absoluto y el punto triple de Viena Standard Mean Ocean Water (agua con una mezcla especificada de hidrógeno y isótopos de oxígeno). El cero absoluto, la temperatura más baja posible, se define precisamente como 0 K y −273.15 °C. El punto triple del agua se define precisamente como 273.16 K y 0.01 °C.
Puntos Clave
- La ley de gas ideal se derivó empíricamente combinando la ley de Boyle y la ley de Charles.
- Aunque la derivación empírica de la ecuación no considera detalles microscópicos, la ley del gas ideal puede derivarse de los primeros principios de la termodinámica clásica.
- La presión y el volumen de un gas pueden estar relacionados con la velocidad promedio de las moléculas:\(\mathrm{PV=\frac{1}{3}Nm\bar{v^2}.}\)
- Los procesos isotérmicos suelen ocurrir cuando un sistema está en contacto con un depósito térmico exterior (baño de calor), y el cambio ocurre lo suficientemente lento como para permitir que el sistema se ajuste continuamente a la temperatura del depósito a través del intercambio de calor.
- Para un gas ideal, desde la ley de gas ideal\(\mathrm{PV = NkT, PV}\) permanece constante a través de un proceso isotérmico. Una curva en un diagrama P-V generada por la ecuación\(\mathrm{PV = const}\) se llama isoterma.
- Para un proceso isotérmico reversible, el trabajo realizado por el gas es igual al área bajo la isoterma de presión-volumen relevante. Se da como\(\mathrm{W_A \rightarrow B=NkT \ln \frac{V_B}{V_A}}\).
- Los gases pueden expandirse o contraerse bajo cierta restricción. Dependiendo de la restricción, el estado final del gas puede cambiar.
- El calor transferido al sistema sí funciona pero también cambia la energía interna del sistema. En un proceso isobárico para un gas monatómico, el calor y el cambio de temperatura satisfacen la siguiente ecuación:\(\mathrm{Q=\frac{5}{2}NkΔT}\).
- Para un gas ideal monatómico, el calor específico a presión constante es\(\mathrm{\frac{5}{2}R}\).
- Anote toda la información que conozca sobre el gas y convierta los valores conocidos a unidades SI si es necesario.
- Elija una ecuación de ley de gas relevante que le permita calcular la variable desconocida, y sustituir los valores conocidos en la ecuación. Después, calcula la variable desconocida.
- La ecuación general del gas sólo se aplica si la cantidad molar del gas es fija.
- Avogadro planteó la hipótesis de que volúmenes iguales de gas, a la misma presión y temperatura, contienen igual número de moléculas, independientemente del tipo de gas.
- La constante de Avogadro es un factor de escala entre observaciones macroscópicas y microscópicas (escala atómica) de la naturaleza. Proporciona la relación entre otras constantes físicas y propiedades.
- Albert Einstein propuso que el número de Avogadro podría determinarse en base a las cantidades observables en movimiento browniano. El NA fue medido por primera vez por Jean Baptiste Perrin en 1908.
- La temperatura surge de la energía cinética de los movimientos aleatorios de los constituyentes de las partículas de la materia, como moléculas o átomos. Por lo tanto, es razonable elegir el cero absoluto, donde cesa todo movimiento clásico, como punto de referencia.
- Por acuerdo internacional, la unidad kelvin y su escala se definen por dos puntos: cero absoluto y el punto triple del agua estandarizada.
- En cero absoluto, los constituyentes de partículas de la materia tienen un movimiento mínimo y no pueden llegar a ser más fríos. Retienen un movimiento mecánico cuántico mínimo.
Términos Clave
- mole: En el Sistema Internacional de Unidades, la unidad base de cantidad de sustancia; la cantidad de sustancia de un sistema que contiene tantas entidades elementales como átomos haya en 12 g de carbono-12. Símbolo: mol.
- gas ideal: Un gas hipotético cuyas moléculas no exhiben interacción y experimentan colisión elástica entre sí y con las paredes del contenedor.
- Número de Avogadro: el número de partículas constituyentes (generalmente átomos o moléculas) en un mol de una sustancia dada. Tiene dimensiones de mol recíproco y su valor es igual a 6.02214129·1023 mol-1
- adiabático: Ocurre sin ganancia o pérdida de calor.
- energía interna: La suma de toda la energía presente en el sistema, incluyendo la energía cinética y potencial; equivalentemente, la energía necesaria para crear un sistema, excluyendo la energía necesaria para desplazar su entorno.
- la primera ley de la termodinámica: Una versión de la ley de conservación de energía: el cambio en la energía interna de un sistema cerrado es igual a la cantidad de calor suministrado al sistema, menos la cantidad de trabajo realizado por el sistema en su entorno.
- calor específico: La relación entre la cantidad de calor necesaria para elevar la temperatura de una masa unitaria de sustancia en un grado unitario a la cantidad de calor necesaria para elevar la de la misma masa de agua en la misma cantidad.
- Unidades SI: Sistema Internacional de Unidades (abreviado SI del francés: Le Système international d'unités). Es la forma moderna del sistema métrico.
- constante de gas: Una constante universal, R, que aparece en la ley del gas ideal, (PV = nRT), derivada de dos constantes fundamentales, la constante de Boltzman y el número de Avogadro, (R = NaK).
- Constante de Faraday: La magnitud de la carga eléctrica por mol de electrones.
- Movimiento browniano: Movimiento aleatorio de partículas suspendidas en un fluido, que surge de que esas partículas son golpeadas por moléculas individuales del fluido.
- cero absoluto: La temperatura más fría posible: cero en la escala Kelvin y aproximadamente -273.15°C y -459.67°F La ausencia total de calor; la temperatura a la que cesaría el movimiento de todas las moléculas.
- Sistema Internacional de Unidades: (SI): El conjunto estándar de unidades básicas de medida utilizadas en la literatura científica a nivel mundial.
- Viena Standard Mean Ocean Water: Un estándar que define una composición isotópica estandarizada del agua.
LICENCIAS Y ATRIBUCIONES
CONTENIDO CON LICENCIA CC, COMPARTIDO PREVIAMENTE
- Curación y Revisión. Proporcionado por: Boundless.com. Licencia: CC BY-SA: Atribución-CompartirIgual
CC CONTENIDO LICENCIADO, ATRIBUCIÓN ESPECÍFICA
- gas ideal. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/ideal_gas. Licencia: CC BY-SA: Atribución-CompartirIgual
- Ley de gas ideal. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/ideal_gas_law%23Empírico. Licencia: CC BY-SA: Atribución-CompartirIgual
- Número de Avogadro. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Avogadro's%20number. Licencia: CC BY-SA: Atribución-CompartirIgual
- mole. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/mole. Licencia: CC BY-SA: Atribución-CompartirIgual
- Colegio OpenStax, La Ley Ideal del Gas. 4 de febrero de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42216/latest/. Licencia: CC BY: Atribución
- gas ideal. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/ideal_gas. Licencia: CC BY-SA: Atribución-CompartirIgual
- Proceso isotérmico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Isothermal_process. Licencia: CC BY-SA: Atribución-CompartirIgual
- Sin límites. Proporcionado por: Boundless Learning. Ubicado en: www.boundless.com//fisics/definición/internal-energy. Licencia: CC BY-SA: Atribución-CompartirIgual
- adiabático. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/adiabatic. Licencia: CC BY-SA: Atribución-CompartirIgual
- Colegio OpenStax, La Ley Ideal del Gas. 4 de febrero de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42216/latest/. Licencia: CC BY: Atribución
- Proceso isotérmico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Isothermal_process. Licencia: CC BY: Atribución
- Proceso isotérmico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Isothermal_process. Licencia: CC BY: Atribución
- Colegio OpenStax, La Primera Ley de la Termodinámica y Algunos Procesos Simples. 17 de septiembre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42233/latest/. Licencia: CC BY: Atribución
- Proceso isobárico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Isobaric_Process. Licencia: CC BY-SA: Atribución-CompartirIgual
- la primera ley de la termodinámica. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/la%20primera%20ley%20de%20Termodinámica. Licencia: CC BY-SA: Atribución-CompartirIgual
- calor específico. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/specific_heat. Licencia: CC BY-SA: Atribución-CompartirIgual
- Colegio OpenStax, La Ley Ideal del Gas. 4 de febrero de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42216/latest/. Licencia: CC BY: Atribución
- Proceso isotérmico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Isothermal_process. Licencia: CC BY: Atribución
- Proceso isotérmico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Isothermal_process. Licencia: CC BY: Atribución
- Colegio OpenStax, La Primera Ley de la Termodinámica y Algunos Procesos Simples. 5 de febrero de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42233/latest/. Licencia: CC BY: Atribución
- gas ideal. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/ideal_gas. Licencia: CC BY-SA: Atribución-CompartirIgual
- Ley de gas ideal. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/ideal_gas_law. Licencia: CC BY-SA: Atribución-CompartirIgual
- Proyecto Libre de Textos de Ciencias de Preparatoria, Propiedades Térmicas y Gases Ideales: Ley de Gas Ideal y Ecuación General de Gas 17 de septiembre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m39086/latest/. Licencia: CC BY: Atribución
- Sin límites. Proporcionado por: Boundless Learning. Ubicada en: www.boundless.com//physics/si-units. Licencia: CC BY-SA: Atribución-CompartirIgual
- Colegio OpenStax, La Ley Ideal del Gas. 4 de febrero de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42216/latest/. Licencia: CC BY: Atribución
- Proceso isotérmico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Isothermal_process. Licencia: CC BY: Atribución
- Proceso isotérmico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Isothermal_process. Licencia: CC BY: Atribución
- Colegio OpenStax, La Primera Ley de la Termodinámica y Algunos Procesos Simples. 5 de febrero de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42233/latest/. Licencia: CC BY: Atribución
- Llanta. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Tire. Licencia: CC BY: Atribución
- Movimiento browniano. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/Brownian_motion. Licencia: CC BY-SA: Atribución-CompartirIgual
- Constante de Avogadro. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Avogadro_Constant%23Medición. Licencia: CC BY-SA: Atribución-CompartirIgual
- Movimiento browniano. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Brownian_motion. Licencia: CC BY-SA: Atribución-CompartirIgual
- Colegio OpenStax, La Ley Ideal del Gas. 17 de septiembre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42216/latest/. Licencia: CC BY: Atribución
- Constante de Faraday. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Faraday%20Constant. Licencia: CC BY-SA: Atribución-CompartirIgual
- constante de gas. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/gas_constant. Licencia: CC BY-SA: Atribución-CompartirIgual
- Colegio OpenStax, La Ley Ideal del Gas. 4 de febrero de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42216/latest/. Licencia: CC BY: Atribución
- Proceso isotérmico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Isothermal_process. Licencia: CC BY: Atribución
- Proceso isotérmico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Isothermal_process. Licencia: CC BY: Atribución
- Colegio OpenStax, La Primera Ley de la Termodinámica y Algunos Procesos Simples. 5 de febrero de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42233/latest/. Licencia: CC BY: Atribución
- Llanta. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Tire. Licencia: CC BY: Atribución
- Avogadro Amedeo. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Archivo:Avogadro_amedeo.jpg. Licencia: CC BY-SA: Atribución-CompartirIgual
- cero absoluto. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/absolute_zero. Licencia: CC BY-SA: Atribución-CompartirIgual
- Temperatura termodinámica. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Thermodynamic_temperature. Licencia: CC BY-SA: Atribución-CompartirIgual
- Sistema Internacional de Unidades. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Internacional%20Sistema%20de%20Unidades. Licencia: CC BY-SA: Atribución-CompartirIgual
- Viena Standard Mean Ocean Water. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/Vienna_Standard_Mean_Ocean_Water. Licencia: CC BY-SA: Atribución-CompartirIgual
- Colegio OpenStax, La Ley Ideal del Gas. 4 de febrero de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42216/latest/. Licencia: CC BY: Atribución
- Proceso isotérmico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Isothermal_process. Licencia: CC BY: Atribución
- Proceso isotérmico. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Isothermal_process. Licencia: CC BY: Atribución
- Colegio OpenStax, La Primera Ley de la Termodinámica y Algunos Procesos Simples. 5 de febrero de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42233/latest/. Licencia: CC BY: Atribución
- Llanta. Proporcionado por: Wikipedia. Ubicado en: http://en.Wikipedia.org/wiki/Tire. Licencia: CC BY: Atribución
- Avogadro Amedeo. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Archivo:Avogadro_amedeo.jpg. Licencia: CC BY-SA: Atribución-CompartirIgual
- Colegio OpenStax, Temperatura. 28 de abril de 2014. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42214/latest/. Licencia: CC BY: Atribución
- Teoría cinética. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Kinetic_Theory. Licencia: Dominio Público: No Conocido Derechos de Autor


