10.6: Espectroscopia fotoluminiscente
- Page ID
- 75927
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)La fotoluminiscencia se divide en dos categorías: fluorescencia y fosforescencia. Un par de electrones que ocupan el mismo estado básico electrónico tienen espines opuestos y están en un estado de giro singlete (Figura 10.6.1 a).
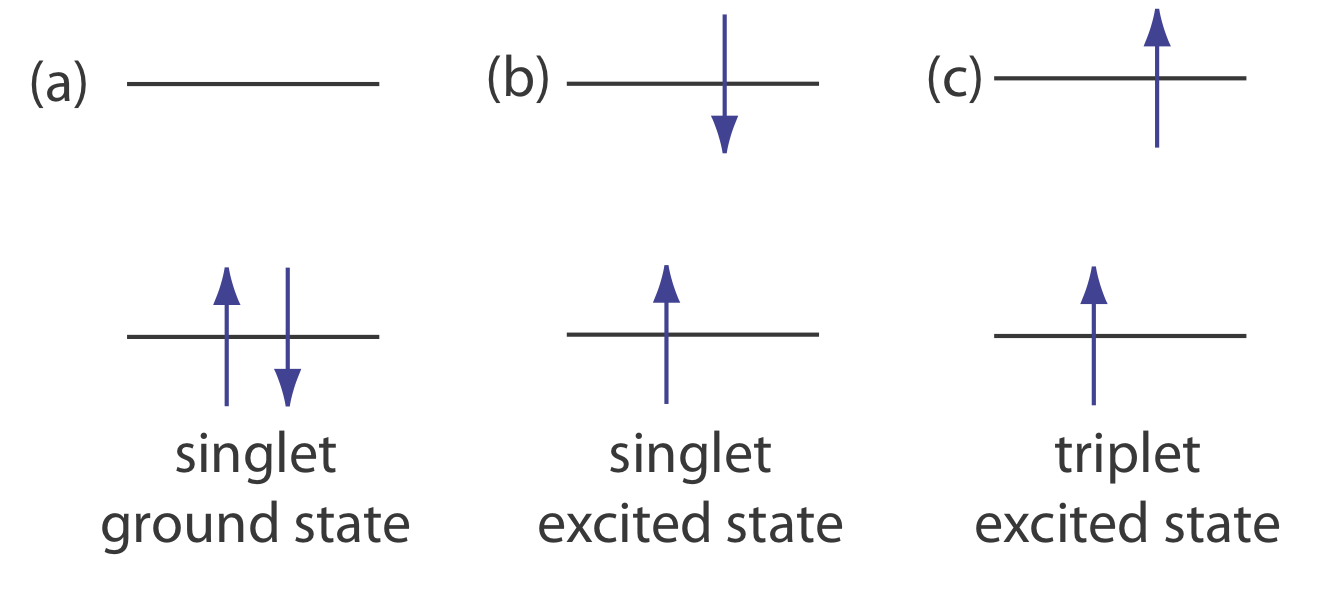
Cuando un analito absorbe un ultravioleta o un fotón visible, uno de sus electrones de valencia se mueve del estado fundamental a un estado excitado con una conservación del espín del electrón (Figura 10.6.1 b). La emisión de un fotón desde un estado excitado singlete al estado de tierra singlete, o entre dos niveles de energía cualesquiera con la misma espina, se llama fluorescencia. La probabilidad de fluorescencia es muy alta y la vida media de un electrón en estado excitado es de solo 10 —5 —10 —8 s. La fluorescencia, por lo tanto, decae rápidamente una vez que se elimina la fuente de excitación.
En algunos casos, un electrón en un estado excitado singlete se transforma a un estado excitado de triplete (Figura 10.6.1 c) en el que su giro ya no está emparejado con el estado fundamental. La emisión entre un estado excitado de triplete y un estado de tierra singlete, o entre dos niveles de energía que difieren en sus respectivos estados de espín, se llama fosforescencia. Debido a que la vida media de la fosforescencia varía de 10 —4 —10 4 s, la fosforescencia puede continuar por algún tiempo después de eliminar la fuente de excitación.
El uso de fluorescencia molecular para análisis cualitativos y semicuantitativos data de principios a mediados del siglo XIX, con métodos cuantitativos más precisos que aparecen en la década de 1920. La instrumentación para espectroscopía de fluorescencia usando un filtro o un monocromador para la selección de longitud de onda apareció, respectivamente, en los años 1930 y 1950. Aunque el descubrimiento de la fosforescencia precedió al de la fluorescencia por casi 200 años, las aplicaciones cualitativas y cuantitativas de la fosforescencia molecular no recibieron mucha atención hasta después del desarrollo de la instrumentación de fluorescencia.
Como cabría esperar, la persistencia de la fosforescencia de larga duración la hizo más notoria.
Espectros de fluorescencia y fosforescencia
Para apreciar el origen de la fluorescencia y fosforescencia debemos considerar qué le sucede a una molécula tras la absorción de un fotón. Supongamos que la molécula inicialmente ocupa el nivel de energía vibracional más bajo de su estado básico electrónico, que es el estado singlete etiquetado S 0 en la Figura 10.6.2 . La absorción de un fotón excita la molécula a uno de varios niveles de energía vibracional en el primer estado electrónico excitado, S1, o el segundo estado excitado electrónico, S2, ambos de los cuales son estados singlete. La relajación al estado fundamental se produce por una serie de mecanismos, algunos de los cuales dan como resultado la emisión de un fotón y otros que ocurren sin la emisión de un fotón. Estos mecanismos de relajación se muestran en la Figura 10.6.2 . La vía de relajación más probable de cualquier estado excitado es la que tiene la vida más corta.

Desactivación sin radiación
Cuando una molécula se relaja sin emitir un fotón llamamos desactivación sin radiación al proceso. Un ejemplo de desactivación sin radiación es la relajación vibracional, en la que una molécula en un nivel de energía vibracional excitada pierde energía al moverse a un nivel de energía vibracional más bajo en el mismo estado electrónico. La relajación vibracional es muy rápida, con una vida útil promedio de <10 —12 s. Debido a que la relajación vibracional es tan eficiente, una molécula en uno de los niveles de energía vibratoria más altos de su estado excitado regresa rápidamente al nivel de energía vibracional más bajo del estado excitado.
Otra forma de desactivación sin radiación es una conversión interna en la que una molécula en el nivel vibratorio del suelo de un estado excitado pasa directamente a un nivel de energía vibracional más alto de un estado electrónico de menor energía del mismo estado de giro. Mediante una combinación de conversiones internas y relajaciones vibracionales, una molécula en un estado electrónico excitado puede regresar al estado electrónico básico sin emitir un fotón. Una forma relacionada de desactivación sin radiación es una conversión externa en la que el exceso de energía se transfiere al disolvente o a otro componente de la matriz de la muestra.
Usemos la Figura 10.6.2 para ilustrar cómo una molécula puede relajarse de nuevo a su estado fundamental sin emitir un fotón. Supongamos que nuestra molécula se encuentra en el nivel de energía vibracional más alto del segundo estado excitado electrónico. Después de que una serie de relajaciones vibracionales lleva a la molécula al nivel de energía vibracional más bajo de S2, sufre una conversión interna en un nivel de energía vibracional más alto del primer estado electrónico excitado. Las relajaciones vibracionales llevan a la molécula al nivel de energía vibracional más bajo de S1. Después de una conversión interna en un nivel de energía vibracional más alto del estado fundamental, la molécula continúa experimentando relajación vibracional hasta alcanzar el nivel de energía vibracional más bajo de S 0.
Una forma final de desactivación sin radiación es un cruce entre sistemas en el que una molécula en el nivel de energía vibratoria terrestre de un estado electrónico excitado pasa a uno de los niveles de energía vibratoria más altos de un estado electrónico de energía más baja con un estado de giro diferente. Por ejemplo, se muestra un cruce entre sistemas en la Figura 10.6.2 entre el estado excitado singlete S1 y el estado excitado triplete T1.
Relajación por fluorescencia
La fluorescencia ocurre cuando una molécula en el nivel de energía vibracional más bajo de un estado excitado regresa a un estado electrónico de menor energía al emitir un fotón. Debido a que las moléculas regresan a su estado fundamental por el mecanismo más rápido, la fluorescencia se observa solo si es un medio de relajación más eficiente que una combinación de conversiones internas y relajaciones vibracionales.
Una expresión cuantitativa de la eficiencia de fluorescencia es el rendimiento cuántico fluorescente\(\Phi_f\), que es la fracción de moléculas en estado excitado que regresan al estado fundamental por fluorescencia. Los rendimientos cuánticos fluorescentes varían de 1 cuando cada molécula en estado excitado experimenta fluorescencia, a 0 cuando no ocurre fluorescencia.
La intensidad de fluorescencia, I f, es proporcional a la cantidad de radiación absorbida por la muestra, P 0 — P T, y el rendimiento cuántico fluorescente
\[I_{f}=k \Phi_{f}\left(P_{0}-P_{\mathrm{T}}\right) \label{10.1}\]
donde k es una constante que da cuenta de la eficiencia de recolección y detección de la emisión fluorescente. De la ley de Beer sabemos que
\[\frac{P_{\mathrm{T}}}{P_{0}}=10^{-\varepsilon b C} \label{10.2}\]
donde C es la concentración de las especies fluorescentes. Resolviendo la ecuación\ ref {10.2} para P T y sustituyendo en la ecuación\ ref {10.1} da, después de simplificar
\[I_{f}=k \Phi_{f} P_{0}\left(1-10^{-\varepsilon b C}\right) \label{10.3}\]
Cuando\(\varepsilon bC\) < 0.01, que a menudo es el caso cuando la concentración del analito es pequeña, la Ecuación\ ref {10.3} simplifica a
\[I_{f}=2.303 k \Phi_{f} \varepsilon b C P_{0}=k^{\prime} P_{0} \label{10.4}\]
donde k ′ es una colección de constantes. La intensidad de la fluorescencia, por lo tanto, aumenta con un incremento en la eficiencia cuántica, la potencia incidente de la fuente, y la absortividad molar y la concentración de las especies fluorescentes.
La fluorescencia generalmente se observa cuando la absorción de energía más baja de la molécula es una\(\pi \rightarrow \pi^*\) transición, aunque algunas\(n \rightarrow \pi^*\) transiciones muestran fluorescencia débil. Muchos compuestos aromáticos no heterocíclicos no substituidos tienen un rendimiento cuántico de fluorescencia favorable, aunque las sustituciones en el anillo aromático pueden afectar\(\Phi_f\) significativamente. Por ejemplo, la presencia de un grupo aceptor de electrones, como —NO 2, disminuye\(\Phi_f\), mientras que la adición de un grupo donador de electrones, como —OH, aumenta\(\Phi_f\). La fluorrescencia también aumenta para sistemas de anillos aromáticos y para moléculas aromáticas con estructuras planas rígidas. La Figura 10.6.3 muestra la fluorescencia de quinina bajo una lámpara UV.

El rendimiento cuántico fluorescente de una molécula también está influenciado por variables externas, como la temperatura y el disolvente. El aumento de la temperatura generalmente disminuye\(\Phi_f\) debido a que las colisiones más frecuentes entre la molécula y el disolvente aumentan la conversión externa. La disminución de la viscosidad del disolvente disminuye\(\Phi_f\) por razones similares. Para un analito con grupos funcionales ácidos o básicos, un cambio en el pH puede cambiar la estructura del analito y sus propiedades fluorescentes.
Como se muestra en la Figura 10.6.2 , la fluorescencia puede devolver la molécula a cualquiera de varios niveles de energía vibracional en el estado electrónico básico. La fluorescencia, por lo tanto, ocurre en un rango de longitudes de onda. Debido a que el cambio en la energía para la emisión fluorescente generalmente es menor que el de la absorción, el espectro de fluorescencia de una molécula se desplaza a longitudes de onda más altas que su espectro de absorción.
Relajación por Fosforescencia
Una molécula en el nivel de energía vibracional más bajo de un estado excitado electrónico triplete normalmente se relaja al estado fundamental por un cruce entre sistemas a un estado singlete o por una conversión externa. La fosforescencia ocurre cuando la molécula se relaja emitiendo un fotón. Como se muestra en la Figura 10.6.2 , la fosforescencia ocurre en un rango de longitudes de onda, todas las cuales están a energías más bajas que la banda de absorción de la molécula. La intensidad de la fosforescencia,\(I_p\), viene dada por una ecuación similar a la Ecuación\ ref {10.4} para fluorescencia
donde\(\Phi_p\) está el rendimiento cuántico fosforescente.
La fosforescencia es más favorable para las moléculas con\(n \rightarrow \pi^*\) transiciones, que tienen una mayor probabilidad de un cruce entre sistemas que\(\pi \rightarrow \pi^*\) las transiciones. Por ejemplo, se observa fosforescencia con moléculas aromáticas que contienen grupos carbonilo o heteroátomos. Los compuestos aromáticos que contienen átomos de haluro también tienen una mayor eficiencia para la fosforescencia. En general, un incremento en la fosforescencia corresponde a una disminución de la fluorescencia.
Debido a que la vida media de la fosforescencia puede ser bastante larga, oscilando entre 10 —4 —10 4 s, el rendimiento cuántico fosforescente suele ser bastante pequeño. Se\(\Phi_p\) logra una mejora al disminuir la eficiencia de la conversión externa. Esto se logra de varias maneras, incluyendo bajar la temperatura, usar un disolvente más viscoso, depositar la muestra sobre un sustrato sólido o atrapando la molécula en solución. La Figura 10.6.4 muestra un ejemplo de fosforescencia.

Espectros de excitación versus emisión
Los espectros de fotoluminiscencia se registran midiendo la intensidad de la radiación emitida en función de la longitud de onda de excitación o de la longitud de onda de emisión. Se obtiene un espectro de excitación monitorizando la emisión a una longitud de onda fija mientras se varía la longitud de onda de excitación. Cuando se corrige por variaciones en la intensidad de la fuente y la respuesta del detector, el espectro de excitación de una muestra es casi idéntico a su espectro de absorbancia. El espectro de excitación proporciona un medio conveniente para seleccionar la mejor longitud de onda de excitación para un análisis cuantitativo o cualitativo.
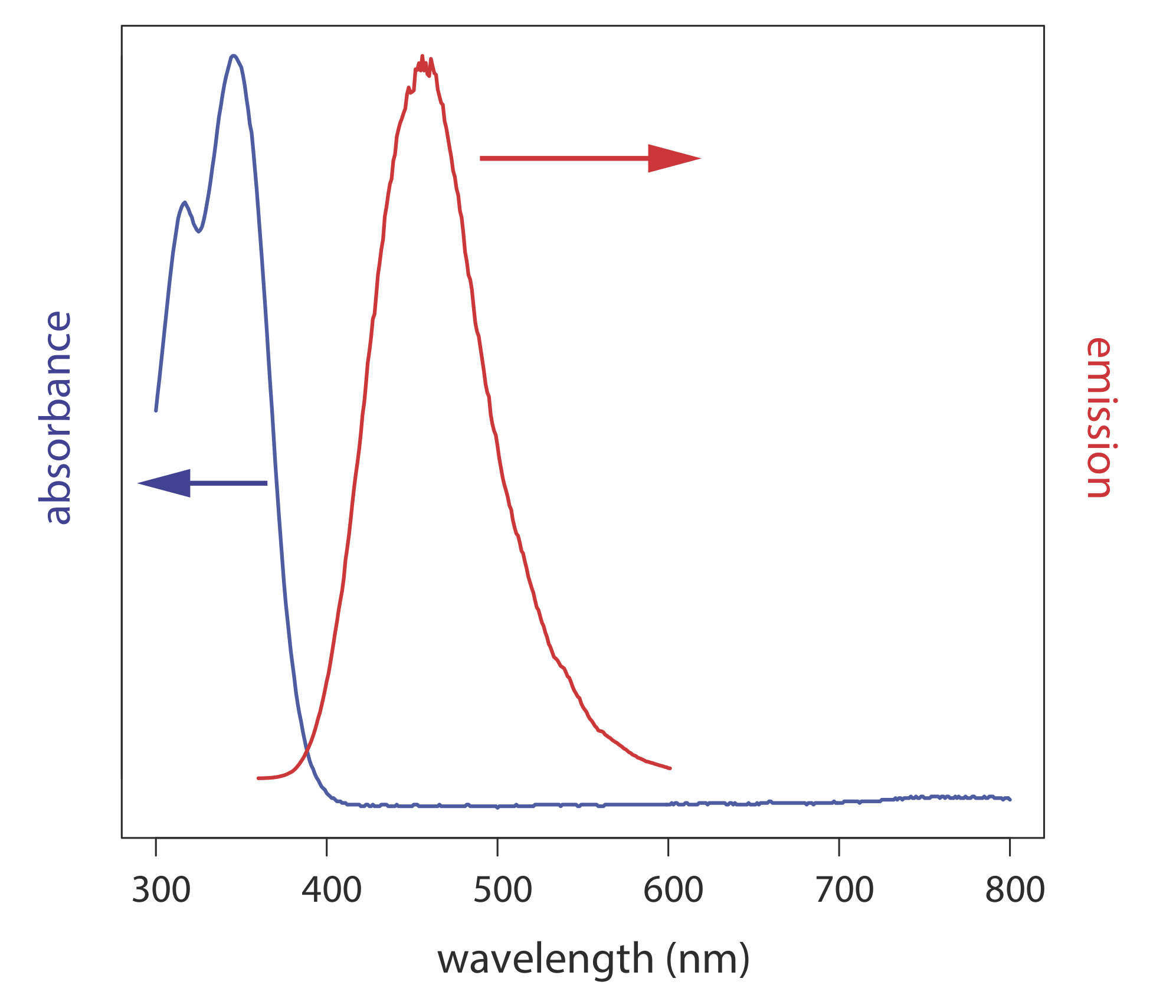
En un espectro de emisión se utiliza una longitud de onda fija para excitar la muestra y se monitorea la intensidad de la radiación emitida en función de la longitud de onda. Aunque una molécula tiene un único espectro de excitación, tiene dos espectros de emisión, uno para fluorescencia y otro para fosforescencia. La Figura 10.6.5 muestra el espectro de absorción UV y el espectro de emisión de fluorescencia UV para quinina.
Instrumentación
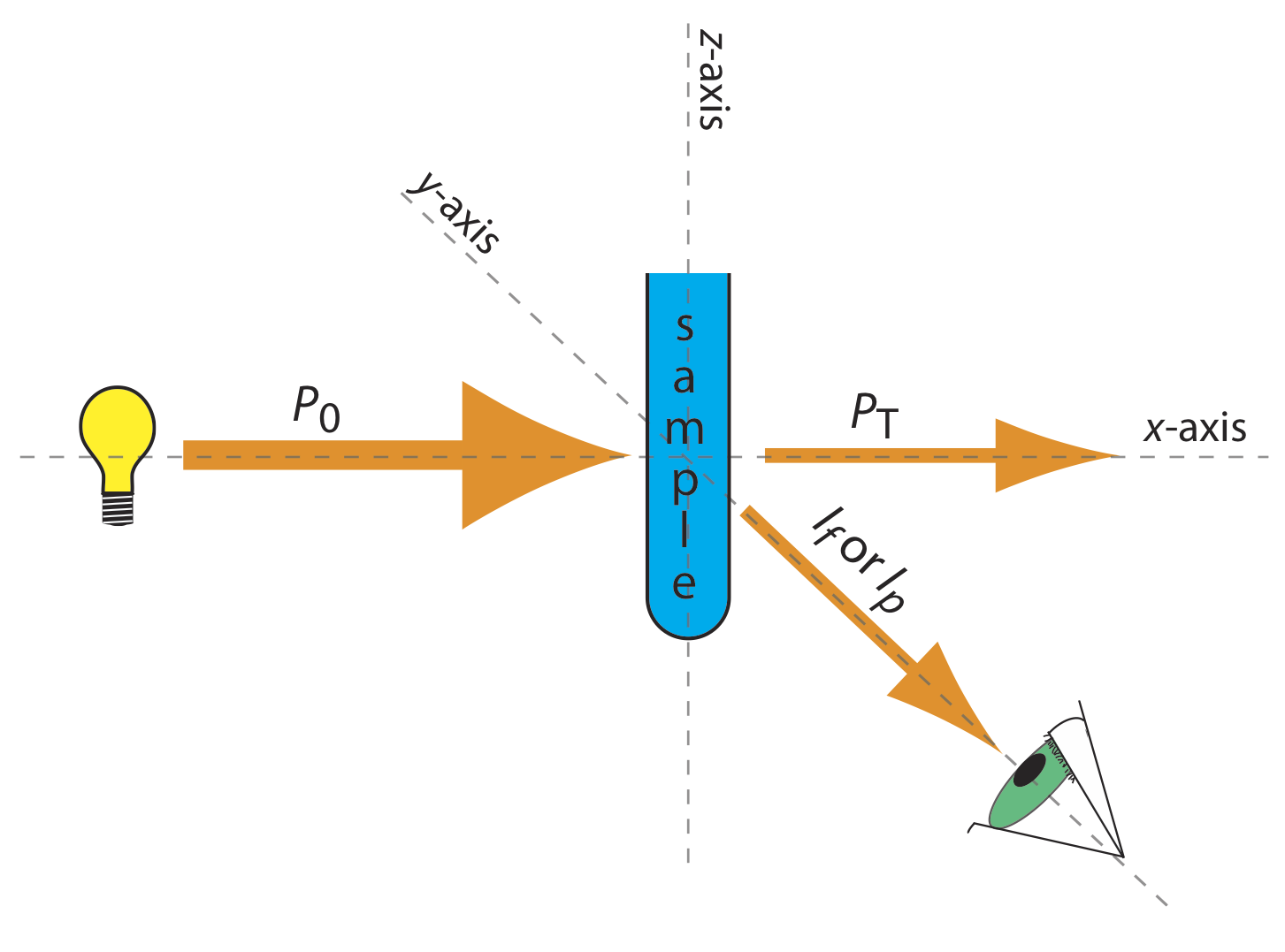
La instrumentación básica para monitorear la fluorescencia y la fosforescencia, una fuente de radiación, un medio para seleccionar una banda estrecha de radiación y un detector, son las mismas que las de la espectroscopia de absorción. Las demandas únicas de fluorescencia y fosforescencia, sin embargo, requieren algunas modificaciones en los diseños de instrumentos vistos anteriormente en la Figura 10.3.1 (fotómetro de filtro), Figura 10.3.2 (espectrofotómetro de un solo haz), Figura 10.3.3 (espectrofotómetro de doble haz) y Figura 10.3.4 (espectrómetro de matriz de diodos). La diferencia más importante es que el detector no se puede colocar directamente frente a la fuente. La figura 10.6.6 muestra por qué este es el caso. Si colocamos el detector a lo largo del eje de la fuente, recibe tanto la radiación de fuente transmitida, P T, como la radiación fluorescente, I f, o fosforescente, I p, radiación. En cambio, rotamos al director y lo colocamos a 90 o a la fuente.
Instrumentos para Medición de Fluorescencia
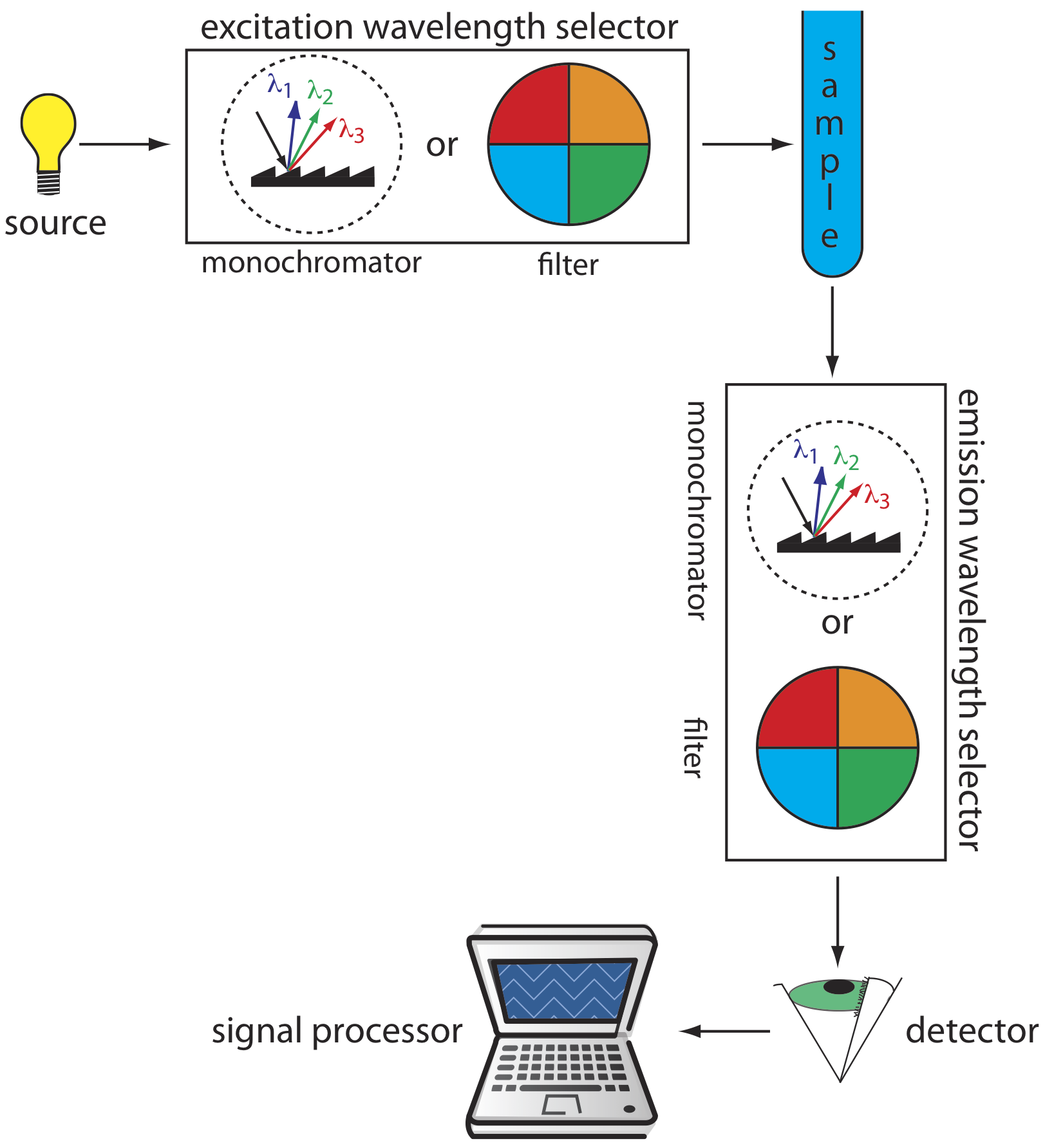
La Figura 10.6.7 muestra el diseño básico de un instrumento para medir la fluorescencia, que incluye dos selectores de longitud de onda, uno para seleccionar la longitud de onda de excitación de la fuente y otro para seleccionar la longitud de onda de emisión del analito. En un fluorímetro las longitudes de onda de excitación y emisión se seleccionan usando filtros de absorción o interferencia. La fuente de excitación para un fluorímetro suele ser una lámpara de vapor de Hg de baja presión que proporciona líneas de emisión intensas distribuidas por toda la región ultravioleta y visible. Cuando se utiliza un monocromador para seleccionar las longitudes de onda de excitación y emisión, el instrumento se denomina espectrofluorómetro. Con un monocromador la fuente de excitación suele ser una lámpara de arco Xe de alta presión, que tiene un espectro de emisión continua. Cualquiera de los dos diseños instrumentales es apropiado para el trabajo cuantitativo, aunque solo un espectrofluorómetro puede registrar un espectro de excitación o emisión.
Una lámpara de vapor de Hg tiene líneas de emisión a 254, 312, 365, 405, 436, 546, 577, 691 y 773 nm.
Las células de muestra para fluorescencia molecular son similares a las de absorción molecular (ver Figura 10.3.6). La teledetección usando una sonda de fibra óptica (ver Figura 10.3.7) es posible usar con un fluorímetro o espectrofluorómetro. Un analito que es fluorescente es monitoreado directamente. Para un analito que no es fluorescente, se incorpora una molécula sonda fluorescente adecuada en la punta de la sonda de fibra óptica. La reacción del analito con la molécula sonda conduce a un aumento o disminución de la fluorescencia.
Instrumentos para la Medición de Fosforescencia
Un instrumento para la fosforescencia molecular debe discriminar entre fosforescencia y fluorescencia. Debido a que la vida útil de la fluorescencia es más corta que la de la fosforescencia, la discriminación se logra incorporando un retraso entre la excitación de la muestra y la medición de la emisión fosforescente. La Figura 10.6.8 muestra cómo dos choppers fuera de fase nos permiten bloquear la emisión fluorescente para que no llegue al detector cuando la muestra está siendo excitada y evitar que la radiación fuente cause fluorescencia cuando estamos midiendo la emisión fosforescente.
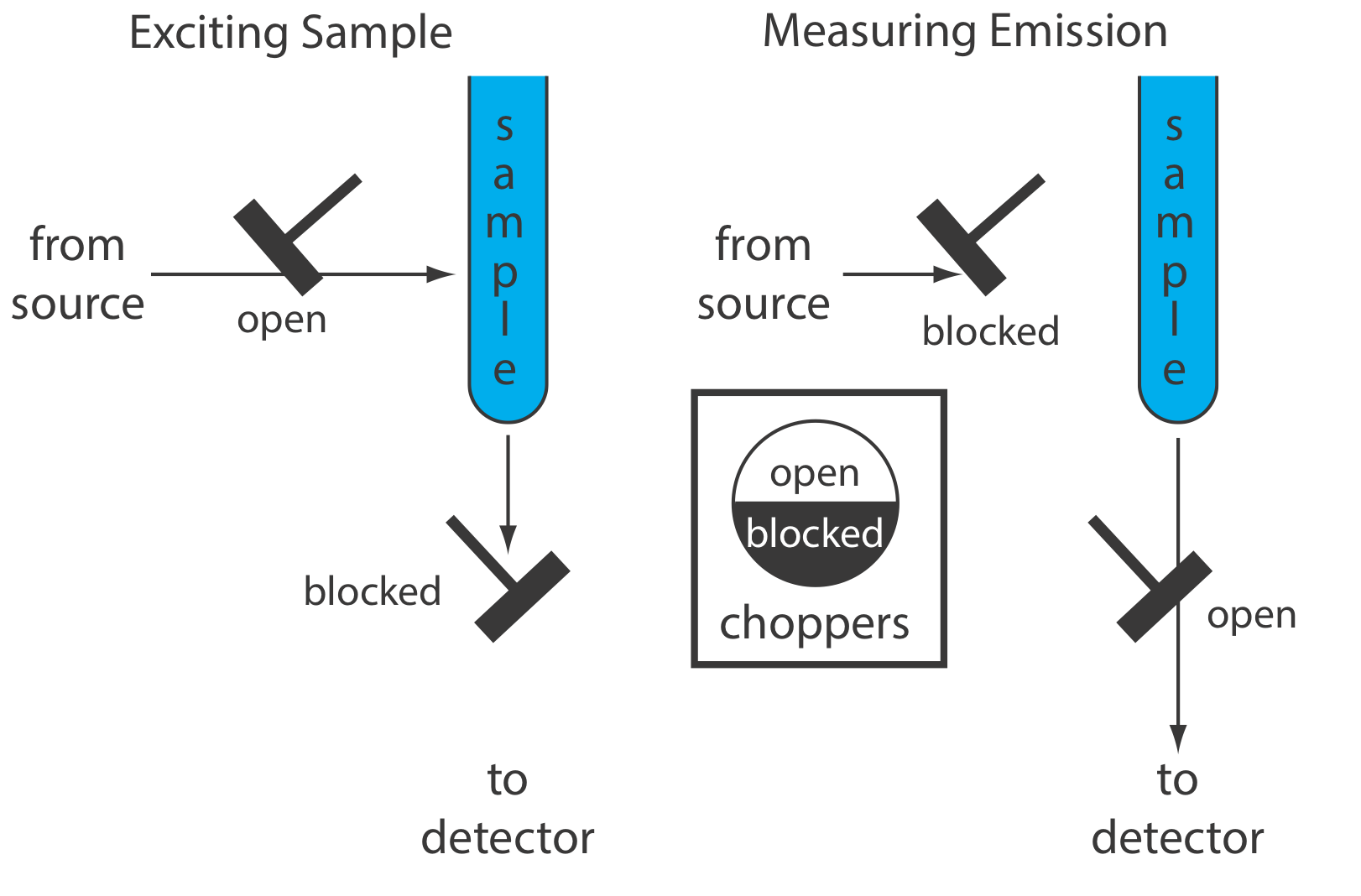
Debido a que la fosforescencia es un proceso tan lento, debemos evitar que el estado excitado se relaje por conversión externa. Una forma de lograr esto es disolviendo la muestra en un disolvente orgánico adecuado, generalmente una mezcla de etanol, isopentano y dietil eter. La solución resultante se congela a temperaturas Líquido-N 2 para formar un sólido ópticamente transparente. La matriz sólida minimiza la conversión externa debido a colisiones entre el analito y el disolvente. La conversión externa también se minimiza mediante la inmovilización de la muestra sobre un sustrato sólido, haciendo posibles mediciones de temperatura ambiente. Un enfoque es colocar una gota de una solución que contiene el analito en un pequeño disco de papel de filtro. Después de secar la muestra bajo una lámpara de calor, la muestra se coloca en el espectrofluorómetro para su análisis. Otros sustratos sólidos incluyen gel de sílice, alúmina, acetato de sodio y sacarosa. Este enfoque es particularmente útil para el análisis de placas de cromatografía en capa fina.
Aplicaciones Cuantitativas
La fluorescencia molecular y, en menor medida, la fosforescencia se utilizan para el análisis cuantitativo directo o indirecto de analitos en una variedad de matrices. Un análisis cuantitativo directo es posible cuando el rendimiento cuántico fluorescente o fosforescente del analito es favorable. Si el analito no es fluorescente o fosforescente, o si el rendimiento cuántico es desfavorable, entonces puede ser factible un análisis indirecto. Un enfoque es hacer reaccionar el analito con un reactivo para formar un producto que sea fluorescente o fosforescente. Otro enfoque es medir una disminución en la fluorescencia o fosforescencia cuando el analito se agrega a una solución que contiene una molécula sonda fluorescente o fosforescente. Se observa una disminución en la emisión cuando la reacción entre el analito y la molécula sonda potencia la desactivación sin radiación o da como resultado un producto no emisor. En esta sección se considera la aplicación de fluorescencia y fosforescencia a analitos inorgánicos y orgánicos.
Analitos inorgánicos
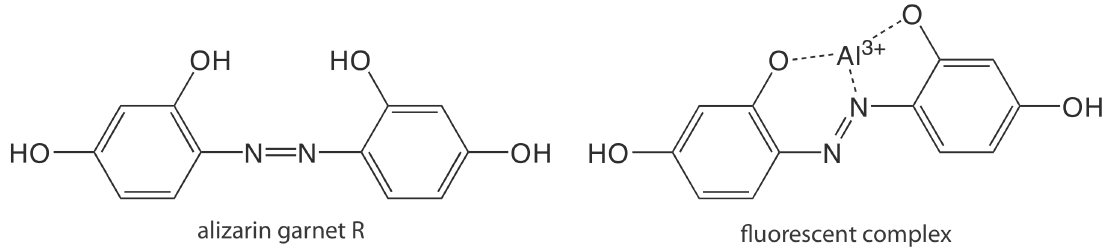
Excepto por algunos iones metálicos, lo más notable\(\text{UO}_2^+\), la mayoría de los iones inorgánicos no son suficientemente fluorescentes para un análisis directo. Muchos iones metálicos se determinan indirectamente al reaccionar con un ligando orgánico para formar un complejo fluorescente o, menos comúnmente, un complejo metal-ligando fosforescente. Un ejemplo es la reacción de Al 3 + con la sal sódica del ácido 2, 4, 3′-trihidroxiazobenceno-5′-sulfónico, también conocido como granate de alizarina R, que forma un complejo de metal-ligando fluorescente (Figura 10.6.9 ). El análisis se realiza utilizando una longitud de onda de excitación de 470 nm, con fluorescencia monitoreada a 500 nm. El cuadro 10.6.1 proporciona ejemplos adicionales de reactivos quelantes que forman complejos fluorescentes de metal-ligando con iones metálicos. Algunos no metales inorgánicos están determinados por su capacidad para disminuir, o apagar, la fluorescencia de otra especie. Un ejemplo es el análisis de F — basado en su capacidad para apagar la fluorescencia del complejo Al 3 + —granate alizarina R.
Analitos Orgánicos
Como se señaló anteriormente, los compuestos orgánicos que contienen anillos aromáticos generalmente son fluorescentes y los heterociclos aromáticos a menudo son fosforescentes. El cuadro 10.6.2 proporciona ejemplos de varios compuestos bioquímicos, farmacéuticos y ambientales importantes que se analizan cuantitativamente por fluorimetría o fosforimetría. Si un analito orgánico no es naturalmente fluorescente o fosforescente, puede ser posible incorporarlo a una reacción química que produzca un producto fluorescente o fosforescente. Por ejemplo, la enzima creatina fosfoquinasa se determina utilizándola para catalizar la formación de creatina a partir de fosfocreatina. La reacción de la creatina con ninhidrina produce un producto fluorescente de estructura desconocida.
Estandarización del Método
De la Ecuación\ ref {10.4} y la Ecuación\ ref {10.5} sabemos que la intensidad de fluorescencia o fosforescencia es una función lineal de la concentración del analito siempre que la absorbancia de la muestra de radiación fuente (\(A = \varepsilon bC\)) sea menor que aproximadamente 0.01. Las curvas de calibración a menudo son lineales en cuatro a seis órdenes de magnitud para fluorescencia y sobre dos a cuatro órdenes de magnitud para fosforescencia. Para mayores concentraciones de analito la curva de calibración se vuelve no lineal debido a que ya no se aplican los supuestos que llevaron a la Ecuación\ ref {10.4} y a la Ecuación\ ref {10.5}. Se puede observar no linealidad para concentraciones más pequeñas de analito fluorescente o contaminantes fosforescentes que están presentes. Como se discutió anteriormente, la eficiencia cuántica es sensible a la temperatura y la matriz de muestra, las cuales deben ser controladas cuando se utilizan estándares externos. Además, la intensidad de emisión depende de la absortividad molar de las especies fotoluminiscentes, la cual es sensible a la matriz de muestra.
Método Representativo 10.6.1: Determinación de Quinina en Orina
La mejor manera de apreciar los detalles teóricos y prácticos discutidos en esta sección es examinar cuidadosamente un método analítico típico. Si bien cada método es único, la siguiente descripción de la determinación de quinina en orina proporciona un ejemplo instructivo de un procedimiento típico. La descripción aquí se basa en Mule, S. J.; Hushin, P. L. Anal. Chem. 1971, 43, 708—711, y O'Reilly, J. E.; J. Chem. Educ. 1975, 52, 610—612. La Figura 10.6.3 muestra la fluorescencia de la quinina en agua tónica.
Descripción del Método
La quinina es un alcaloide utilizado para tratar la malaria. Es un compuesto fuertemente fluorescente en soluciones diluidas de H 2 SO 4 (\(\Phi_f = 0.55\)). El espectro de excitación de la quinina tiene bandas de absorción a 250 nm y 350 nm y su espectro de emisión tiene una sola banda de emisión a 450 nm. La quinina se excreta rápidamente del cuerpo en la orina y se determina midiendo su fluorescencia después de su extracción de la muestra de orina.
Procedimiento
Transfiera una muestra de orina de 2.00-mL a un tubo de ensayo de 15 mL y use NaOH 3.7 M para ajustar su pH entre 9 y 10. Agregar 4 mL de una mezcla 3:1 (v/v) de cloroformo e isopropanol y agitar el contenido del tubo de ensayo por un minuto. Permita que las capas orgánica y acuosa (orina) se separen y transfiera la fase orgánica a un tubo de ensayo limpio. Agregar 2.00 mL de 0.05 M H 2 SO 4 a la fase orgánica y agitar el contenido por un minuto. Permita que las capas orgánica y acuosa se separen y transfiera la fase acuosa a la celda de muestra. Mida la emisión fluorescente a 450 nm usando una longitud de onda de excitación de 350 nm. Determinar la concentración de quinina en la muestra de orina utilizando un conjunto de estándares externos en 0.05 M H 2 SO 4, preparado a partir de una solución de 100.0 ppm de quinina en 0.05 M H 2 SO 4. Use agua destilada como blanco.
Preguntas
1. El ion cloruro apaga la intensidad de la emisión fluorescente de la quinina. Por ejemplo, en presencia de 100 ppm de NaCl (61 ppm Cl —) la intensidad de emisión de quinina es solo 83% de su intensidad de emisión en ausencia de cloruro. La presencia de 1000 ppm de NaCl (610 ppm Cl —) reduce aún más la emisión fluorescente de quinina a menos de 30% de su intensidad de emisión en ausencia de cloruro. La concentración de cloruro en la orina típicamente oscila entre 4600—6700 ppm Cl —. Explique cómo este procedimiento evita una interferencia del cloruro.
El procedimiento utiliza dos extracciones. En la primera de estas extracciones, la quinina se separa de la orina extrayéndola en una mezcla de cloroformo e isopropanol, dejando atrás el ion cloruro en la muestra original.
2. Las muestras de orina pueden contener pequeñas cantidades de otros compuestos fluorescentes, que interferirán con el análisis si se llevan a través de las dos extracciones. ¿Explicar cómo se puede modificar el procedimiento para tener esto en cuenta?
Un enfoque es preparar un blanco que utilice una muestra de orina que se sabe que está libre de quinina. Restar la señal fluorescente del blanco de la fluorescencia medida de las muestras de orina corrige los compuestos interferentes.
La emisión fluorescente para quinina a 450 nm se puede inducir usando una frecuencia de excitación de 250 nm o 350 nm. La eficiencia cuántica fluorescente es la misma para cualquiera de las longitudes de onda de excitación. El espectro de absorción de quinina muestra que\(\varepsilon_{250}\) es mayor que\(\varepsilon_{350}\). Dado que la quinina tiene una absorbancia más fuerte a 250 nm, explique por qué su intensidad de emisión fluorescente es mayor cuando se utiliza 350 nm como longitud de onda de excitación.
De la Ecuación\ ref {10.4} sabemos que I f es una función de los siguientes términos: k\(\Phi_f\),, P 0\(\varepsilon\),, b, y C. Sabemos que\(\Phi_f\), b y C son lo mismo para ambas longitudes de onda de excitación y eso\(\varepsilon\) es mayor para una longitud de onda de 250 nm; podemos, por lo tanto, ignorar estos términos. La mayor intensidad de emisión cuando se utiliza una longitud de onda de excitación de 350 nm debe deberse a un valor mayor para P 0 o k. De hecho, P 0 a 350 nm para una lámpara de arco Xe de alta presión es aproximadamente 170% de eso a 250 nm. Además, la sensibilidad de un detector fotomultiplicador típico (que contribuye al valor de k) a 350 nm es aproximadamente 140% de la de 250 nm.
Para evaluar el método descrito en el Método Representativo 10.6.1, se prepara y analiza una serie de estándares externos, proporcionando los resultados que se muestran en la siguiente tabla. Todas las intensidades fluorescentes se corrigen usando un blanco preparado a partir de una muestra de orina libre de quinina. Las intensidades fluorescentes se normalizan estableciendo If para el estándar de concentración más alto a 100.
| [quinina] (µg/mL) | I f |
|---|---|
| 1.00 | 10.11 |
| 3.00 | 30.20 |
| 5.00 | 49.84 |
| 7.00 | 69.89 |
| 10.00 | 100.0 |
Después de ingerir 10.0 mg de quinina, un voluntario proporciona una muestra de orina 24 h después. El análisis de la muestra de orina da una intensidad relativa de emisión de 28.16. Reportar la concentración de quinina en la muestra en mg/L y el porcentaje de recuperación para la quinina ingerida.
Solución
La regresión lineal de la intensidad de emisión relativa frente a la concentración de quinina en los estándares da la curva de calibración que se muestra a continuación y la siguiente ecuación de calibración.
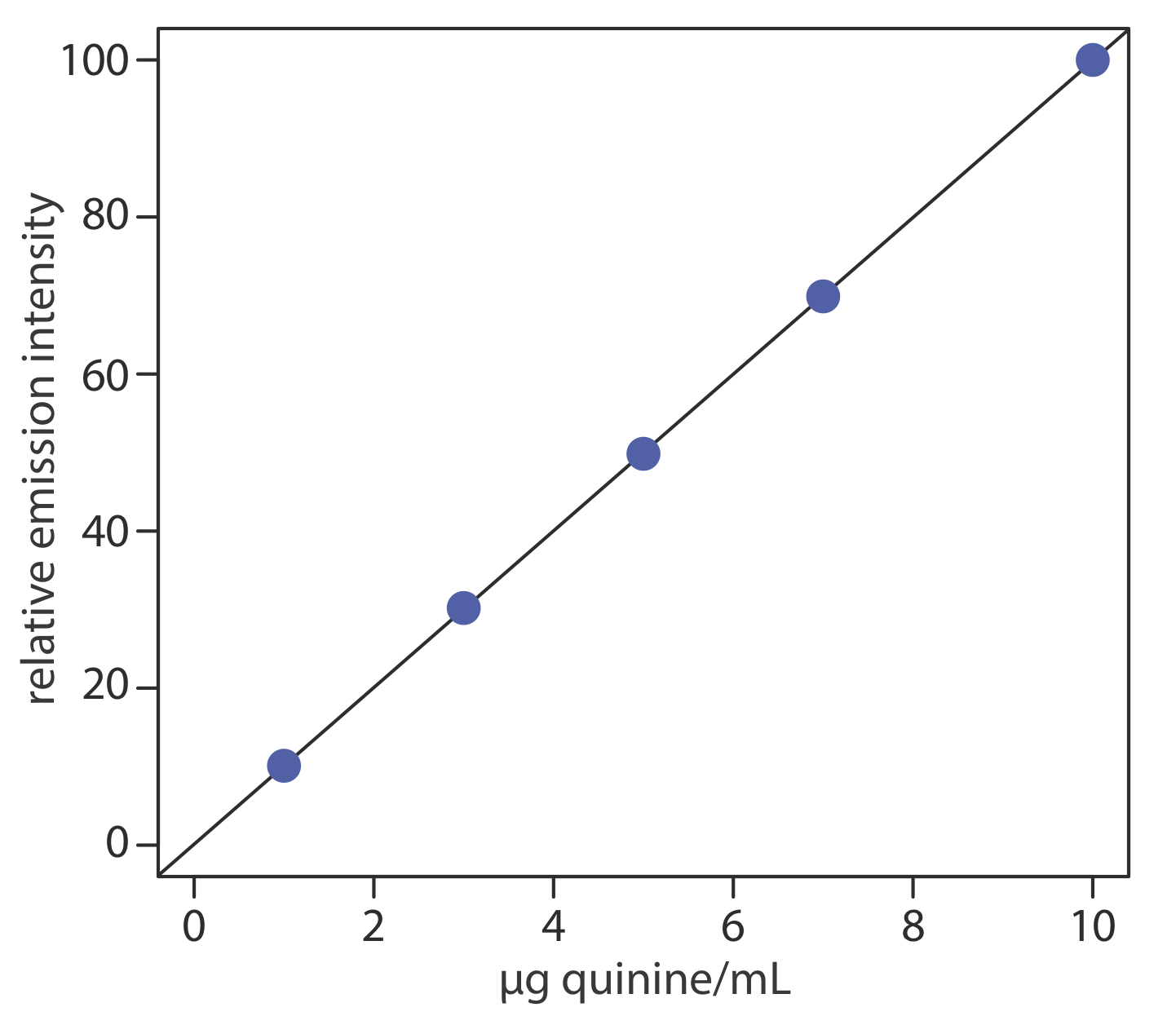
\[I_{f}=0.122+9.978 \times \frac{\mathrm{g} \text { quinine }}{\mathrm{mL}} \nonumber\]
Sustituyendo la intensidad de emisión relativa de la muestra en la ecuación de calibración da la concentración de quinina como 2.81 μg/mL. Debido a que el volumen de orina tomada, 2.00 mL, es el mismo que el volumen de 0.05 M H 2 SO 4 utilizado para extraer la quinina, la concentración de quinina en la orina también es de 2.81 μg/mL. La recuperación de la quinina ingerida es
\[\frac{\frac{2.81 \ \mu \mathrm{g} \text { quinine }}{\mathrm{mL} \text { urine }} \times 2.00 \ \mathrm{mL} \text { urine } \times \frac{1 \mathrm{mg}}{1000 \ \mu \mathrm{g}}} {10.0 \ \mathrm{mg} \text { quinine ingested }} \times 100=0.0562 \% \nonumber\]
Pueden tomar de 10 a 11 días para que el cuerpo excrete completamente la quinina por lo que no es de extrañar que una cantidad tan pequeña de quinina se recupere de esta muestra de orina.
Evaluación de espectroscopía de fotoluminiscencia
Escala de Operación
La espectroscopia de fotoluminiscencia se utiliza para el análisis rutinario de analitos de traza y ultratraza en muestras macro y meso. Los límites de detección para espectroscopía de fluorescencia están influenciados por el rendimiento cuántico del analito. Para un analito con\(\Phi_f > 0.5\), es posible un límite de detección picomolar cuando se usa un espectrofluorómetro de alta calidad. Por ejemplo, el límite de detección para el sulfato de quinina, para el cual\(\Phi\) es de 0.55, generalmente está entre 1 parte por mil millones y 1 parte por billón. Los límites de detección de fosforescencia son algo mayores, con valores típicos en el rango nanomolar para la fosforimetría a baja temperatura y en el rango micromolar para la fosforimetría a temperatura ambiente usando un sustrato sólido.
Precisión
La precisión de un método de fluorescencia generalmente está entre 1— 5% cuando las interferencias espectrales y químicas son insignificantes. La precisión está limitada por los mismos tipos de problemas que afectan a otros métodos espectroscópicos ópticos. Además, la precisión se ve afectada por interferencias que afectan el rendimiento cuántico fluorescente. La precisión de la fosforescencia es algo mayor que la de la fluorescencia.
Precisión
La desviación estándar relativa para la fluorescencia suele estar entre 0.5— 2% cuando la concentración del analito está muy por encima de su límite de detección. La precisión suele estar limitada por la estabilidad de la fuente de excitación. La precisión de la fosforescencia a menudo está limitada por la reproducibilidad en la preparación de muestras para el análisis, siendo comunes las desviaciones estándar relativas del 5— 10%.
Sensibilidad
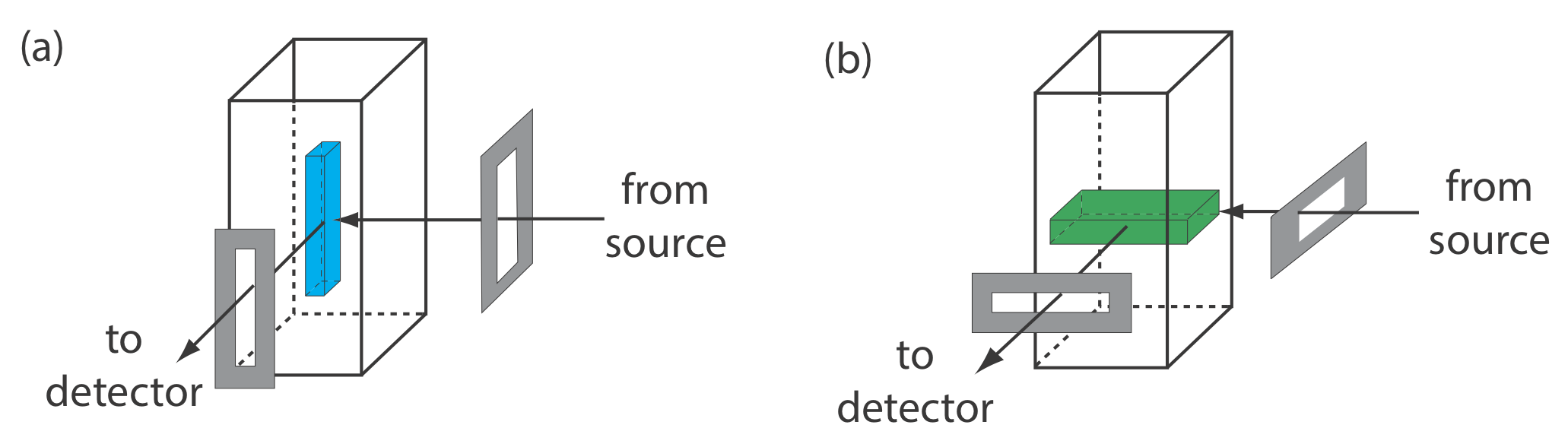
De la Ecuación\ ref {10.4} y la Ecuación\ ref {10.5} sabemos que la sensibilidad de un método fluorescente o fosforescente se ve afectada por una serie de parámetros. Ya hemos considerado la importancia del rendimiento cuántico y el efecto de la temperatura y la composición de la solución sobre\(\Phi_f\) y\(\Phi_p\). Además del rendimiento cuántico, la sensibilidad se mejora mediante el uso de una fuente de excitación que tiene una mayor intensidad de emisión, P 0, a la longitud de onda deseada, y seleccionando una longitud de onda de excitación para la que el analito tenga una mayor absortividad molar,\(\varepsilon\). Otro enfoque para mejorar la sensibilidad es aumentar el volumen a partir del cual se monitorea la emisión. La Figura 10.6.10 muestra cómo rotar las ranuras de un monocromador desde su orientación vertical habitual a una orientación horizontal aumenta el volumen de muestreo. El resultado puede en- arrugar la emisión de la muestra por\(5-30 \times\).
Selectividad
La selectividad de fluorescencia y fosforescencia es superior a la de la espectrofotometría de absorción por dos razones: primero, no todos los compuestos que absorben radiación son fluorescentes o fosforescentes; y, segundo, la selectividad entre un analito y un interferente es posible si hay una diferencia en cualquiera su excitación o sus espectros de emisión. La intensidad de emisión total es una suma lineal de la de cada especie fluorescente o fosforescente. El análisis de una muestra que contiene n analitos, por lo tanto, se realiza midiendo la intensidad de emisión total a n longitudes de onda.
Tiempo, Costo y Equipo
Al igual que con otros métodos espectroscópicos ópticos, los métodos fluorescentes y fosforescentes proporcionan un medio rápido para analizar muestras y son capaces de automatización. Los fluorímetros son relativamente económicos, van desde varios cientos hasta varios miles de dólares, y a menudo son satisfactorios para el trabajo cuantitativo. Los espectrofluorómetros son más caros, ya que los modelos suelen superar los 50,000 dólares.


