16.2: Celdas galvánicas y electrodos
- Page ID
- 70749
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Es físicamente imposible medir la diferencia de potencial entre una pieza de metal y la solución en la que se sumerge. Podemos, sin embargo, medir la diferencia entre los potenciales de dos electrodos que sumergen en la misma solución, o más útilmente, están en dos soluciones diferentes. En este último caso, cada par electrodo-solución constituye una media celda de oxidación-reducción, y estamos midiendo la suma de los dos potenciales de media celda.
Esta disposición se llama celda galvánica. Una celda típica podría consistir en dos piezas de metal, una de zinc y otra de cobre, cada una sumergida en una solución que contiene una sal disuelta del metal correspondiente. Las dos soluciones están separadas por una barrera porosa que evita que se mezclen rápidamente pero permite que los iones se difundan a través de ellas.
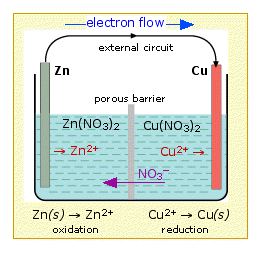
Si conectamos el zinc y el cobre por medio de un conductor metálico, los electrones sobrantes que quedan cuando los iones Zn 2 + emergen del zinc en la celda izquierda podrían fluir a través del circuito externo y al electrodo derecho, donde podrían ser entregados al Cu 2 + iones que se “descargan”, es decir, se convierten en átomos de Cu en la superficie del electrodo de cobre. La reacción neta es la oxidación del zinc por iones de cobre (II):
\[Zn_{(s)} + Cu^{2+} \rightarrow Zn^{2+} + Cu_{(s)}\]
pero esta vez, las etapas de oxidación y reducción (medias reacciones) tienen lugar en ubicaciones separadas:
|
Electrodo izquierdo:
|
Zn (s) → Zn 2 + + 2 e — | oxidación |
|
electrodo derecho:
|
Cu 2 + + 2 e — → Cu (s) | reducción |
Las celdas electroquímicas permiten la medición y el control de una reacción redox
La reacción se puede iniciar y detener conectando o desconectando los dos electrodos. Si colocamos una resistencia variable en el circuito, incluso podemos controlar la velocidad de reacción de la celda neta simplemente girando una perilla. Al conectar una batería u otra fuente de corriente a los dos electrodos, podemos forzar que la reacción continúe en su dirección no espontánea, o inversa. Al colocar un amperímetro en el circuito externo, podemos medir la cantidad de carga eléctrica que pasa a través de los electrodos, y así el número de moles de reactivos que se transforman en productos en la reacción celular.
La carga eléctrica q se mide en culombios. A la cantidad de carga transportada por un mol de electrones se le conoce como el Faraday, que denotamos por F. Experimentos cuidadosos han determinado que 1 F = 96467 C. Para la mayoría de los propósitos, simplemente puede usar 96,500 Coulombs como valor del faraday. Cuando medimos la corriente eléctrica, estamos midiendo la velocidad a la que se transporta la carga eléctrica a través del circuito. Una corriente de un amperio corresponde al flujo de un culombo por segundo.
Transporte de carga dentro de la celda
Para que la celda funcione, no sólo debe haber un circuito eléctrico externo entre los dos electrodos, sino que los dos electrolitos (las soluciones) deben estar en contacto. La necesidad de esto se puede entender considerando qué pasaría si las dos soluciones estuvieran físicamente separadas. Se agrega carga positiva (en forma de Zn 2 +) al electrolito en el compartimento izquierdo, y se retira (como Cu 2 +) del lado derecho, provocando que la solución en contacto con el zinc adquiera una carga positiva neta, mientras que se acumularía una carga neta negativa en la solución en el lado de cobre de la celda. Estas violaciones de la electroneutralidad harían más difícil (requeriría más trabajo) introducir iones Zn 2 + adicionales en el electrolito cargado positivamente o que los electrones fluyan al compartimento derecho donde se necesitan para reducir el Cu 2 + iones, deteniendo así efectivamente la reacción después de que solo se haya producido una cantidad químicamente insignificante.
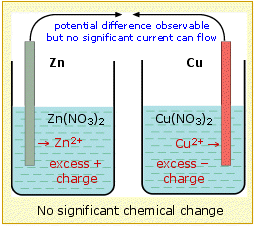
Para sostener la reacción celular, la carga transportada por los electrones a través del circuito externo debe ir acompañada de un transporte compensador de iones entre las dos células. Esto significa que debemos proporcionar un camino para que los iones se muevan directamente de una célula a otra. Este transporte iónico involucra no sólo a las especies electroactivas Cu 2 + y Zn 2 +, sino también a los contraiones, que en este ejemplo son nitrato, NO 3 -. Así, un exceso de Cu 2 + en el compartimento izquierdo podría ser aliviado por la deriva de estos iones hacia el lado derecho, o igualmente bien por difusión de iones nitrato hacia la izquierda. Estudios más detallados revelan que ambos procesos ocurren, y que las cantidades relativas de carga transportadas a través de la solución por iones positivos y negativos dependen de sus movilidades relativas, que expresan la velocidad con la que los iones son capaces de abrirse paso a través de la solución. Dado que los iones negativos tienden a ser mayores que los iones positivos, estos últimos tienden a tener mayores movilidades y llevan la mayor fracción de carga.

En las celdas más simples, la barrera entre las dos soluciones puede ser una membrana porosa, pero para mediciones precisas, se utiliza una disposición más complicada, conocida como puente salino. El puente salino consiste en un compartimento intermedio lleno de una solución concentrada de KCl y provisto de barreras porosas en cada extremo. El propósito del puente salino es minimizar la diferencia de potencial natural, conocida como potencial de unión, que se desarrolla (como se mencionó en la sección anterior) cuando dos fases cualesquiera (como las dos soluciones) están en contacto. Esta diferencia de potencial se combinaría con los dos potenciales de media celda para introducir un grado de incertidumbre en cualquier medición del potencial celular. Con el puente de sal, tenemos dos potenciales de unión líquida en lugar de uno, pero tienden a cancelarse entre sí.
Convenciones de descripción de celdas
Para facilitar la descripción de una celda electroquímica dada, se ha adoptado una notación simbólica especial. En esta notación la celda que describimos anteriormente sería
Zn (s) | Zn 2 + (aq) || Cu 2 + (aq) | Cu (s)
Hay varias otras convenciones relacionadas con la notación y nomenclatura de celdas que se espera que conozca:
- El ánodo es donde ocurre la oxidación, y el cátodo es el sitio de reducción. En una celda real, la identidad de los electrodos depende de la dirección en la que se esté produciendo la reacción celular neta.
- Si los electrones fluyen desde el electrodo izquierdo al electrodo derecho (como se representa en la notación celular anterior) cuando la celda opera en su dirección espontánea, el potencial del electrodo derecho será mayor que el del izquierdo, y el potencial celular será positivo.
- El “flujo de corriente convencional” es de positivo a negativo, lo que es opuesto a la dirección del flujo de electrones. Esto significa que si los electrones fluyen desde el electrodo izquierdo hacia la derecha, un galvanómetro colocado en el circuito externo indicaría un flujo de corriente de derecha a izquierda.
Electrodos y reacciones de electrodos
Una reacción de electrodo se refiere al proceso de oxidación o reducción neta que tiene lugar en un electrodo. Esta reacción puede tener lugar en una sola etapa de transferencia de electrones, o como una sucesión de dos o más etapas. Las sustancias que reciben y pierden electrones se denominan especies electroactivas.
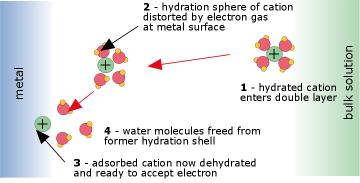
Este proceso tiene lugar dentro de la región interfacial muy delgada en la superficie del electrodo, e implica la tunelización mecánica de electrones entre el electrodo y las especies electroactivas. El trabajo requerido para desplazar las moléculas H 2 O en las esferas de hidratación de los iones constituye parte de la energía de activación del proceso.
En el ejemplo de la celda de Zn/Cu que hemos estado usando, la reacción del electrodo involucra un metal y su catión hidratado; a tales electrodos los llamamos electrodos de iones metal-metal. Hay una serie de otros tipos de electrodos que se encuentran ampliamente en electroquímica y química analítica.
Electrodos de iones
Muchas reacciones de electrodos involucran solo especies iónicas, tales como\(Fe^{2+}\) y\(Fe^{3+}\). Si ninguna de las especies electroactivas es un metal, algún otro metal debe servir como conducto para el suministro o eliminación de electrones del sistema. Para evitar complicaciones que surgirían de las reacciones de los electrodos que involucran a este metal, comúnmente se usa una sustancia relativamente inerte como el platino. Tal media celda se representaría como
Pt (s) | Fe 3 + (aq), Fe 2 + (aq) ||...
y la reacción de media celda sería
\[Fe^{2+}(aq) \rightarrow Fe^{3+} (aq) + e^-\]
La reacción ocurre en la superficie del electrodo (Fig. 4 anterior). El ion electroactivo se difunde a la superficie del electrodo y se adsorbe (se une) a él por las fuerzas de van der Waals y Coulombic. Al hacerlo, las aguas de hidratación que normalmente están adheridas a cualquier especie iónica deben ser desplazadas. Este proceso es siempre endotérmico, a veces hasta tal punto que solo una pequeña fracción de los iones podrá entrar en contacto con la superficie lo suficientemente cerca como para sufrir transferencia de electrones, y la reacción será lenta. La transferencia de electrones real se produce por tunelización cuántica mecánica.
Electrodos de gas
Algunas reacciones de electrodos involucran una especie gaseosa como\(H_2\),\(O_2\), o\(Cl_2\). Tales reacciones también deben llevarse a cabo sobre la superficie de un conductor electroquímicamente inerte como el platino. Una reacción típica de considerable importancia comercial es
\[Cl^-(aq) \rightarrow ½ Cl_2(g) + e^- \]
Reacciones similares que involucran la oxidación\(Br_2\) o\(I_2\) también ocurren en superficies de platino.
Electrodos insolubles de sal
Un electrodo típico de este tipo consiste en un alambre de plata cubierto con una fina capa de cloruro de plata, que es insoluble en agua. La reacción del electrodo consiste en la oxidación y reducción de la plata:
\[AgCl(s) + e^– → Ag(s) + Cl^–(aq)\]
La media celda estaría representada como
\[ ... || Cl^– (aq) | AgCl (s) | Ag (s)\]
Si bien la utilidad de dicho electrodo puede no ser inmediatamente evidente, este tipo de electrodo encuentra una aplicación muy amplia en las mediciones electroquímicas, como veremos más adelante.
Electrodos de Referencia
En la mayoría de los experimentos electroquímicos nuestro interés se concentra en una sola de las reacciones de los electrodos. Dado que todas las mediciones deben realizarse en una celda completa que involucre dos sistemas de electrodos, es una práctica común emplear un electrodo de referencia como la otra mitad de la celda. Los principales requisitos de un electrodo de referencia son que sea fácil de preparar y mantener, y que su potencial sea estable. El último requisito significa esencialmente que la concentración de cualquier especie iónica involucrada en la reacción del electrodo debe mantenerse en un valor fijo. La forma más común de lograr esto es usar una reacción de electrodo que involucra una solución saturada de una sal insoluble del ion. Uno de esos sistemas, ya se ha mencionado el electrodo de plata-cloruro de plata:
\[Ag | AgCl(s) | Cl^–(aq) || ...\]
\[Ag(s) + Cl^–(aq) →AgCl(s) + e^–\]
Este electrodo suele tomar la forma de un trozo de alambre de plata recubierto con AgCl. El recubrimiento se realiza haciendo de la plata el ánodo en una celda electrolítica que contiene HCl; los iones Ag + se combinan con iones Cl — tan rápido como se forman en la superficie de la plata.

El otro electrodo de referencia común es el electrodo de calomel; calomel es el nombre común para cloruro de mercurio (I). Tal media celda se representaría como
\[Hg | Hg^{2+}(aq) | KCl || ...\]
y la reacción de media celda sería
\[Hg(l) + Cl^– → ½ HgCl2(s) + e^–\]
Los potenciales de ambos electrodos se han determinado con mucha precisión contra el electrodo de hidrógeno. Este último rara vez se utiliza en mediciones electroquímicas rutinarias debido a que es más difícil de preparar; la superficie del platino tiene que ser tratada especialmente por electrólisis preliminar. Además, existe la necesidad de un suministro de gas hidrógeno que lo hace algo engorroso y peligroso.
Resumen y notas adicionales
Asegúrese de comprender a fondo las siguientes ideas esenciales que se han presentado anteriormente. Es especialmente importante que conozcas los significados precisos de todos los términos resaltados en el contexto de este tema.
- Una celda galvánica (a veces más apropiadamente llamada celda voltaica) consiste en dos medias celdas unidas por un puente salino o algún otro camino que permita que los iones pasen entre los dos lados para mantener la electroneutralidad.
- La forma convencional de representar una celda electroquímica de cualquier tipo es escribir la media reacción de oxidación a la izquierda y la reducción a la derecha. Por lo tanto, para la reacción
Zn (s) + Cu 2 + → Zn 2 + + Cu (s)
escribimos
Zn (s) | Zn 2 + (aq) || Cu 2 + (aq) | Cu (s)
en el que las barras verticales individuales representan límites de fase. La barra doble denota un límite líquido-líquido que en las células de laboratorio consiste en un puente salino o en una barrera permeable a los iones. Si la reacción de la celda neta se escribiera a la inversa, la notación celular se convertiría
Cu (s) | Cu 2 + (aq) || Zn 2+ (aq) | Zn (s)
Recuerde: el proceso de R educación siempre se muestra a la derecha.
-
en la superficie del electrodo. La energía requerida para desplazar las moléculas de agua de la capa de hidratación de un ion a medida que se acerca a la superficie del electrodo constituye una energía de activación que puede ralentizar el proceso. Incluso mayores energías de activación (y reacciones más lentas) ocurren cuando se forma o consume una molécula como O 2.


