Estequiometría
- Page ID
- 75029
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Habilidades para Desarrollar
- Realizar cálculos estequiométricos
- Distinguir el equilibrio dinámico del equilibrio
- Describir por qué el rendimiento real puede ser menor que el rendimiento teórico
La estequiometría es un término general para las relaciones entre cantidades de sustancias en reacciones químicas. También describe cálculos realizados para determinar qué cantidad de sustancia se utilizará en una reacción, sobrante después de una reacción, producida por una reacción, etc.
¿Cómo lo usas?
Los cálculos de rendimiento teórico en la sección anterior son cálculos estequiométricos simples. Para hacer cálculos estequiométricos, necesitarás:
- Una ecuación química equilibrada: es posible que necesites escribir la ecuación y equilibrarla tú mismo, en base a lo que sabes
- Pesos de fórmula o pesos moleculares (abreviados FW o MW) para compuestos relevantes: a menudo necesitará calcularlos por usted mismo usando la tabla periódica y las fórmulas; solo sume los pesos atómicos de acuerdo con la fórmula
- Por lo general, necesitarás averiguar cuántos moles reaccionan; para ello, deberás decidir cuál es el reactivo limitante, comparando el número de moles de cada compuesto que están presentes y los coeficientes en la ecuación
- Finalmente, una vez que tengas todas las partes puedes hacer una conversión de unidades estilo análisis dimensional para encontrar la respuesta. Asegúrate de entender lo que hace cada paso y que cada paso se está multiplicando por 1. También es posible que tengas que hacer alguna otra suma o resta, dependiendo de lo que pida la pregunta, como restar la cantidad de un compuesto que reacciona de la cantidad inicial para encontrar la parte sobrante
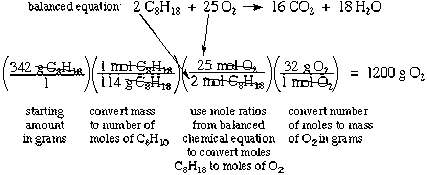
Conceptos de estequiometría y reacción
Hacer cálculos estequiométricos no es solo un procedimiento para resolver un problema en un libro. Es una manera de describir las cosas que realmente suceden, y se relaciona con conceptos y comprensión de la química.
Los cálculos estequiométricos se basan en la conservación de la masa (ver la página de Lavoisier) y la idea de que partículas como núcleos y electrones no se crean ni destruyen durante las reacciones, solo se reordenan. Estos entendimientos nos permiten hacer estos cálculos.
Los cálculos estequiométricos también están relacionados con el concepto de equilibrio químico. Equilibrio significa un estado estable en el que las fuerzas opuestas están equilibradas. Por ejemplo, cuando te paras sobre un pie, para mantener el equilibrio y no caerte, si te mueves un poco hacia un lado, necesitarás corregir eso y retroceder un poco en la otra dirección para no perder el equilibrio. En química, equilibrio significa un estado en el que están ocurriendo 2 procesos opuestos, pero a la misma velocidad. Por ejemplo, la reacción puede ir en dirección hacia adelante (hacia la derecha), y al mismo tiempo algunas moléculas de producto se están convirtiendo en reactivos, yendo en dirección inversa (hacia la izquierda). En muchas reacciones químicas, ambas direcciones son posibles; cuando están sucediendo a la misma velocidad, eso se llama equilibrio dinámico, que significa “equilibrio móvil”, porque las moléculas individuales se mueven de un lado a otro entre “reactivo” y “producto” (que en realidad se definen simplemente por cómo escribes la ecuación), pero las cantidades totales de reactivo y producto no están cambiando.

Cuando hacemos cálculos estequiométricos, asumimos que la reacción será completa, es decir, que el reactivo limitante reaccionará completamente, por lo que no queda ninguno, formando tanto producto como sea posible. No obstante, esto es sólo a veces lo que sucede. Hay varias razones por las que esto podría no suceder.
Posibles razones por las que el rendimiento real es menor que el rendimiento teórico
- Rate describe qué tan rápido ocurre una reacción química. Algunas reacciones químicas son muy lentas, como las que disuelven la roca y cambian la forma de las montañas; otras son muy rápidas, o intermedias. En general, la velocidad de una reacción dependerá de las condiciones, como la temperatura. Ahora mismo, sobre todo hablaremos de reacciones que ocurren bastante rápido, pero si una reacción no termina antes de medirla, podría ser porque es demasiado lenta. Esto se discute más cuando se estudia la cinética química.

- La posición del equilibrio es otra posible razón por la que una reacción podría no producir tanto producto como calculas. Para todas las reacciones, se alcanza el equilibrio antes de que se use todo el reactivo; podría usar casi todo el reactivo, para que no note la pequeña parte sobrante, o podría alcanzar el equilibrio con más de la mitad del reactivo restante. Si se alcanza el equilibrio (si la reacción es lo suficientemente rápida), el rendimiento teórico predicho solo se alcanzará si el equilibrio es casi todo producto. Posteriormente, aprenderás formas de predecir dónde está el equilibrio. Por ahora, solo debes saber que las reacciones pueden ir en ambas direcciones, y que el equilibrio no siempre es todo producto.

La última complicación posible son reacciones secundarias o competitivas. Esto significa que algunas otras reacciones en las que no has pensado o aprendido podrían estar sucediendo, que agotan parte del reactivo o producto. Debido a que la química es realmente complicada y muy pocos materiales son realmente puros, casi todos los sistemas o reacciones reales tendrán algunas reacciones secundarias. A veces son muy importantes y evitan que suceda lo que quieres que suceda; otras veces no importan para nada.

Para tus cálculos, normalmente no necesitas preocuparte realmente por la tasa, el equilibrio o las reacciones secundarias, porque aún no hemos aprendido estrategias para lidiar con ellos. Sin embargo, para que tus modelos mentales de reacciones químicas coincidan con los sistemas químicos reales, es importante saber que las reacciones reales son más complicadas de lo que las hacemos parecer en las primeras semanas de la clase química.
Colaboradores y Atribuciones
Emily V Eames (City College of San Francisco)

