6.4: Estructura Electrónica de Átomos (Configuraciones Electrónicas)
- Page ID
- 75304
- Derivar las configuraciones predichas de electrones del estado fundamental de los átomos
- Identificar y explicar excepciones a las configuraciones predichas de electrones para átomos e iones
- Relacionar configuraciones de electrones con clasificaciones de elementos en la tabla periódica
Habiendo introducido los fundamentos de la estructura atómica y la mecánica cuántica, podemos usar nuestra comprensión de los números cuánticos para determinar cómo se relacionan los orbitales atómicos entre sí. Esto nos permite determinar qué orbitales están ocupados por electrones en cada átomo. La disposición específica de los electrones en los orbitales de un átomo determina muchas de las propiedades químicas de ese átomo.
Energías orbitales y estructura atómica
La energía de los orbitales atómicos aumenta a medida que aumenta el número cuántico principal\(n\),,. En cualquier átomo con dos o más electrones, la repulsión entre los electrones hace que las energías de las subcáscaras con diferentes valores\(l\) difieran de manera que la energía de los orbitales aumenta dentro de una concha en el orden s < p < d < f. \(\PageIndex{1}\)describe cómo se relacionan estas dos tendencias en el aumento de la energía. El orbital de 1 s en la parte inferior del diagrama es el orbital con electrones de menor energía. La energía aumenta a medida que avanzamos hasta los orbitales 2 s y luego 2 p, 3 s y 3 p, lo que demuestra que el valor n creciente tiene más influencia en la energía que el valor l creciente para átomos pequeños. Sin embargo, este patrón no se sostiene para átomos más grandes. El orbital de 3 d es mayor en energía que el orbital de 4 s. Tales superposiciones continúan ocurriendo con frecuencia a medida que avanzamos hacia arriba en el gráfico.

Los electrones en átomos sucesivos en la tabla periódica tienden a llenar primero orbitales de baja energía. Así, a muchos estudiantes les resulta confuso que, por ejemplo, los orbitales de 5 p se llenen inmediatamente después de los 4 d, e inmediatamente antes de los 6 s. El orden de llenado se basa en resultados experimentales observados, y ha sido confirmado por cálculos teóricos. A medida que aumenta el número cuántico principal, n, el tamaño de la órbita aumenta y los electrones pasan más tiempo más lejos del núcleo. Así, la atracción hacia el núcleo es más débil y la energía asociada a la órbita es mayor (menos estabilizada). Pero este no es el único efecto que tenemos que tener en cuenta. Dentro de cada caparazón, a medida que aumenta el valor de l, los electrones son menos penetrantes (es decir, hay menos densidad de electrones que se encuentra cerca del núcleo), en el orden s > p > d > f. Los electrones que están más cerca del núcleo repelen ligeramente los electrones que están más alejados, compensando ligeramente las atracciones del núcleo electrónico más dominante (recordemos que todos los electrones tienen −1 cargas, pero los núcleos tienen cargas + Z). Este fenómeno se denomina blindaje y se discutirá con más detalle en la siguiente sección. Los electrones en orbitales que experimentan más blindaje están menos estabilizados y por lo tanto más altos en energía. Para orbitales pequeños (1 s a 3 p), el aumento de energía debido a n es más significativo que el aumento debido a l; sin embargo, para orbitales más grandes las dos tendencias son comparables y no se pueden predecir simplemente. Discutiremos métodos para recordar el orden observado.
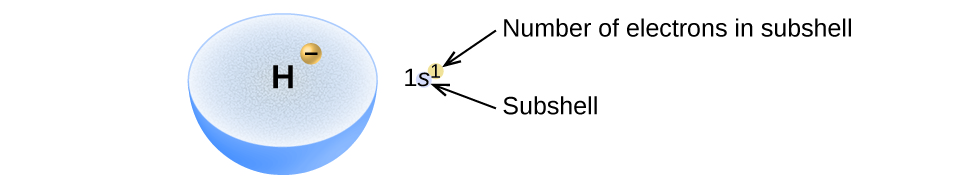
La disposición de los electrones en los orbitales de un átomo se denomina configuración electrónica del átomo. Describimos una configuración electrónica con un símbolo que contiene tres piezas de información (Figura\(\PageIndex{2}\)):
- El número de la cáscara cuántica principal, n,
- La letra que designa el tipo orbital (la subcapa, l), y
- Un número superíndice que designa el número de electrones en esa subcapa en particular.
Por ejemplo, la notación 2 p 4 (léase “dos-p—cuatro”) indica cuatro electrones en una subcapa p (l = 1) con un número cuántico principal (n) de 2. La notación 3 d 8 (léase “tres—d—ocho”) indica ocho electrones en la subcapa d (i.e., l = 2) de la cáscara principal para la cual n = 3.
El principio de Aufbau
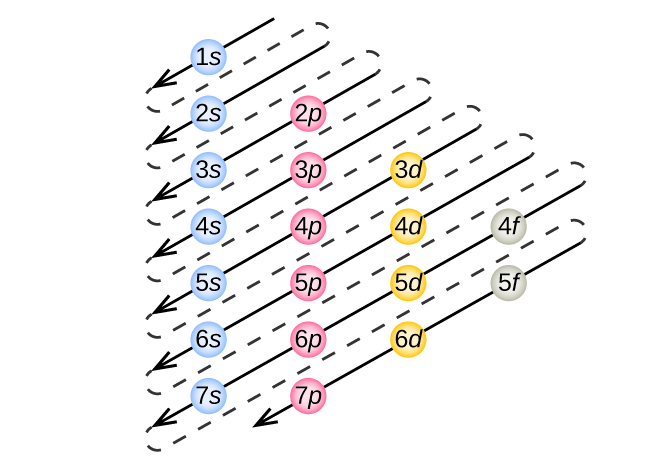
Para determinar la configuración electrónica para cualquier átomo en particular, podemos “construir” las estructuras en el orden de los números atómicos. Comenzando con hidrógeno, y continuando a través de los períodos de la tabla periódica, agregamos un protón a la vez al núcleo y un electrón a la subcapa adecuada hasta que hayamos descrito las configuraciones electrónicas de todos los elementos. Este procedimiento se llama principio Aufbau, de la palabra alemana Aufbau (“construir”). Cada electrón agregado ocupa la subcapa de menor energía disponible (en el orden mostrado en la Figura\(\PageIndex{3}\)), sujeto a las limitaciones impuestas por los números cuánticos permitidos según el principio de exclusión de Pauli. Los electrones ingresan a las subcapas de mayor energía solo después de que las subconchas de menor energía se hayan llenado hasta su capacidad. La figura\(\PageIndex{3}\) ilustra la forma tradicional de recordar el orden de llenado de los orbitales atómicos.
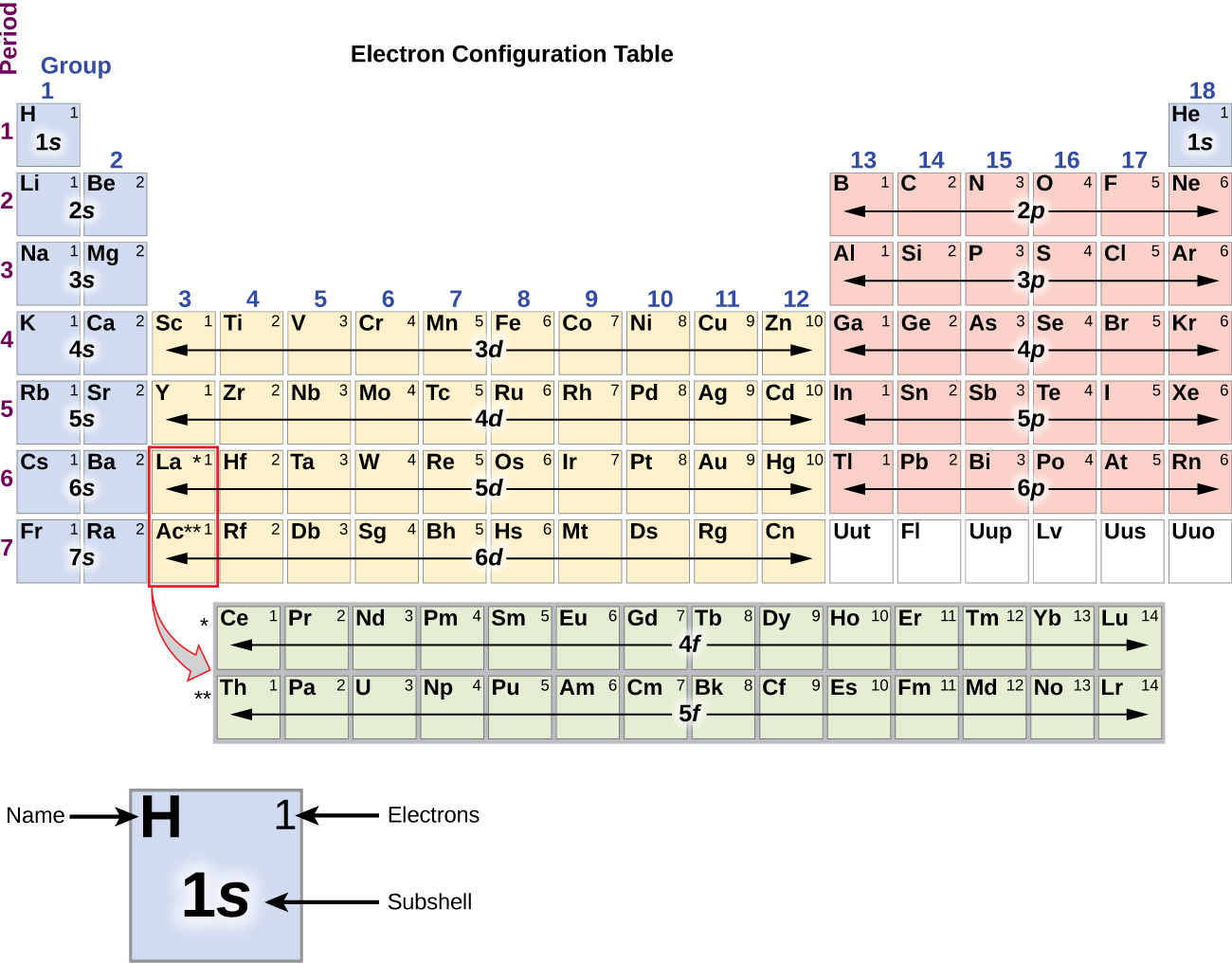
Dado que la disposición de la tabla periódica se basa en las configuraciones de electrones, la Figura\(\PageIndex{4}\) proporciona un método alternativo para determinar la configuración electrónica. El orden de llenado simplemente comienza en hidrógeno e incluye cada subcapa a medida que avanza en orden Z creciente. Por ejemplo, después de llenar el bloque 3 p hasta Ar, vemos que el orbital será 4s (K, Ca), seguido de los orbitales de 3 d.
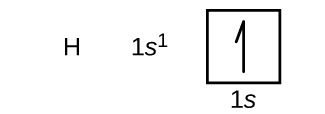
Ahora construiremos la configuración electrónica del estado fundamental y el diagrama orbital para una selección de átomos en los períodos primero y segundo de la tabla periódica. Los diagramas orbitales son representaciones pictóricas de la configuración electrónica, mostrando los orbitales individuales y la disposición de apareamiento de los electrones. Comenzamos con un solo átomo de hidrógeno (número atómico 1), que consiste en un protón y un electrón. Haciendo referencia a cualquiera de las Figuras\(\PageIndex{3}\) o\(\PageIndex{4}\), esperaríamos encontrar el electrón en el orbital de 1 s. Por convención, el\(m_s=+\dfrac{1}{2}\) valor suele llenarse primero. La configuración electrónica y el diagrama orbital son:
A continuación del hidrógeno se encuentra el helio de gas noble, que tiene un número atómico de 2. El átomo de helio contiene dos protones y dos electrones. El primer electrón tiene los mismos cuatro números cuánticos que el electrón del átomo de hidrógeno (n = 1, l = 0, m l = 0,\(m_s=+\dfrac{1}{2}\)). El segundo electrón también entra en el orbital de 1 s y lo llena. El segundo electrón tiene los mismos números cuánticos n, l, y m l, pero debe tener el número cuántico de espín opuesto,\(m_s=−\dfrac{1}{2}\). Esto está de acuerdo con el principio de exclusión de Pauli: No hay dos electrones en un mismo átomo que puedan tener el mismo conjunto de cuatro números cuánticos. Para los diagramas orbitales, esto significa que dos flechas van en cada caja (representando dos electrones en cada orbital) y las flechas deben apuntar en direcciones opuestas (representando espines emparejados). La configuración electrónica y el diagrama orbital del helio son:
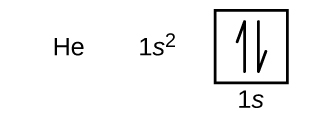
El caparazón n = 1 está completamente lleno en un átomo de helio.
El siguiente átomo es el litio de metal alcalino con un número atómico de 3. Los dos primeros electrones en litio llenan el orbital de 1 s y tienen los mismos conjuntos de cuatro números cuánticos que los dos electrones en helio. El electrón restante debe ocupar el orbital de la siguiente energía más baja, la orbital de 2 s (Figura\(\PageIndex{3}\) o\(\PageIndex{4}\)). Así, la configuración electrónica y el diagrama orbital del litio son:
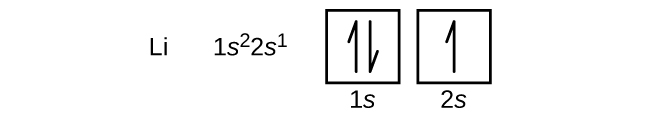
Un átomo del berilio de metal alcalinotérreo, con un número atómico de 4, contiene cuatro protones en el núcleo y cuatro electrones que rodean al núcleo. El cuarto electrón llena el espacio restante en el orbital de 2 s.
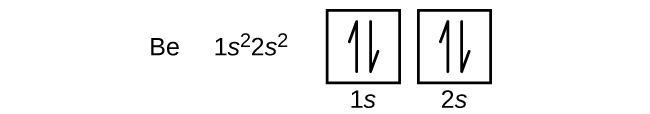
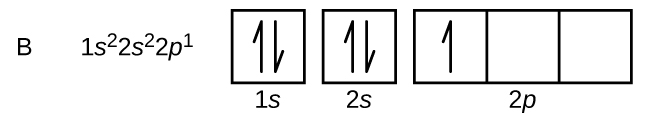
Un átomo de boro (número atómico 5) contiene cinco electrones. El caparazón n = 1 está lleno de dos electrones y tres electrones ocuparán el caparazón n = 2. Debido a que cualquier subcapa s puede contener sólo dos electrones, el quinto electrón debe ocupar el siguiente nivel de energía, que será un orbital de 2 p. Hay tres orbitales degenerados 2 p (m l = −1, 0, +1) y el electrón puede ocupar cualquiera de estos p orbitales. Al dibujar diagramas orbitales, incluimos cajas vacías para representar cualquier órbita vacía en la misma subcapa que estamos llenando.
El carbono (número atómico 6) tiene seis electrones. Cuatro de ellos llenan los orbitales de 1 s y 2 s. Los dos electrones restantes ocupan la subcapa de 2 p. Ahora tenemos la opción de llenar uno de los orbitales de 2 p y emparejar los electrones o dejar los electrones desapareados en dos orbitales p diferentes, pero degenerados. Los orbitales se llenan como lo describe la regla de Hund: la configuración de menor energía para un átomo con electrones dentro de un conjunto de orbitales degenerados es aquella que tiene el número máximo de electrones desapareados. Así, los dos electrones en los orbitales de carbono 2 p tienen números cuánticos n, l y m s idénticos y difieren en su número cuántico m l (de acuerdo con el principio de exclusión de Pauli). La configuración electrónica y el diagrama orbital para el carbono son:
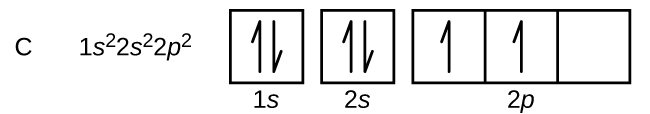
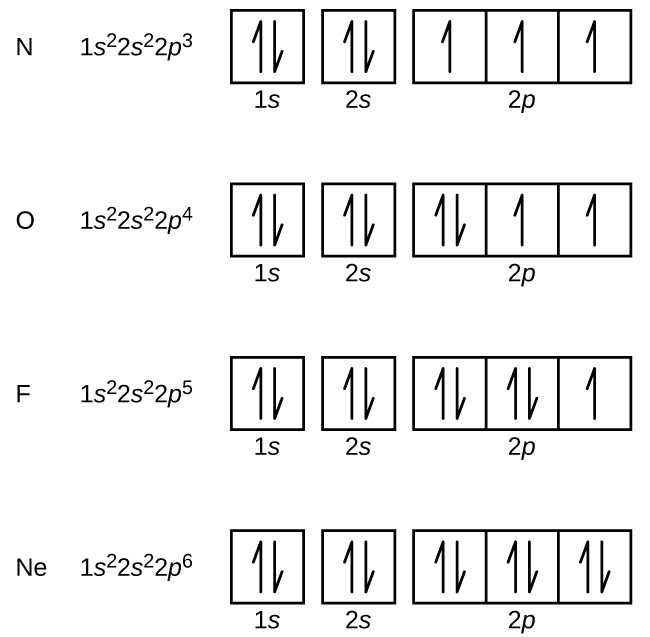
El nitrógeno (número atómico 7) llena las subconchas de 1 s y 2 s y tiene un electrón en cada uno de los tres orbitales de 2 p, de acuerdo con la regla de Hund. Estos tres electrones tienen giros desapareados. El oxígeno (número atómico 8) tiene un par de electrones en cualquiera de los orbitales de 2 p (los electrones tienen espines opuestos) y un solo electrón en cada uno de los otros dos. El flúor (número atómico 9) tiene solo un orbital de 2 p que contiene un electrón desapareado. Todos los electrones en el neón de gas noble (número atómico 10) están emparejados, y todos los orbitales en las conchas n = 1 y n = 2 están llenos. Las configuraciones de electrones y diagramas orbitales de estos cuatro elementos son:
El sodio de metal alcalino (número atómico 11) tiene un electrón más que el átomo de neón. Este electrón debe entrar en la subcapa de menor energía disponible, la orbital de 3 s, dando un 1 s 2 2 s 2 2 p 6 3 s 1 configuración. Los electrones que ocupan los orbitales de la capa más externa (valor más alto de n) se denominan electrones de valencia, y los que ocupan los orbitales de la capa interna se denominan electrones centrales (Figura\ PageIndex5\ PageIndex5). Dado que las capas de electrones centrales corresponden a configuraciones de electrones de gas noble, podemos abreviar configuraciones de electrones escribiendo el gas noble que coincide con la configuración de electrones centrales, junto con los electrones de valencia en un formato condensado. Para nuestro ejemplo de sodio, el símbolo [Ne] representa electrones centrales, (1 s 2 2 s 2 2 p 6) y nuestra configuración abreviada o condensada es [Ne] 3 s 1 .

De igual manera, la configuración abreviada del litio puede representarse como [He] 2 s 1, donde [He] representa la configuración del átomo de helio, que es idéntica a la de la capa interna llena de litio. Escribir las configuraciones de esta manera enfatiza la similitud de las configuraciones de litio y sodio. Ambos átomos, que están en la familia de los metales alcalinos, tienen solo un electrón en una subcapa de valencia fuera de un conjunto relleno de conchas internas.
\[\ce{Li:[He]}\,2s^1\\ \ce{Na:[Ne]}\,3s^1 \nonumber \]
El magnesio de metal alcalinotérreo (número atómico 12), con sus 12 electrones en una configuración [Ne] 3 s 2, es análogo a su miembro de la familia berilio, [He] 2 s 2. Ambos átomos tienen una subcapa s llena fuera de sus conchas internas rellenas. El aluminio (número atómico 13), con 13 electrones y la configuración de electrones [Ne] 3 s 2 3 p 1, es análogo a su miembro de la familia boro, [He] 2 s 2 2 p 1.
Las configuraciones electrónicas de silicio (14 electrones), fósforo (15 electrones), azufre (16 electrones), cloro (17 electrones) y argón (18 electrones) son análogas en las configuraciones electrónicas de sus capas externas a sus correspondientes miembros de la familia carbono, nitrógeno, oxígeno, flúor y neón, respectivamente, salvo que el número cuántico principal de la capa exterior de los elementos más pesados ha aumentado en uno a n = 3. La figura\(\PageIndex{6}\) muestra la configuración electrónica de menor energía, o estado fundamental, para estos elementos así como para los átomos de cada uno de los elementos conocidos.
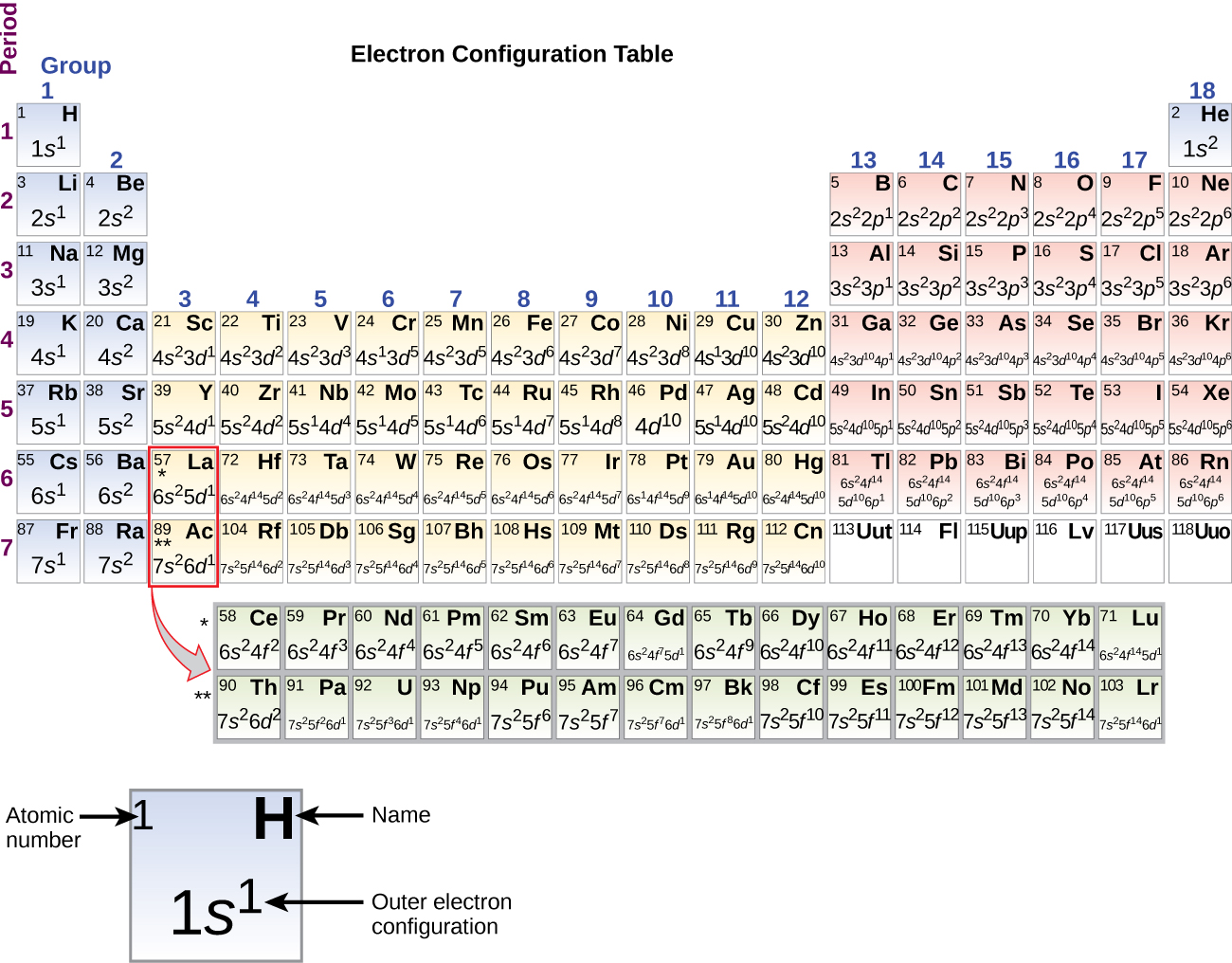
Cuando llegamos al siguiente elemento de la tabla periódica, el potasio de metal alcalino (número atómico 19), podríamos esperar que empezáramos a sumar electrones a la subcapa de 3 d. Sin embargo, toda la evidencia química y física disponible indica que el potasio es como el litio y el sodio, y que el siguiente electrón no se agrega al nivel de 3 d sino que, en cambio, se agrega al nivel de 4 s (Figura\(\PageIndex{3}\) o\(\PageIndex{4}\)). Como se discutió anteriormente, el orbital de 3 d sin nodos radiales es mayor en energía debido a que es menos penetrante y más blindado del núcleo que el 4 s, que tiene tres nodos radiales. Así, el potasio tiene una configuración electrónica de [Ar] 4 s 1. De ahí que el potasio corresponda a Li y Na en su configuración de concha de valencia. El siguiente electrón se agrega para completar la subcapa de 4 s y el calcio tiene una configuración electrónica de [Ar] 4 s 2. Esto le da al calcio una configuración electrónica de cubierta externa correspondiente a la del berilio y el magnesio.
Comenzando con el escandio de metal de transición (número atómico 21), se agregan electrones adicionales sucesivamente a la subcapa de 3 d. Esta subcapa se llena a su capacidad con 10 electrones (recuerde que para l = 2 [d orbitales], hay 2 l + 1 = 5 valores de m l, lo que significa que hay cinco d orbitales que tienen una capacidad combinada de 10 electrones). El subshell de 4 p se llena a continuación. Nótese que para tres series de elementos, el escandio (Sc) a través del cobre (Cu), el itrio (Y) a través de la plata (Ag) y el lutecio (Lu) a través del oro (Au), se agregan sucesivamente un total de 10 electrones d a la (n — 1) concha junto a la cáscara n para llevar eso (n — 1 ) shell de 8 a 18 electrones. Para dos series, se añaden sucesivamente lantano (La) a través de lutecio (Lu) y actinio (Ac) a través de Lrencium (Lr), 14 electrones f (l = 3, 2 l + 1 = 7 m l valores; así, siete orbitales con una capacidad combinada de 14 electrones) se agregan sucesivamente a la ( n — 2) para llevar esa concha de 18 electrones a un total de 32 electrones.
¿Cuál es la configuración electrónica y el diagrama orbital para un átomo de fósforo? ¿Cuáles son los cuatro números cuánticos para el último electrón agregado?
Solución
El número atómico de fósforo es 15. Así, un átomo de fósforo contiene 15 electrones. El orden de llenado de los niveles de energía es de 1 s, 2 s, 2 p, 3 s, 3 p, 4 s,. Los 15 electrones del átomo de fósforo se llenarán hasta el orbital de 3 p, que contendrá tres electrones:
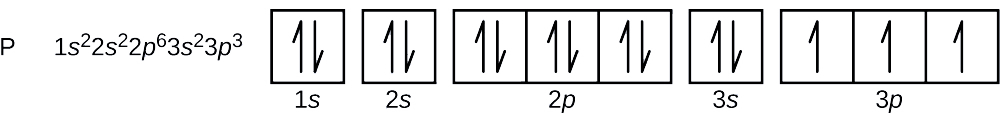
El último electrón agregado es un electrón de 3 p. Por lo tanto, n = 3 y, para una orbital de tipo p, l = 1. El valor m l podría ser —1, 0 o +1. Los tres orbitales p son degenerados, por lo que cualquiera de estos valores m l es correcto. Para electrones desapareados, convención asigna el valor de\(+\dfrac{1}{2}\) for the spin quantum number; thus, \(m_s=+\dfrac{1}{2}\).
Identify the atoms from the electron configurations given:
- [Ar]4s23d5
- [Kr]5s24d105p6
- Answer a
-
Mn
- Answer b
-
Xe
The periodic table can be a powerful tool in predicting the electron configuration of an element. However, we do find exceptions to the order of filling of orbitals that are shown in Figure \(\PageIndex{3}\) or \(\PageIndex{4}\). For instance, the electron configurations of the transition metals chromium (Cr; atomic number 24) and copper (Cu; atomic number 29), among others, are not those we would expect. In general, such exceptions involve subshells with very similar energy, and small effects can lead to changes in the order of filling.
In the case of Cr and Cu, we find that half-filled and completely filled subshells apparently represent conditions of preferred stability. This stability is such that an electron shifts from the 4s into the 3d orbital to gain the extra stability of a half-filled 3d subshell (in Cr) or a filled 3d subshell (in Cu). Other exceptions also occur. For example, niobium (Nb, atomic number 41) is predicted to have the electron configuration [Kr]5s24d3. Experimentally, we observe that its ground-state electron configuration is actually [Kr]5s14d4. We can rationalize this observation by saying that the electron–electron repulsions experienced by pairing the electrons in the 5s orbital are larger than the gap in energy between the 5s and 4d orbitals. There is no simple method to predict the exceptions for atoms where the magnitude of the repulsions between electrons is greater than the small differences in energy between subshells.
Electron Configurations and the Periodic Table
As described earlier, the periodic table arranges atoms based on increasing atomic number so that elements with the same chemical properties recur periodically. When their electron configurations are added to the table (Figure \(\PageIndex{6}\)), we also see a periodic recurrence of similar electron configurations in the outer shells of these elements. Because they are in the outer shells of an atom, valence electrons play the most important role in chemical reactions. The outer electrons have the highest energy of the electrons in an atom and are more easily lost or shared than the core electrons. Valence electrons are also the determining factor in some physical properties of the elements.
Elements in any one group (or column) have the same number of valence electrons; the alkali metals lithium and sodium each have only one valence electron, the alkaline earth metals beryllium and magnesium each have two, and the halogens fluorine and chlorine each have seven valence electrons. The similarity in chemical properties among elements of the same group occurs because they have the same number of valence electrons. It is the loss, gain, or sharing of valence electrons that defines how elements react.
It is important to remember that the periodic table was developed on the basis of the chemical behavior of the elements, well before any idea of their atomic structure was available. Now we can understand why the periodic table has the arrangement it has—the arrangement puts elements whose atoms have the same number of valence electrons in the same group. This arrangement is emphasized in Figure \(\PageIndex{6}\), which shows in periodic-table form the electron configuration of the last subshell to be filled by the Aufbau principle. The colored sections of Figure \(\PageIndex{6}\) show the three categories of elements classified by the orbitals being filled: main group, transition, and inner transition elements. These classifications determine which orbitals are counted in the valence shell, or highest energy level orbitals of an atom.
- Main group elements (sometimes called representative elements) are those in which the last electron added enters an s or a p orbital in the outermost shell, shown in blue and red in Figure \(\PageIndex{6}\). This category includes all the nonmetallic elements, as well as many metals and the intermediate semimetallic elements. The valence electrons for main group elements are those with the highest n level. For example, gallium (Ga, atomic number 31) has the electron configuration [Ar]4s23d104p1, which contains three valence electrons (underlined). The completely filled d orbitals count as core, not valence, electrons.
- Transition elements or transition metals. These are metallic elements in which the last electron added enters a d orbital. The valence electrons (those added after the last noble gas configuration) in these elements include the ns and (n – 1) d electrons. The official IUPAC definition of transition elements specifies those with partially filled d orbitals. Thus, the elements with completely filled orbitals (Zn, Cd, Hg, as well as Cu, Ag, and Au in Figure \(\PageIndex{6}\)) are not technically transition elements. However, the term is frequently used to refer to the entire d block (colored yellow in Figure \(\PageIndex{6}\)), and we will adopt this usage in this textbook.
- Inner transition elements are metallic elements in which the last electron added occupies an f orbital. They are shown in green in Figure \(\PageIndex{6}\). The valence shells of the inner transition elements consist of the (n – 2)f, the (n – 1)d, and the ns subshells. There are two inner transition series:
- The lanthanide series: lanthanide (La) through lutetium (Lu)
- The actinide series: actinide (Ac) through lawrencium (Lr)
Lanthanum and actinium, because of their similarities to the other members of the series, are included and used to name the series, even though they are transition metals with no f electrons.
Electron Configurations of Ions
We have seen that ions are formed when atoms gain or lose electrons. A cation (positively charged ion) forms when one or more electrons are removed from a parent atom. For main group elements, the electrons that were added last are the first electrons removed. For transition metals and inner transition metals, however, electrons in the s orbital are easier to remove than the d or f electrons, and so the highest ns electrons are lost, and then the (n – 1)d or (n – 2)f electrons are removed. An anion (negatively charged ion) forms when one or more electrons are added to a parent atom. The added electrons fill in the order predicted by the Aufbau principle.
What is the electron configuration and orbital diagram of:
- Na+
- P3–
- Al2+
- Fe2+
- Sm3+
Solution
First, write out the electron configuration for each parent atom. We have chosen to show the full, unabbreviated configurations to provide more practice for students who want it, but listing the core-abbreviated electron configurations is also acceptable.
Next, determine whether an electron is gained or lost. Remember electrons are negatively charged, so ions with a positive charge have lost an electron. For main group elements, the last orbital gains or loses the electron. For transition metals, the last s orbital loses an electron before the d orbitals.
- Na: 1s22s22p63s1. Sodium cation loses one electron, so Na+: 1s22s22p63s1 = Na+: 1s22s22p6.
- P: 1s22s22p63s23p3. Phosphorus trianion gains three electrons, so P3−: 1s22s22p63s23p6.
- Al: 1s22s22p63s23p1. Aluminum dication loses two electrons Al2+: 1s22s22p63s23p1 = Al2+: 1s22s22p63s1.
- Fe: 1s22s22p63s23p64s23d6. Iron(II) loses two electrons and, since it is a transition metal, they are removed from the 4s orbital Fe2+: 1s22s22p63s23p64s23d6 = 1s22s22p63s23p63d6.
- Sm: 1s22s22p63s23p64s23d104p65s24d105p66s24f6. Samarium trication loses three electrons. The first two will be lost from the 6s orbital, and the final one is removed from the 4f orbital. Sm3+: 1s22s22p63s23p64s23d104p65s24d105p66s24f6 = 1s22s22p63s23p64s23d104p65s24d105p64f5.
- Which ion with a +2 charge has the electron configuration 1s22s22p63s23p63d104s24p64d5?
- Which ion with a +3 charge has this configuration?
- Answer a
-
Tc2+
- Answer b
-
Ru3+
Summary
The relative energy of the subshells determine the order in which atomic orbitals are filled (1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, and so on). Electron configurations and orbital diagrams can be determined by applying the Pauli exclusion principle (no two electrons can have the same set of four quantum numbers) and Hund’s rule (whenever possible, electrons retain unpaired spins in degenerate orbitals).
Electrons in the outermost orbitals, called valence electrons, are responsible for most of the chemical behavior of elements. In the periodic table, elements with analogous valence electron configurations usually occur within the same group. There are some exceptions to the predicted filling order, particularly when half-filled or completely filled orbitals can be formed. The periodic table can be divided into three categories based on the orbital in which the last electron to be added is placed: main group elements (s and p orbitals), transition elements (d orbitals), and inner transition elements (f orbitals).
Glossary
- Aufbau principle
- procedure in which the electron configuration of the elements is determined by “building” them in order of atomic numbers, adding one proton to the nucleus and one electron to the proper subshell at a time
- core electron
- electron in an atom that occupies the orbitals of the inner shells
- electron configuration
- electronic structure of an atom in its ground state given as a listing of the orbitals occupied by the electrons
- Hund’s rule
- every orbital in a subshell is singly occupied with one electron before any one orbital is doubly occupied, and all electrons in singly occupied orbitals have the same spin
- orbital diagram
- pictorial representation of the electron configuration showing each orbital as a box and each electron as an arrow
- valence electrons
- electrons in the outermost or valence shell (highest value of n) of a ground-state atom; determine how an element reacts
- valence shell
- outermost shell of electrons in a ground-state atom; for main group elements, the orbitals with the highest n level (s and p subshells) are in the valence shell, while for transition metals, the highest energy s and d subshells make up the valence shell and for inner transition elements, the highest s, d, and f subshells are included


