17.3: Potenciales de reducción estándar
- Page ID
- 75226
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Determinar los potenciales celulares estándar para reacciones de oxidación-reducción
- Utilice potenciales de reducción estándar para determinar el mejor agente oxidante o reductor entre varias opciones posibles
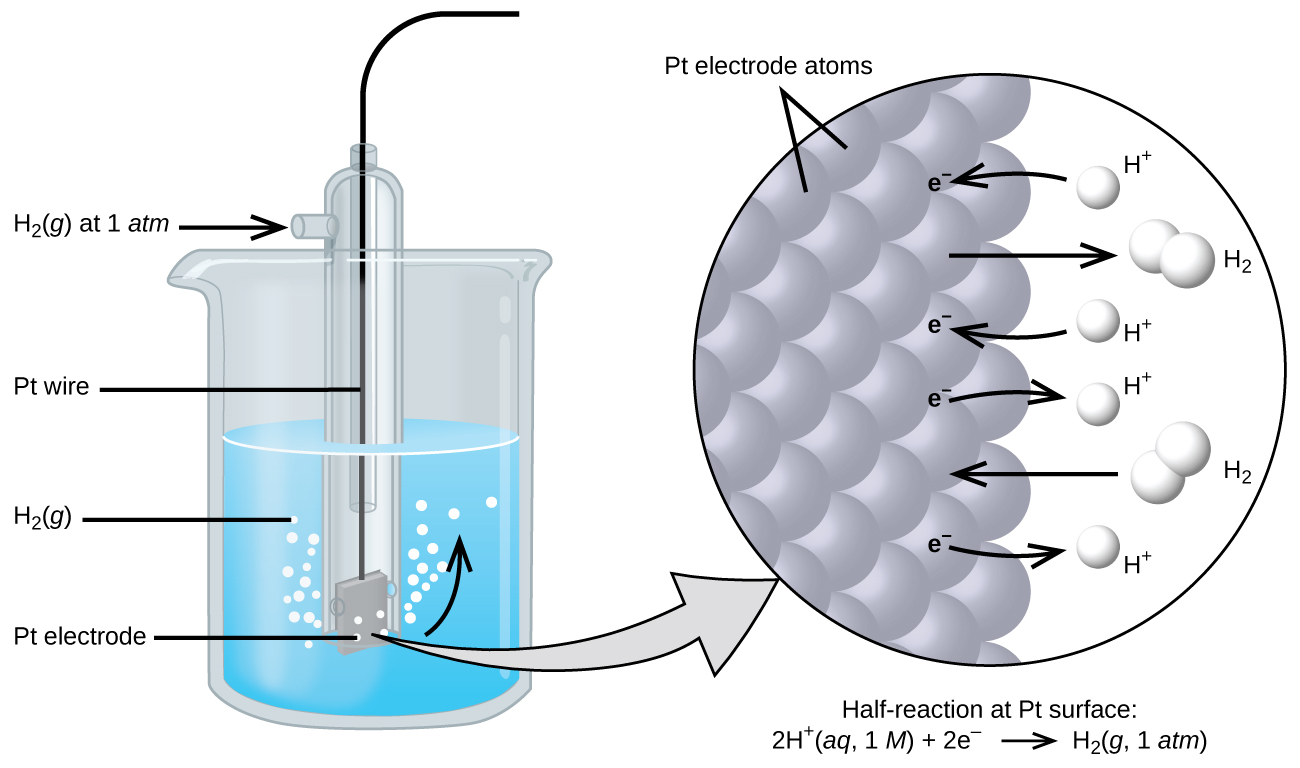
El potencial celular resulta de la diferencia en los potenciales eléctricos para cada electrodo. Si bien es imposible determinar el potencial eléctrico de un solo electrodo, podemos asignarle a un electrodo el valor de cero y luego usarlo como referencia. El electrodo elegido como cero se muestra en la Figura 17.4.1 y se denomina electrodo de hidrógeno estándar (SHE). El SHE consiste en 1 atm de gas hidrógeno burbujeado a través de una solución de HCl 1 M, generalmente a temperatura ambiente. El platino, que es químicamente inerte, se utiliza como electrodo. La media reacción de reducción elegida como referencia es
\[\ce{2H+}(aq,\: 1\:M)+\ce{2e-}⇌\ce{H2}(g,\:1\: \ce{atm}) \hspace{20px} E°=\mathrm{0\: V} \nonumber \]
E° es el potencial de reducción estándar. El superíndice “°” en la E denota condiciones estándar (1 bar o 1 atm para gases, 1 M para solutos). El voltaje se define como cero para todas las temperaturas.
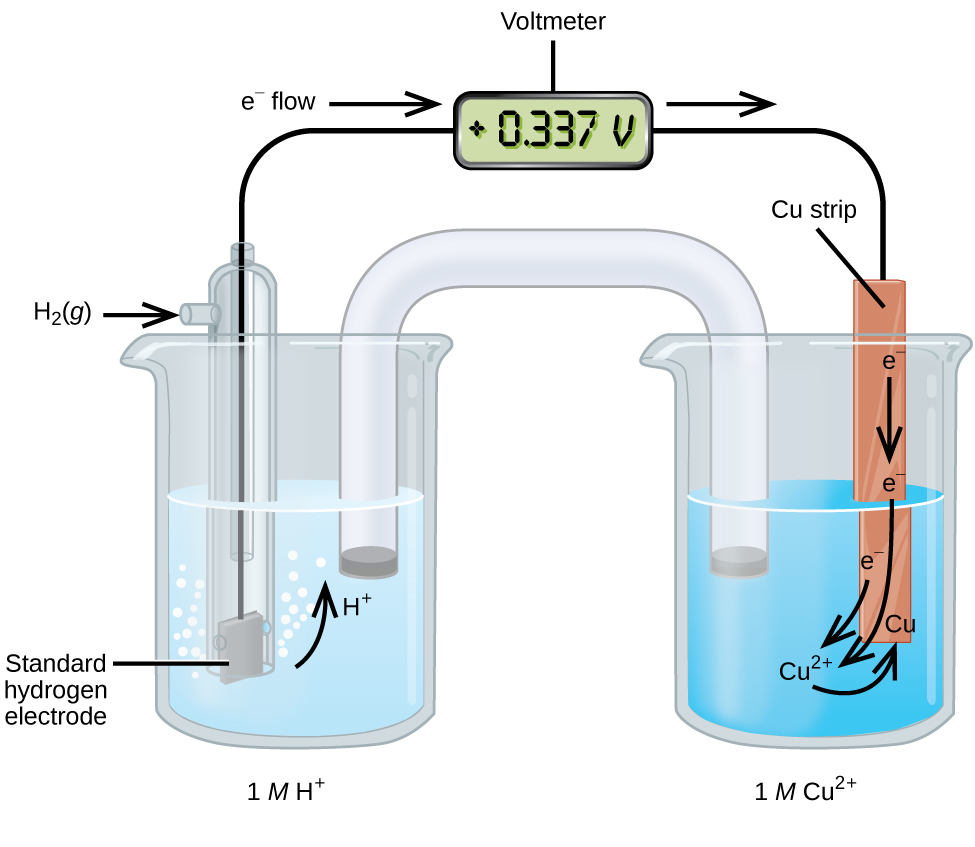
Se puede utilizar una celda galvánica compuesta por una semicelda SHE y Cu 2 + /Cu para determinar el potencial de reducción estándar para Cu 2 + (Figura\(\PageIndex{2}\)). En notación celular, la reacción es
\[\ce{Pt}(s)│\ce{H2}(g,\:1\: \ce{atm})│\ce{H+}(aq,\:1\:M)║\ce{Cu^2+}(aq,\:1\:M)│\ce{Cu}(s) \nonumber \]
Los electrones fluyen desde el ánodo hasta el cátodo. Las reacciones, que son reversibles, son
\ [\ begin {alinear*}
&\ textrm {Ánodo (oxidación):}\ ce {H2} (g) ⟶\ ce {2H+} (aq) +\ ce {2e-}\\
&\ textrm {cátodo (reducción):}\ ce {Cu^2+} (aq) +\ ce {2e-} ⟶\ ce {Cu} (s)\\
&\ overline {textrm {General:}\ ce {Cu^2+} (aq) +\ ce {H2} (g) ⟶\ ce {2H+} (aq) +\ ce {Cu} (s)}
\ end {align* }\ nonumber\]
El potencial de reducción estándar se puede determinar restando el potencial de reducción estándar para la reacción que ocurre en el ánodo del potencial de reducción estándar para la reacción que ocurre en el cátodo. El signo menos es necesario porque la oxidación es la inversa de la reducción.
\[E^\circ_\ce{cell}=E^\circ_\ce{cathode}−E^\circ_\ce{anode} \nonumber \]
\[\mathrm{+0.34\: V}=E^\circ_{\ce{Cu^2+/Cu}}−E^\circ_{\ce{H+/H2}}=E^\circ_{\ce{Cu^2+/Cu}}−0=E^\circ_{\ce{Cu^2+/Cu}} \nonumber \]
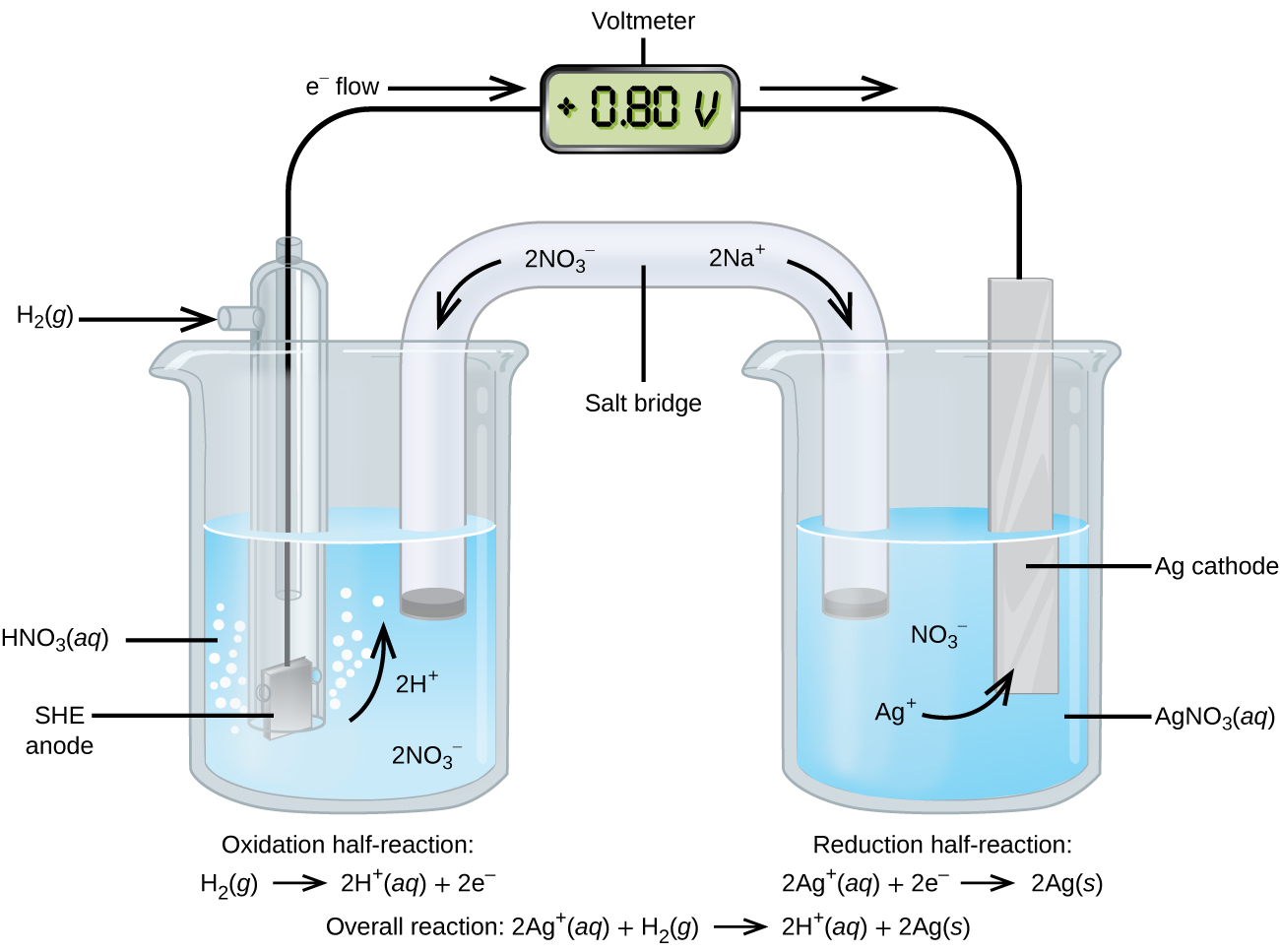
Usando la SHE como referencia, se pueden determinar otros potenciales de reducción estándar. Considere la celda que se muestra en la Figura\(\PageIndex{2}\), donde
\[\ce{Pt}(s)│\ce{H2}(g,\:1\: \ce{atm})│\ce{H+}(aq,\: 1\:M)║\ce{Ag+}(aq,\: 1\:M)│\ce{Ag}(s) \nonumber \]
Los electrones fluyen de izquierda a derecha, y las reacciones son
\ [\ begin {alinear*}
&\ textrm {ánodo (oxidación):}\ ce {H2} (g) ⟶\ ce {2H+} (aq) +\ ce {2e-}\\
&\ textrm {cátodo (reducción):}\ ce {2Ag+} (aq) +\ ce {2e-} ⟶\ ce {2Ag} (s)\\
&\ overline\ textrm {general:}\ ce {2Ag+} (aq) +\ ce {H2} (g) ⟶\ ce {2H+} (aq) +\ ce {2Ag} (s)}
\ end {align*} \ nonumber\]
El potencial de reducción estándar se puede determinar restando el potencial de reducción estándar para la reacción que ocurre en el ánodo del potencial de reducción estándar para la reacción que ocurre en el cátodo. El signo menos es necesario porque la oxidación es la inversa de la reducción.
\[E^\circ_\ce{cell}=E^\circ_\ce{cathode}−E^\circ_\ce{anode} \nonumber \]
\[\mathrm{+0.80\: V}=E^\circ_{\ce{Ag+/Ag}}−E^\circ_{\ce{H+/H2}}=E^\circ_{\ce{Ag+/Ag}}−0=E^\circ_{\ce{Ag+/Ag}} \nonumber \]
Es importante señalar que el potencial no se duplica para la reacción catódica.
La SHE es bastante peligrosa y rara vez se usa en el laboratorio. Su principal significación es que estableció el cero para los potenciales de reducción estándar. Una vez determinados, los potenciales de reducción estándar pueden ser utilizados para determinar el potencial celular estándar,\(E^\circ_\ce{cell}\), para cualquier célula. Por ejemplo, para la siguiente celda:
\[\ce{Cu}(s)│\ce{Cu^2+}(aq,\:1\:M)║\ce{Ag+}(aq,\:1\:M)│\ce{Ag}(s) \nonumber \]
\ [\ begin {alinear*}
&\ textrm {ánodo (oxidación):}\ ce {Cu} (s) ⟶\ ce {Cu^2+} (aq) +\ ce {2e-}\\
&\ textrm {cátodo (reducción):}\ ce {2Ag+} (aq) +\ ce {2e-} ⟶\ ce {2Ag} (s)\\
&\ overline\ textrm {general:}\ ce {Cu} (s) +\ ce {2Ag+} (aq) ⟶\ ce {Cu^2+} (aq) +\ ce {2Ag} (s)}
\ end { alinear*}\ nonumber\]
\[E^\circ_\ce{cell}=E^\circ_\ce{cathode}−E^\circ_\ce{anode}=E^\circ_{\ce{Ag+/Ag}}−E^\circ_{\ce{Cu^2+/Cu}}=\mathrm{0.80\: V−0.34\: V=0.46\: V} \nonumber \]
Nuevamente, tenga en cuenta que al calcular\(E^\circ_\ce{cell}\), los potenciales de reducción estándar siempre permanecen los mismos incluso cuando una media reacción se multiplica por un factor. Los potenciales de reducción estándar para reacciones de reducción seleccionadas se muestran en la Tabla\(\PageIndex{1}\). Se proporciona una lista más completa en las Tablas P1 o P2.
| Media reacción | E° (V) |
|---|---|
| \(\ce{F2}(g)+\ce{2e-}⟶\ce{2F-}(aq)\) | +2.866 |
| \(\ce{PbO2}(s)+\ce{SO4^2-}(aq)+\ce{4H+}(aq)+\ce{2e-}⟶\ce{PbSO4}(s)+\ce{2H2O}(l)\) | +1.69 |
| \(\ce{MnO4-}(aq)+\ce{8H+}(aq)+\ce{5e-}⟶\ce{Mn^2+}(aq)+\ce{4H2O}(l)\) | +1.507 |
| \(\ce{Au^3+}(aq)+\ce{3e-}⟶\ce{Au}(s)\) | +1.498 |
| \(\ce{Cl2}(g)+\ce{2e-}⟶\ce{2Cl-}(aq)\) | +1.35827 |
| \(\ce{O2}(g)+\ce{4H+}(aq)+\ce{4e-}⟶\ce{2H2O}(l)\) | +1.229 |
| \(\ce{Pt^2+}(aq)+\ce{2e-}⟶\ce{Pt}(s)\) | +1.20 |
| \(\ce{Br2}(aq)+\ce{2e-}⟶\ce{2Br-}(aq)\) | +1.0873 |
| \(\ce{Ag+}(aq)+\ce{e-}⟶\ce{Ag}(s)\) | +0.7996 |
| \(\ce{Hg2^2+}(aq)+\ce{2e-}⟶\ce{2Hg}(l)\) | +0.7973 |
| \(\ce{Fe^3+}(aq)+\ce{e-}⟶\ce{Fe^2+}(aq)\) | +0.771 |
| \(\ce{MnO4-}(aq)+\ce{2H2O}(l)+\ce{3e-}⟶\ce{MnO2}(s)+\ce{4OH-}(aq)\) | +0.558 |
| \(\ce{I2}(s)+\ce{2e-}⟶\ce{2I-}(aq)\) | +0.5355 |
| \(\ce{NiO2}(s)+\ce{2H2O}(l)+\ce{2e-}⟶\ce{Ni(OH)2}(s)+\ce{2OH-}(aq)\) | +0.49 |
| \(\ce{Cu^2+}(aq)+\ce{2e-}⟶\ce{Cu}(s)\) | +0.34 |
| \(\ce{Hg2Cl2}(s)+\ce{2e-}⟶\ce{2Hg}(l)+\ce{2Cl-}(aq)\) | +0.26808 |
| \(\ce{AgCl}(s)+\ce{e-}⟶\ce{Ag}(s)+\ce{Cl-}(aq)\) | +0.22233 |
| \(\ce{Sn^4+}(aq)+\ce{2e-}⟶\ce{Sn^2+}(aq)\) | +0.151 |
| \(\ce{2H+}(aq)+\ce{2e-}⟶\ce{H2}(g)\) | 0.00 |
| \(\ce{Pb^2+}(aq)+\ce{2e-}⟶\ce{Pb}(s)\) | −0.1262 |
| \(\ce{Sn^2+}(aq)+\ce{2e-}⟶\ce{Sn}(s)\) | −0.1375 |
| \(\ce{Ni^2+}(aq)+\ce{2e-}⟶\ce{Ni}(s)\) | −0.257 |
| \(\ce{Co^2+}(aq)+\ce{2e-}⟶\ce{Co}(s)\) | −0.28 |
| \(\ce{PbSO4}(s)+\ce{2e-}⟶\ce{Pb}(s)+\ce{SO4^2-}(aq)\) | −0.3505 |
| \(\ce{Cd^2+}(aq)+\ce{2e-}⟶\ce{Cd}(s)\) | −0.4030 |
| \(\ce{Fe^2+}(aq)+\ce{2e-}⟶\ce{Fe}(s)\) | −0.447 |
| \(\ce{Cr^3+}(aq)+\ce{3e-}⟶\ce{Cr}(s)\) | −0.744 |
| \(\ce{Mn^2+}(aq)+\ce{2e-}⟶\ce{Mn}(s)\) | −1.185 |
| \(\ce{Zn(OH)2}(s)+\ce{2e-}⟶\ce{Zn}(s)+\ce{2OH-}(aq)\) | −1.245 |
| \(\ce{Zn^2+}(aq)+\ce{2e-}⟶\ce{Zn}(s)\) | −0.7618 |
| \(\ce{Al^3+}(aq)+\ce{3e-}⟶\ce{Al}(s)\) | −1.662 |
| \(\ce{Mg^2+}(aq)+\ce{2e-}⟶\ce{Mg}(s)\) | −2.372 |
| \(\ce{Na+}(aq)+\ce{e-}⟶\ce{Na}(s)\) | −2.71 |
| \(\ce{Ca^2+}(aq)+\ce{2e-}⟶\ce{Ca}(s)\) | −2.868 |
| \(\ce{Ba^2+}(aq)+\ce{2e-}⟶\ce{Ba}(s)\) | −2.912 |
| \(\ce{K+}(aq)+\ce{e-}⟶\ce{K}(s)\) | −2.931 |
| \(\ce{Li+}(aq)+\ce{e-}⟶\ce{Li}(s)\) | −3.04 |
Tablas como esta permiten determinar el potencial celular estándar para muchas reacciones de oxidación-reducción.
¿Cuál es el potencial de celda estándar para una celda galvánica que consiste en medias celdas Au 3 + /Au y Ni 2 + /Ni? Identificar los agentes oxidantes y reductores.
Solución
Usando Table\(\PageIndex{1}\), las reacciones involucradas en la celda galvánica, ambas escritas como reducciones, son
\[\ce{Au^3+}(aq)+\ce{3e-}⟶\ce{Au}(s) \hspace{20px} E^\circ_{\ce{Au^3+/Au}}=\mathrm{+1.498\: V} \nonumber \]
\[\ce{Ni^2+}(aq)+\ce{2e-}⟶\ce{Ni}(s) \hspace{20px} E^\circ_{\ce{Ni^2+/Ni}}=\mathrm{−0.257\: V} \nonumber \]
Las células galvánicas tienen potenciales celulares positivos, y todas las reacciones de reducción son reversibles. La reacción en el ánodo será la semirreacción con el potencial de reducción estándar más pequeño o más negativo. La inversión de la reacción en el ánodo (para mostrar la oxidación) pero no su potencial de reducción estándar da:
\ [\ begin {alinear*}
&\ textrm {ánodo (oxidación):}\ ce {Ni} (s) ⟶\ ce {Ni^2+} (aq) +\ ce {2e-}\ hspace {20px} E^\ circ_\ ce {ánodo} =E^\ circ_ {\ ce {\ ce {Ni^2+/Ni}} =\ mathrm {−0.257\: V}\\
&\ textrm {Cátodo (reducción):}\ ce {Au^3+} (aq) +\ ce {3e-} ⟶\ ce {Au} (s)\ hspace {20px} E^\ circ_\ ce {cátodo} =E^\ circ_ {\ ce {Au ^3+/Au}} =\ mathrm {+1.498\: V}
\ final {alinear*}\ nonumber\]
El factor menos común es seis, por lo que la reacción general es
Los potenciales de reducción no son escalados por los coeficientes estequiométricos al calcular el potencial celular, y se deben usar los potenciales de reducción estándar no modificados.
\[E^\circ_\ce{cell}=E^\circ_\ce{cathode}−E^\circ_\ce{anode}=\mathrm{1.498\: V−(−0.257\: V)=1.755\: V} \nonumber \]
De las medias reacciones, el Ni se oxida, por lo que es el agente reductor, y el Au 3 + se reduce, por lo que es el agente oxidante.
Una celda galvánica consiste en un electrodo de Mg en solución 1 M de Mg (NO 3) 2 y un electrodo de Ag en solución 1 M de AgnO 3. Calcular el potencial celular estándar a 25 °C.
- Responder
-
\[\ce{Mg}(s)+\ce{2Ag+}(aq)⟶\ce{Mg^2+}(aq)+\ce{2Ag}(s) \hspace{20px} E^\circ_\ce{cell}=\mathrm{0.7996\: V−(−2.372\: V)=3.172\: V} \nonumber \]
Resumen
La asignación del potencial del electrodo de hidrógeno estándar (SHE) como cero voltios permite la determinación de potenciales de reducción estándar, E°, para semi-reacciones en celdas electroquímicas. Como su nombre lo indica, los potenciales de reducción estándar utilizan estados estándar (1 bar o 1 atm para los gases; 1 M para los solutos, a menudo a 298.15 K) y se escriben como reducciones (donde los electrones aparecen en el lado izquierdo de la ecuación). Las reacciones de reducción son reversibles, por lo que los potenciales celulares estándar se pueden calcular restando el potencial de reducción estándar para la reacción en el ánodo de la reducción estándar para la reacción en el cátodo. Al calcular el potencial celular estándar, los potenciales de reducción estándar no son escalados por los coeficientes estequiométricos en la ecuación global equilibrada.
Ecuaciones Clave
- \(E^\circ_\ce{cell}=E^\circ_\ce{cathode}−E^\circ_\ce{anode}\)
Glosario
- potencial celular estándar\( (E^\circ_\ce{cell})\)
- el potencial de celda cuando todos los reactivos y productos están en sus estados estándar (1 bar o 1 atm o gases; 1 M para solutos), generalmente a 298.15 K; puede calcularse restando el potencial de reducción estándar para la semirreacción en el ánodo del potencial de reducción estándar para la mitad de la reacción en el ánodo del potencial de reducción estándar para la mitad reacción que ocurre en el cátodo
- electrodo de hidrógeno estándar (SHE)
- el electrodo consiste en gas hidrógeno burbujeando a través de ácido clorhídrico sobre un electrodo inerte de platino cuya reducción en condiciones estándar se le asigna un valor de 0 V; el punto de referencia para los potenciales de reducción estándar
- potencial de reducción estándar (E°)
- el valor de la reducción en condiciones estándar (1 bar o 1 atm para los gases; 1 M para los solutos) generalmente a 298.15 K; valores tabulados utilizados para calcular potenciales celulares estándar


