17.2: Celdas galvánicas
- Page ID
- 75255
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Usar notación de celdas para describir celdas galvánicas
- Describir los componentes básicos de las celdas galvánicas
Las celdas galvánicas, también conocidas como celdas voltaicas, son celdas electroquímicas en las que las reacciones espontáneas de oxidación-reducción producen energía eléctrica. Al escribir las ecuaciones, a menudo es conveniente separar las reacciones de oxidación-reducción en medias reacciones para facilitar el equilibrio de la ecuación general y enfatizar las transformaciones químicas reales.
Considera lo que sucede cuando se coloca una pieza limpia de cobre metálico en una solución de nitrato de plata (Figura\(\PageIndex{1}\)). Tan pronto como se agrega el metal cobre, el metal plateado comienza a formarse y los iones de cobre pasan a la solución. El color azul de la solución en el extremo derecho indica la presencia de iones cobre. La reacción puede dividirse en sus dos medias reacciones. Las medias reacciones separan la oxidación de la reducción, por lo que cada una puede considerarse individualmente.
\ [\ begin {align}
&\ textrm {oxidación:}\ ce {Cu} (s) ⟶\ ce {Cu^2+} (aq) +\ ce {2e-}\\
&\ subrayado {\ textrm {reducción:} 2× (\ ce {Ag+} (aq) +\ ce {e-} ⟶\ ce {Ag} (s))\ hspace {40px}\ ce {o}\ hspace {40px}\ ce {2Ag+} (aq) +\ ce {2e-} ⟶\ ce {2Ag} (s)}\\
&\ textrm {general:}\ ce {2Ag+} (aq) +\ ce {Cu} (s) ⟶\ ce {2Ag} (s) +\ ce {Cu^2+} (aq)
\ end {align}\ nonumber\]
La ecuación para la media reacción de reducción tuvo que duplicarse por lo que el número de electrones “ganados” en la semirreacción de reducción igualó el número de electrones “perdidos” en la semirreacción de oxidación.

Las celdas galvánicas o voltáicas implican reacciones electroquímicas espontáneas en las que las medias reacciones se separan (Figura\(\PageIndex{2}\)) para que la corriente pueda fluir a través de un cable externo. El vaso de precipitados del lado izquierdo de la figura se llama media celda, y contiene una solución 1 M de nitrato de cobre (II) [Cu (NO 3) 2] con un trozo de cobre metálico parcialmente sumergido en la solución. El metal de cobre es un electrodo. El cobre está en proceso de oxidación; por lo tanto, el electrodo de cobre es el ánodo. El ánodo está conectado a un voltímetro con un cable y el otro terminal del voltímetro está conectado a un electrodo de plata por un cable. La plata está en proceso de reducción; por lo tanto, el electrodo de plata es el cátodo. La media celda del lado derecho de la figura consiste en el electrodo de plata en una solución 1 M de nitrato de plata (AgnO 3). En este punto, no hay flujos de corriente, es decir, no se produce ningún movimiento significativo de electrones a través del cable porque el circuito está abierto. El circuito se cierra mediante un puente salino, que transmite la corriente con iones en movimiento. El puente salino consiste en una solución concentrada, no reactiva, electrolítica como la solución de nitrato de sodio (NaNO 3) utilizada en este ejemplo. A medida que los electrones fluyen de izquierda a derecha a través del electrodo y el cable, los iones nitrato (aniones) pasan a través del tapón poroso de la izquierda hacia la solución de nitrato de cobre (II). Esto mantiene el vaso de precipitados de la izquierda eléctricamente neutro al neutralizar la carga en los iones de cobre (II) que se producen en la solución a medida que el metal de cobre se oxida. Al mismo tiempo, los iones nitrato se mueven hacia la izquierda, los iones de sodio (cationes) se mueven hacia la derecha, a través del tapón poroso, y hacia la solución de nitrato de plata a la derecha. Estos cationes añadidos “reemplazan” los iones de plata que se eliminan de la solución ya que se redujeron a metal plateado, manteniendo el vaso de precipitados a la derecha eléctricamente neutro. Sin el puente de sal, los compartimentos no permanecerían eléctricamente neutros y ninguna corriente significativa fluiría. Sin embargo, si los dos compartimentos están en contacto directo, no es necesario un puente salino. En el instante en que se completa el circuito, el voltímetro lee +0.46 V, esto se llama potencial de celda. El potencial celular se crea cuando se conectan los dos metales diferentes, y es una medida de la energía por unidad de carga disponible de la reacción de oxidación-reducción. El voltio es la unidad SI derivada para el potencial eléctrico
\[\mathrm{volt=\mathit{V}=\dfrac{J}{C}} \nonumber \]
En esta ecuación, A es la corriente en amperios y C la carga en culombios. Tenga en cuenta que los voltios deben multiplicarse por la carga en culombios (C) para obtener la energía en julios (J).
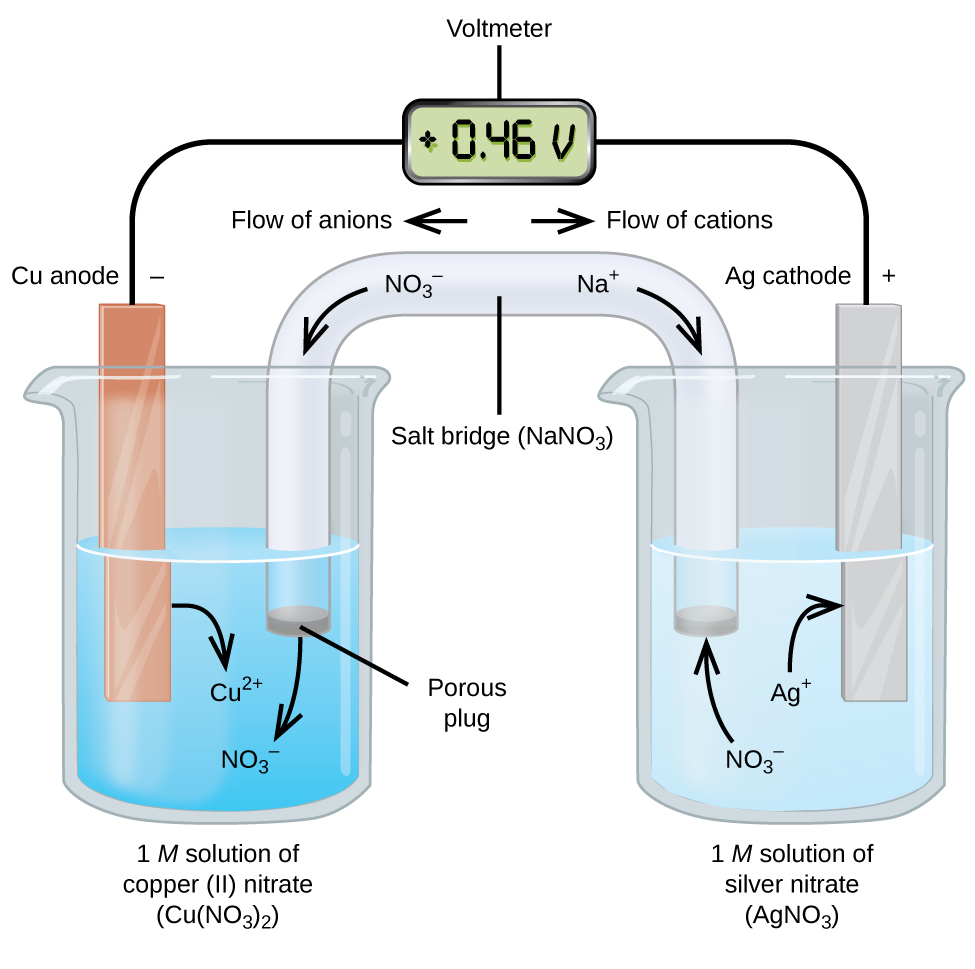
Cuando la celda electroquímica se construye de esta manera, un potencial celular positivo indica una reacción espontánea y que los electrones fluyen de izquierda a derecha. Hay mucho que hacer en Figura\(\PageIndex{2}\), por lo que es útil resumir cosas para este sistema:
- Los electrones fluyen del ánodo al cátodo: de izquierda a derecha en la celda galvánica estándar en la figura.
- El electrodo en la semicelda izquierda es el ánodo porque aquí se produce la oxidación. El nombre hace referencia al flujo de aniones en el puente salino hacia él.
- El electrodo en la semicelda derecha es el cátodo porque aquí se produce la reducción. El nombre hace referencia al flujo de cationes en el puente salino hacia él.
- La oxidación ocurre en el ánodo (la semicelda izquierda en la figura).
- La reducción ocurre en el cátodo (la semicelda derecha en la figura).
- El potencial celular, +0.46 V, en este caso, resulta de las diferencias inherentes en la naturaleza de los materiales utilizados para hacer las dos medias celdas.
- El puente salino debe estar presente para cerrar (completar) el circuito y se debe producir tanto una oxidación como una reducción para que la corriente fluya.
Hay muchas celdas galvánicas posibles, por lo que se suele utilizar una notación taquigráfica para describirlas. La notación celular (a veces llamada diagrama de celdas) proporciona información sobre las diversas especies involucradas en la reacción. Esta notación también funciona para otros tipos de celdas. Una línea vertical, │, denota un límite de fase y una línea doble,”, el puente de sal. La información sobre el ánodo se escribe a la izquierda, seguida de la solución del ánodo, luego el puente de sal (cuando está presente), luego la solución del cátodo y, finalmente, la información sobre el cátodo a la derecha. La notación de celda para la celda galvánica en la Figura\(\PageIndex{2}\) es entonces
\[\ce{Cu}(s)│\ce{Cu^2+}(aq,\: 1\:M)║\ce{Ag+}(aq,\: 1\:M)│\ce{Ag}(s) \nonumber \]
Obsérvese que los iones del espectador no están incluidos y que se utilizó la forma más simple de cada media reacción. Cuando se conocen, generalmente se incluyen las concentraciones iniciales de los diversos iones.
Una de las celdas más simples es la de Daniell. Es posible construir esta batería colocando un electrodo de cobre en el fondo de un frasco y cubriendo el metal con una solución de sulfato de cobre. Una solución de sulfato de zinc se hace flotar sobre la solución de sulfato de cobre; luego se coloca un electrodo de zinc en la solución de sulfato de zinc. Conectar el electrodo de cobre al electrodo de zinc permite que fluya una corriente eléctrica. Este es un ejemplo de una célula sin un puente de sal, y los iones pueden fluir a través de la interfaz entre las dos soluciones.
Algunas reacciones de oxidación-reducción involucran especies que son pobres conductores de electricidad, por lo que se usa un electrodo que no participa en las reacciones. Frecuentemente, el electrodo es platino, oro o grafito, todos los cuales son inertes a muchas reacciones químicas. Uno de tales sistemas se muestra en la Figura\(\PageIndex{3}\). El magnesio sufre oxidación en el ánodo de la izquierda en la figura y los iones de hidrógeno experimentan reducción en el cátodo de la derecha. La reacción puede resumirse como
\ [\ begin {align}
&\ textrm {oxidación:}\ ce {Mg} (s) ⟶\ ce {Mg^2+} (aq) +\ ce {2e-}\\
&\ textrm {reducción:}\ ce {2H+} (aq) +\ ce {2e-} ⟶\ ce {H2} (g)\\
&\ overline {\ textrm {global:}\ ce {Mg} (s) +\ ce {2H+} (aq) ⟶\ ce {Mg^2+} (aq) +\ ce {H2} (g)}
\ end {align}\ nonumber\]
La celda utilizó un alambre de platino inerte para el cátodo, por lo que la notación de celda es
\[\ce{Mg}(s)│\ce{Mg^2+}(aq)║\ce{H+}(aq)│\ce{H2}(g)│\ce{Pt}(s) \nonumber \]
El electrodo de magnesio es un electrodo activo porque participa en la reacción de oxidación-reducción. Los electrodos inertes, como el electrodo de platino en la Figura\(\PageIndex{3}\), no participan en la reacción de oxidación-reducción y están presentes para que la corriente pueda fluir a través de la celda. El platino u oro generalmente hacen buenos electrodos inertes porque son químicamente no reactivos.

Considere una celda galvánica que consiste en
\[\ce{2Cr}(s)+\ce{3Cu^2+}(aq)⟶\ce{2Cr^3+}(aq)+\ce{3Cu}(s) \nonumber \]
Escribe las medias reacciones de oxidación y reducción y escribe la reacción usando notación celular. ¿Qué reacción ocurre en el ánodo? ¿El cátodo?
Solución
Por inspección, el Cr se oxida cuando se pierden tres electrones para formar Cr 3 +, y Cu 2 + se reduce a medida que gana dos electrones para formar Cu. Equilibrar la carga da
\ [\ begin {align}
&\ textrm {oxidación:}\ ce {2Cr} (s) ⟶\ ce {2Cr^3+} (aq) +\ ce {6e-}\\
&\ textrm {reducción:}\ ce {3Cu^2+} (aq) +\ ce {6e-} ⟶\ ce {3Cu} (s)\\
&\ overline {t\ extrm {general:}\ ce {2Cr} (s) +\ ce {3Cu^2+} (aq) ⟶\ ce {2Cr^3+} (aq) +\ ce {3Cu} (s)}
\ end {align}\ nonumber\]
La notación celular utiliza la forma más simple de cada una de las ecuaciones, y comienza con la reacción en el ánodo. No se especificaron concentraciones de modo que:
\[\ce{Cr}(s)│\ce{Cr^3+}(aq)║\ce{Cu^2+}(aq)│\ce{Cu}(s). \nonumber \]
La oxidación ocurre en el ánodo y la reducción en el cátodo.
Considere una celda galvánica que consiste en
\[\ce{5Fe^2+}(aq)+\ce{MnO4-}(aq)+\ce{8H+}(aq)⟶\ce{5Fe^3+}(aq)+\ce{Mn^2+}(aq)+\ce{4H2O}(l) \nonumber \]
Escribe las medias reacciones de oxidación y reducción y escribe la reacción usando notación celular. ¿Qué reacción ocurre en el ánodo? ¿El cátodo?
Solución
Por inspección, Fe 2 + sufre oxidación cuando se pierde un electrón para formar Fe 3 +, y MnO 4 − se reduce a medida que gana cinco electrones para formar Mn 2 +. Equilibrar la carga da
\ [\ begin {align}
&\ textrm {oxidación:} 5 (\ ce {Fe^2+} (aq) ⟶\ ce {Fe^3+} (aq) +\ ce {e-})\\
&\ subrayan {\ textrm {reducción:}\ ce {MnO4-} (aq) +\ ce {8H+} (aq) +\ ce {5e-} ⟶\ ce {Mn^2+} (aq) +\ ce {4H2O} (l)}\\
&\ textrm {general:}\ ce {5Fe^2+} (aq) +\ ce {MnO4-} (aq) +\ ce {8H+} (aq) ⟶\ ce {5Fe^3+} (aq ) +\ ce {Mn^2+} (aq) +\ ce {4H2O} (l)
\ end {align}\ nonumber\]
La notación celular utiliza la forma más simple de cada una de las ecuaciones, y comienza con la reacción en el ánodo. Es necesario utilizar un electrodo inerte, como el platino, porque no hay metal presente para conducir los electrones desde el ánodo hasta el cátodo. No se especificaron concentraciones de modo que:
\[\ce{Pt}(s)│\ce{Fe^2+}(aq),\: \ce{Fe^3+}(aq)║\ce{MnO4-}(aq),\: \ce{H+}(aq),\: \ce{Mn^2+}(aq)│\ce{Pt}(s). \nonumber \]
La oxidación ocurre en el ánodo y la reducción en el cátodo.
Utilice la notación celular para describir la celda galvánica donde los iones de cobre (II) se reducen a cobre metálico y el zinc metálico se oxida a iones de zinc.
- Contestar
-
De la información dada en el problema:
\ [\ begin {align}
&\ textrm {ánodo (oxidación):}\ ce {Zn} (s) ⟶\ ce {Zn^2+} (aq) +\ ce {2e-}\\
&\ textrm {cátodo (reducción):}\ ce {Cu^2+} (aq) +\ ce {2e-} ⟶\ ce {Cu} (s)\\
&\ overline {extrm {general:}\ ce {Zn} (s) +\ ce {Cu^2+} (aq) ⟶\ ce {Zn^2+} (aq) +\ ce {Cu} (s)}
\ end {align}\ nonumber\]Usando la notación de celdas:
\[\ce{Zn}(s)│\ce{Zn^2+}(aq)║\ce{Cu^2+}(aq)│\ce{Cu}(s) \nonumber. \nonumber \]
Resumen
Las celdas electroquímicas suelen consistir en dos medias celdas. Las medias celdas separan la semirreacción de oxidación de la semirreacción de reducción y hacen posible que la corriente fluya a través de un cable externo. Una media celda, normalmente representada en el lado izquierdo en una figura, contiene el ánodo. La oxidación ocurre en el ánodo. El ánodo está conectado al cátodo en la otra semicelda, a menudo se muestra en el lado derecho en una figura. La reducción ocurre en el cátodo. Agregar un puente de sal completa el circuito permitiendo que la corriente fluya. Los aniones en el puente salino fluyen hacia el ánodo y los cationes en el puente salino fluyen hacia el cátodo. El movimiento de estos iones completa el circuito y mantiene cada media celda eléctricamente neutra. Las celdas electroquímicas pueden describirse usando notación celular. En esta notación, la información sobre la reacción en el ánodo aparece a la izquierda y la información sobre la reacción en el cátodo a la derecha. El puente de sal está representado por una línea doble,”. Las fases sólida, líquida o acuosa dentro de una semicelda están separadas por una sola línea, │. La fase y concentración de las diversas especies se incluye después del nombre de la especie. Los electrodos que participan en la reacción de oxidación-reducción se denominan electrodos activos. Los electrodos que no participan en la reacción de oxidación-reducción pero que están ahí para permitir que la corriente fluya son electrodos inertes. Los electrodos inertes a menudo están hechos de platino u oro, que no cambian por muchas reacciones químicas.
Glosario
- electrodo activo
- electrodo que participa en la reacción de oxidación-reducción de una celda electroquímica; la masa de un electrodo activo cambia durante la reacción de oxidación-reducción
- ánodo
- electrodo en una celda electroquímica en la que se produce la oxidación; la información sobre el ánodo se registra en el lado izquierdo del puente de sal en notación celular
- cátodo
- electrodo en una celda electroquímica en la que se produce la reducción; la información sobre el cátodo se registra en el lado derecho del puente de sal en notación celular
- notación de celdas
- forma taquigráfica de representar las reacciones en una celda electroquímica
- potencial celular
- diferencia en el potencial eléctrico que surge cuando se conectan metales diferentes; la fuerza impulsora para el flujo de carga (corriente) en las reacciones de oxidación-reducción
- celda galvánica
- celda electroquímica que implica una reacción espontánea de oxidación-reducción; celdas electroquímicas con potenciales celulares positivos; también llamada celda voltaica
- electrodo inerte
- electrodo que permite el flujo de corriente, pero que de otra manera no participa en la reacción de oxidación-reducción en una celda electroquímica; la masa de un electrodo inerte no cambia durante la reacción de oxidación-reducción; los electrodos inertes a menudo están hechos de platino u oro porque estos metales son químicamente no reactivo.
- Celda voltaica
- otro nombre para una celda galvánica


