17.5: Baterías y Pilas de Combustible
- Page ID
- 75240
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Clasificar las baterías como primarias o secundarias
- Enumerar algunas de las características y limitaciones de las baterías
- Proporcionar una descripción general de una pila de combustible
Una batería es una celda electroquímica o serie de celdas que produce una corriente eléctrica. En principio, cualquier celda galvánica podría ser utilizada como batería. Una batería ideal nunca se agotaría, produciría un voltaje invariable y sería capaz de soportar temperaturas extremas ambientales de calor y humedad. Las baterías reales logran un equilibrio entre las características ideales y las limitaciones prácticas. Por ejemplo, la masa de la batería de un automóvil es de aproximadamente 18 kg o aproximadamente 1% de la masa de un automóvil promedio o camión liviano. Este tipo de batería suministraría energía casi ilimitada si se usara en un teléfono inteligente, pero sería rechazada para esta aplicación por su masa. Por lo tanto, ninguna batería es “la mejor” y las baterías se seleccionan para una aplicación en particular, teniendo en cuenta cosas como la masa de la batería, su costo, confiabilidad y capacidad de corriente. Existen dos tipos básicos de baterías: primaria y secundaria. A continuación se describen algunas baterías de cada tipo.
Visita este sitio para conocer más acerca de las baterías.
Baterías Primarias
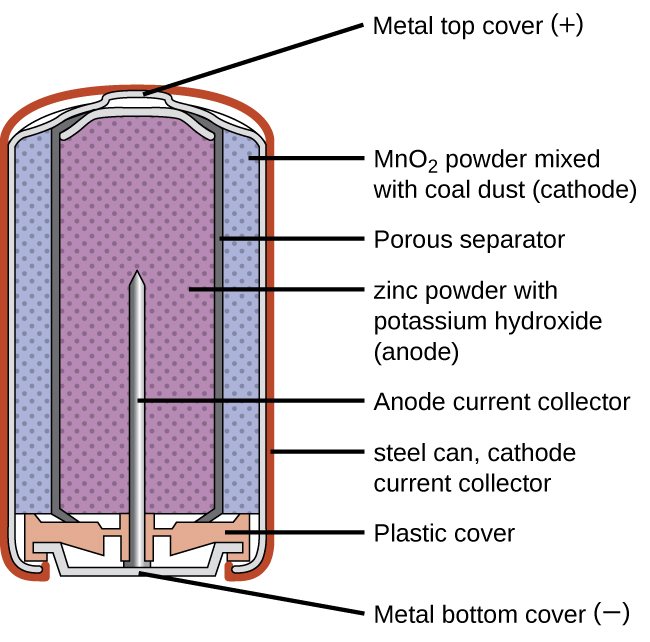
Las baterías primarias son baterías de un solo uso porque no se pueden recargar. Una batería primaria común es la celda seca (Figura\(\PageIndex{1}\)). La celda seca es una batería de zinc-carbono. La lata de zinc sirve tanto como recipiente como electrodo negativo. El electrodo positivo es una varilla hecha de carbono que está rodeada por una pasta de óxido de manganeso (IV), cloruro de zinc, cloruro de amonio, polvo de carbono y una pequeña cantidad de agua. La reacción en el ánodo se puede representar como la oxidación ordinaria del zinc:
\[\ce{Zn}(s)⟶\ce{Zn^2+}(aq)+\ce{2e-} \hspace{20px} E^\circ_{\ce{Zn^2+/Zn}}=\mathrm{−0.7618\: V} \nonumber \]
La reacción en el cátodo es más complicada, en parte porque se produce más de una reacción. La serie de reacciones que se producen en el cátodo es aproximadamente
\[\ce{2MnO2}(s)+\ce{2NH4Cl}(aq)+\ce{2e-}⟶\ce{Mn2O3}(s)+\ce{2NH3}(aq)+\ce{H2O}(l)+\ce{2Cl-} \nonumber \]
La reacción general de la batería de zinc-carbono se puede representar como
\[\ce{2MnO2}(s) + \ce{2NH4Cl}(aq) + \ce{Zn}(s) ⟶ \ce{Zn^2+}(aq) + \ce{Mn2O3}(s) + \ce{2NH3}(aq) + \ce{H2O}(l) + \ce{2Cl-} \nonumber \]
con un potencial celular global que inicialmente es de aproximadamente 1.5 V, pero disminuye a medida que se usa la batería. Es importante recordar que el voltaje que entrega una batería es el mismo independientemente del tamaño de una batería. Por esta razón, las baterías D, C, A, AA y AAA tienen la misma clasificación de voltaje. Sin embargo, las baterías más grandes pueden entregar más moles de electrones. A medida que el contenedor de zinc se oxida, su contenido eventualmente se escapa, por lo que este tipo de batería no debe dejarse en ningún dispositivo eléctrico por periodos prolongados.

Pilas alcalinas (Figura\(\PageIndex{2}\)) were developed in the 1950s partly to address some of the performance issues with zinc–carbon dry cells. They are manufactured to be exact replacements for zinc-carbon dry cells. As their name suggests, these types of batteries use alkaline electrolytes, often potassium hydroxide. The reactions are
\[\begin{align*} &\textrm{anode: }\ce{Zn}(s)+\ce{2OH-}(aq)⟶\ce{ZnO}(s)+\ce{H2O}(l)+\ce{2e-} \hspace{40px} E^\circ_\ce{anode}=\mathrm{−1.28\: V}\\ &\underline{\textrm{cathode: }\ce{2MnO2}(s)+\ce{H2O}(l)+\ce{2e-}⟶\ce{Mn2O3}(s)+\ce{2OH-}(aq) \hspace{40px} E^\circ_\ce{cathode}=\mathrm{+0.15\: V}}\\ &\textrm{overall: }\ce{Zn}(s)+\ce{2MnO2}(s)⟶\ce{ZnO}(s)+\ce{Mn2O3}(s) \hspace{40px} E^\circ_\ce{cell}=\mathrm{+1.43\: V} \end{align*} \nonumber \]
Una batería alcalina puede entregar aproximadamente de tres a cinco veces la energía de una celda seca de zinc-carbono de tamaño similar. Las baterías alcalinas son propensas a fugas de hidróxido de potasio, por lo que estas también deben retirarse de los dispositivos para su almacenamiento a largo plazo. Si bien algunas pilas alcalinas son recargables, la mayoría no lo son. Los intentos de recargar una batería alcalina que no es recargable a menudo conducen a la ruptura de la batería y la fuga del electrolito de hidróxido de potasio.
Baterías Secundarias
Las baterías secundarias son recargables. Estos son los tipos de baterías que se encuentran en dispositivos como teléfonos inteligentes, tabletas electrónicas y automóviles.
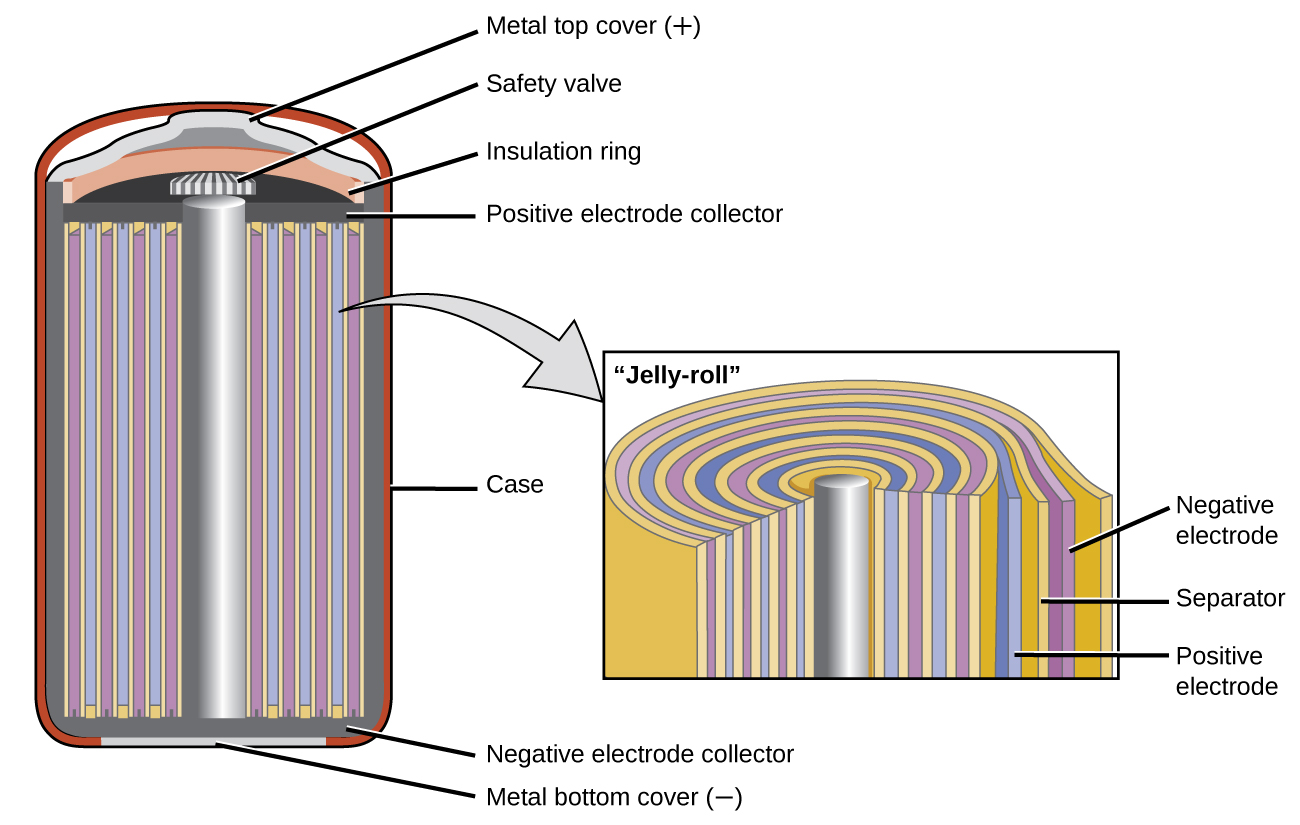
Las baterías de níquel-cadmio o NiCd (Figura\(\PageIndex{3}\)) consisten en un cátodo niquelado, un ánodo chapado en cadmio y un electrodo de hidróxido de potasio. Las placas positiva y negativa, a las que el separador evita que se cortocircuiten, se enrollan juntas y se colocan en la caja. Este es un diseño “gelatinoso” y permite que la celda NiCd entregue mucha más corriente que una batería alcalina de tamaño similar. Las reacciones son
\ [\ begin {alinear*}
&\ textrm {ánodo:}\ ce {Cd} (s) +\ ce {2OH-} (aq) ⟶\ ce {Cd (OH) 2} (s) +\ ce {2e-}\\
&\ subrayado {\ textrm {cátodo:}\ ce {NiO2} (s) +\ ce {2H2O} (l) +\ ce {2e-} ⟶\ ce {Ni (OH) 2} (s) +\ ce {2OH-} (aq)}\\
&\ textrm {general:}\ ce {Cd} (s) +\ ce {NiO2} (s) +\ ce {2H2O} (l) ⟶\ ce {Cd (OH) 2} (s) +\ ce {Ni (OH) 2} (s)\ end {align*}\ nonumber\]
El voltaje es de aproximadamente 1.2 V a 1.25 V a medida que la batería se descarga. Cuando se trata adecuadamente, una batería de NiCd se puede recargar aproximadamente 1000 veces. El cadmio es un metal pesado tóxico, por lo que las baterías de NiCd nunca deben abrirse ni colocarse en la basura normal.
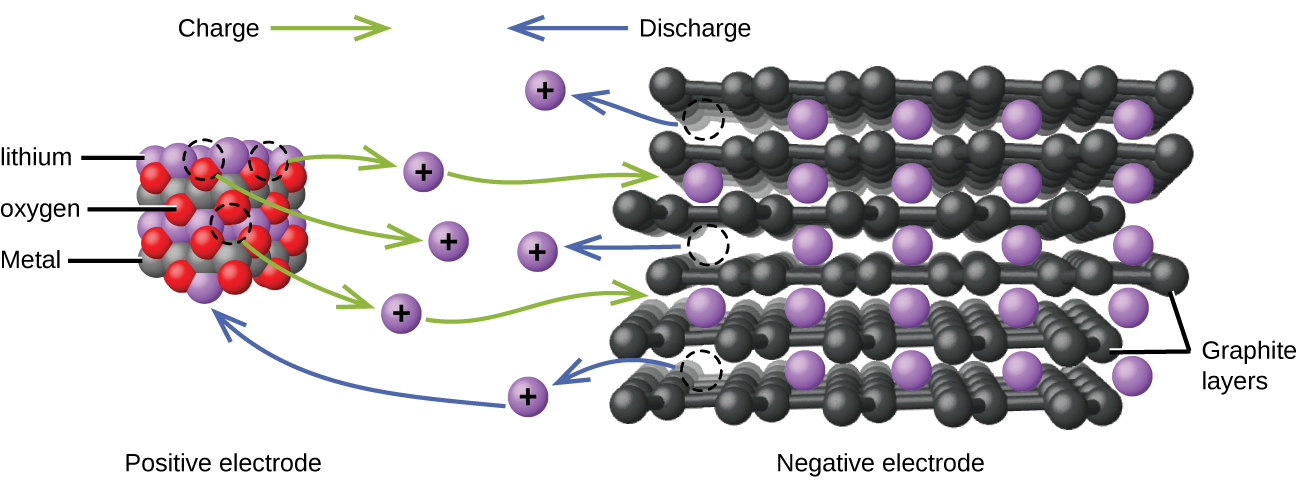
Las baterías de iones de litio (Figura\(\PageIndex{4}\)) se encuentran entre las baterías recargables más populares y se utilizan en muchos dispositivos electrónicos portátiles. Las reacciones son
\[\begin{align*} &\textrm{anode: }\ce{LiCoO2}⇌\ce{Li}_{1-x}\ce{CoO2}+x\ce{Li+}+x\ce{e-}\\ &\textrm{cathode: }x\ce{Li+}+x\ce{e-}+x\ce{C6}⇌x\ce{LiC6}\\ &\overline{\textrm{overall: }\ce{LiCoO2}+x\ce{C6}⇌\ce{Li}_{1-x}\ce{CoO2}+x\ce{LiC6}} \end{align*} \nonumber \]
Con los coeficientes que representan moles, x no es más de aproximadamente 0.5 moles. El voltaje de la batería es de aproximadamente 3.7 V. Las baterías de litio son populares porque pueden proporcionar una gran cantidad de corriente, son más livianas que las baterías comparables de otros tipos, producen un voltaje casi constante a medida que se descargan y solo pierden lentamente su carga cuando se almacenan.
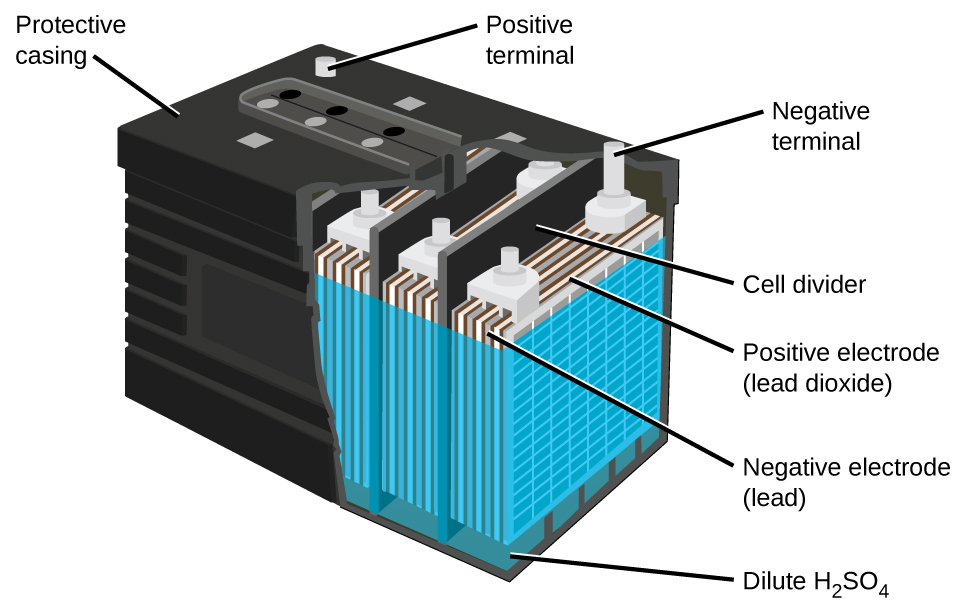
La batería de plomo-ácido (Figura\(\PageIndex{5}\)) es el tipo de batería secundaria utilizada en su automóvil. Es económico y capaz de producir la alta corriente requerida por los motores de arranque de automóviles. Las reacciones para una batería de plomo-ácido son
\[\begin{align*} &\textrm{anode: }\ce{Pb}(s)+\ce{HSO4-}(aq)⟶\ce{PbSO4}(s)+\ce{H+}(aq)+\ce{2e-}\\ &\underline{\textrm{cathode: } \ce{PbO2}(s)+\ce{HSO4-}(aq)+\ce{3H+}(aq)+\ce{2e-}⟶\ce{PbSO4}(s)+\ce{2H2O}(l)}\\ &\textrm{overall: }\ce{Pb}(s)+\ce{PbO2}(s)+\ce{2H2SO4}(aq)⟶\ce{2PbSO4}(s)+\ce{2H2O}(l) \end{align*} \nonumber \]
Cada celda produce 2 V, por lo que seis celdas están conectadas en serie para producir una batería de automóvil de 12 V. Las baterías de plomo-ácido son pesadas y contienen un electrolito líquido cáustico, pero a menudo siguen siendo la batería de elección debido a su alta densidad de corriente. Dado que estas baterías contienen una cantidad significativa de plomo, siempre deben desecharse adecuadamente.
Pilas de combustible
Una pila de combustible es un dispositivo que convierte la energía química en energía eléctrica. Las pilas de combustible son similares a las baterías pero requieren una fuente continua de combustible, a menudo hidrógeno. Seguirán produciendo electricidad mientras se disponga de combustible. Las pilas de combustible de hidrógeno se han utilizado para suministrar energía a satélites, cápsulas espaciales, automóviles, embarcaciones y submarinos (Figura\(\PageIndex{6}\)).
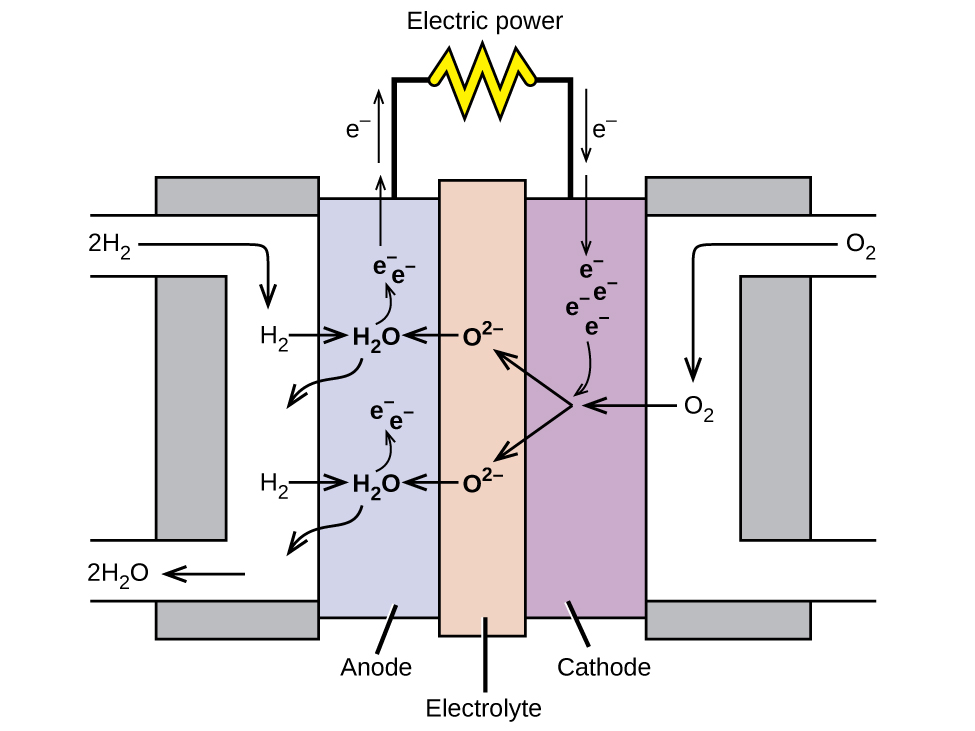
En una pila de combustible de hidrógeno, las reacciones son
\ [\ begin {alinear*}
&\ textrm {ánodo:}\ ce {2H2 + 2O^2- ⟶ 2H2O + 4e-}\\
&\ subrayado {\ textrm {cátodo:}\ ce {O2 + 4e- ⟶ 2O^2-}\ hspace {55px}}\\
&\ textrm {general:}\ ce {2H2 + O2 ⟶ 2H2 H2O}\ final {alinear*}\ nonumber\]
El voltaje es de aproximadamente 0.9 V. La eficiencia de las celdas de combustible es típicamente de aproximadamente 40% a 60%, que es mayor que el típico motor de combustión interna (25% a 35%) y, en el caso de la pila de combustible de hidrógeno, produce solo agua como escape. Actualmente, las pilas de combustible son bastante caras y contienen características que las hacen fallar después de un tiempo relativamente corto.
Resumen
Las baterías son celdas galvánicas, o una serie de celdas, que producen una corriente eléctrica. Cuando las celdas se combinan en baterías, el potencial de la batería es un múltiplo entero del potencial de una sola celda. Existen dos tipos básicos de baterías: primaria y secundaria. Las baterías primarias son de “un solo uso” y no se pueden recargar. Las celdas secas y (la mayoría) las baterías alcalinas son ejemplos de baterías primarias. El segundo tipo es recargable y se llama batería secundaria. Ejemplos de baterías secundarias incluyen baterías de níquel-cadmio (NiCd), ácido de plomo y baterías de iones de litio. Las pilas de combustible son similares a las baterías en que generan una corriente eléctrica, pero requieren la adición continua de combustible y oxidante. La pila de combustible de hidrógeno utiliza hidrógeno y oxígeno del aire para producir agua, y generalmente es más eficiente que los motores de combustión interna.
Resumen
- batería alcalina
- batería primaria que utiliza un electrolito alcalino (a menudo hidróxido de potasio); diseñada para ser un reemplazo exacto para la celda seca, pero con más almacenamiento de energía y menos fugas de electrolito que las celdas secas típicas
- batería
- celda galvánica o serie de celdas que produce una corriente; en teoría, cualquier celda galvánica
- celda seca
- batería primaria, también llamada batería de zinc-carbono; se puede usar en cualquier orientación porque usa una pasta como electrolito; tiende a tener fugas de electrolito cuando se almacena
- pila de combustible
- dispositivos que producen una corriente eléctrica siempre que se agreguen continuamente combustible y oxidante; más eficientes que los motores de combustión interna
- batería de plomo-ácido
- batería secundaria que consta de múltiples celdas; la batería de plomo-ácido que se encuentra en los automóviles tiene seis celdas y un voltaje de 12 V
- batería de iones de litio
- batería secundaria muy popular; utiliza iones de litio para conducir corriente y es ligera, recargable y produce un potencial casi constante a medida que se descarga
- batería de níquel-cadmio
- (batería NiCd) batería secundaria que utiliza cadmio, que es un metal pesado tóxico; más pesada que las baterías de iones de litio, pero con características de rendimiento similares
- batería primaria
- batería no recargable de un solo uso
- batería secundaria
- batería que se puede recargar


