17.6: Corrosión
- Page ID
- 75256
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Definir corrosión
- Enumere algunos de los métodos utilizados para prevenir o ralentizar la corrosión
La corrosión se define generalmente como la degradación de los metales debido a un proceso electroquímico. La formación de óxido en el hierro, el deslustre en la plata y la pátina azul-verde que se desarrolla sobre el cobre son ejemplos de corrosión. El costo total de la corrosión en Estados Unidos es significativo, con estimaciones superiores a medio billón de dólares al año.
La Estatua de la Libertad es un hito que todos los estadounidenses reconocen. La Estatua de la Libertad se identifica fácilmente por su altura, postura y color azul verdoso único. Cuando esta estatua fue entregada por primera vez desde Francia, su aspecto no era verde. Era marrón, el color de su “piel” de cobre. Entonces, ¿cómo cambió de color la Estatua de la Libertad? El cambio de apariencia fue resultado directo de la corrosión. El cobre que es el componente principal de la estatua sufrió lentamente la oxidación del aire. Las reacciones de oxidación-reducción del cobre metálico en el ambiente ocurren en varias etapas. El metal cobre se oxida a óxido de cobre (I\(\ce{Cu_2O}\)) (), que es rojo, y luego a óxido de cobre (II), que es negro.
\[\ce{2Cu(s)} +\ce{1/2O2(g)} \rightarrow \underset{\text{red}}{\ce{Cu2O(s)}} \nonumber \]
\[\ce{Cu2O(s)} +\ce{1/2O2(g)} \rightarrow \underset{\text{black}}{\ce{2CuO(s)}} \nonumber \]
El carbón, que a menudo era alto en azufre, se quemaba extensamente a principios del siglo pasado. Como resultado, el trióxido de azufre, el dióxido de carbono y el agua reaccionaron con el\(\ce{CuO}\).
\[\ce{2CuO(s)}+\ce{CO2(g)} + \ce{H2O(l)} \rightarrow \underset{\text{green}}{\ce{Cu_2CO3(OH)2(s)}} \nonumber \]
\[\ce{3CuO(s)}+\ce{2CO2(g)}+\ce{H2O(l)} \rightarrow \underset{\text{blue}}{\ce{Cu_2(CO_3)_2(OH)2(s)}} \nonumber \]
\[\ce{4CuO(s)}+\ce{SO3(g)}+\ce{3H2O(l)} \rightarrow \underset{\text{green}}{\ce{Cu_4SO_4(OH)6(s)}} \nonumber \]
Estos tres compuestos son los responsables de la característica pátina azul-verde que se ve hoy en día. Afortunadamente, la formación de la pátina creó una capa protectora en la superficie, evitando una mayor corrosión de la piel de cobre. La formación de la capa protectora es una forma de pasivación, la cual se discute más adelante en un capítulo posterior.
Quizás el ejemplo más familiar de corrosión es la formación de óxido en el hierro. El hierro se oxidará cuando se expone al oxígeno y al agua. Los principales pasos en la oxidación del hierro parecen involucrar lo siguiente. Una vez expuesto a la atmósfera, el hierro se oxida rápidamente.
\[\textrm{anode: }\ce{Fe}_{(s)} \rightarrow \ce{Fe^{2+}}_{(aq)}+\ce{2e^-}\;\;\; E^\circ_{\ce{Fe^{2+}/Fe}}=\mathrm{−0.44\: V} \nonumber \]
Los electrones reducen el oxígeno en el aire en soluciones ácidas.
\[\textrm{cathode: }\ce{O}_{2(g)}+\ce{4H^+}_{(aq)}+\ce{4e^-} \rightarrow \ce{2H_2O}_{(l)}\;\; E^\circ_{\ce{O_2/O_2}}=\mathrm{+1.23\; V} \nonumber \]
\[\textrm{overall: }\ce{2Fe}_{(s)}+\ce{O}_{2(g)}+\ce{4H^+}_{(aq)} \rightarrow \ce{2Fe^{2+}}_{(aq)}+\ce{2H_2O}_{(l)} \;\;\;E^\circ_\ce{cell}=\mathrm{+1.67\; V} \nonumber \]
Lo que llamamos óxido es óxido de hierro hidratado (III), que se forma cuando los iones de hierro (II) reaccionan más con el oxígeno.
\[\ce{4Fe^{2+}}_{(aq)}+\ce{O}_{2(g)}+(4+2x)\ce{H_2O}_{(l)} \rightarrow \ce{2Fe_2O_3} \cdot x\ce{H_2O}_{(s)}+\ce{8H^+}_{(aq)} \nonumber \]
El número de moléculas de agua es variable, por lo que está representado por x. A diferencia de la pátina sobre el cobre, la formación de óxido no crea una capa protectora y por lo tanto la corrosión del hierro continúa a medida que el óxido se desprende y expone el hierro fresco a la atmósfera.
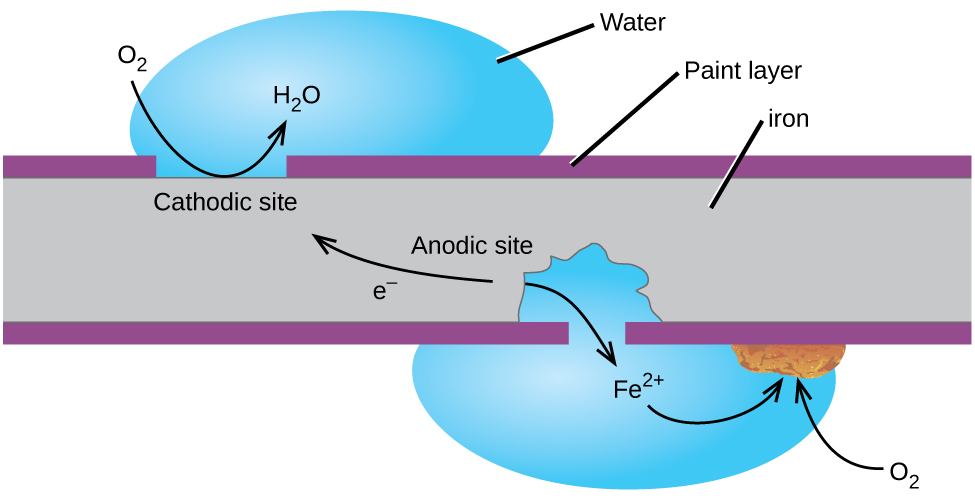
Una forma de evitar que el hierro se corroa es mantenerlo pintado. La capa de pintura evita que el agua y el oxígeno necesarios para la formación de óxido entren en contacto con el hierro. Mientras la pintura permanezca intacta, el hierro está protegido de la corrosión.
Otras estrategias incluyen alear el hierro con otros metales. Por ejemplo, el acero inoxidable es principalmente hierro con un poco de cromo. El cromo tiende a acumularse cerca de la superficie, donde forma una capa de óxido que protege al hierro.
El hierro cincado o galvanizado utiliza una estrategia diferente. El zinc se oxida más fácilmente que el hierro porque el zinc tiene un menor potencial de reducción. Dado que el zinc tiene un menor potencial de reducción, es un metal más activo. Así, aunque el recubrimiento de zinc esté rayado, el zinc aún se oxidará antes que el hierro. Esto sugiere que este enfoque debería funcionar con otros metales activos.

Otra forma importante de proteger el metal es convertirlo en el cátodo en una celda galvánica. Esta es una protección catódica y se puede utilizar para metales que no sean solo hierro. Por ejemplo, la oxidación de los tanques y tuberías subterráneos de almacenamiento de hierro se puede prevenir o reducir en gran medida conectándolos a un metal más activo como el zinc o el magnesio. Esto también se utiliza para proteger las piezas metálicas en los calentadores de agua. Los metales más activos (menor potencial de reducción) se denominan ánodos de sacrificio porque a medida que se agotan a medida que se corroen (oxidan) en el ánodo. El metal que se protege sirve como cátodo, y así no se oxida (corroe). Cuando los ánodos se monitorean adecuadamente y se reemplazan periódicamente, la vida útil del tanque de almacenamiento de hierro se puede extender en gran medida.
Resumen
La corrosión es la degradación de un metal causada por un proceso electroquímico. Se gastan grandes sumas de dinero cada año reparando los efectos de, o previniendo, la corrosión. Algunos metales, como el aluminio y el cobre, producen una capa protectora cuando se corroen en el aire. La fina capa que se forma en la superficie del metal evita que el oxígeno entre en contacto con más átomos metálicos y así “protege” al metal restante de una mayor corrosión. El hierro se corroe (forma óxido) cuando se expone al agua y al oxígeno. El óxido que se forma en el metal de hierro se descama, exponiendo el metal fresco, que también se corroe. Una forma de prevenir, o ralentizar, la corrosión es recubriendo el metal. El recubrimiento evita que el agua y el oxígeno entren en contacto con el metal La pintura u otros recubrimientos ralentizarán la corrosión, pero no son efectivos una vez rayados. El hierro cincado o galvanizado explota el hecho de que es más probable que el zinc se oxide que el hierro. Mientras el recubrimiento permanezca, aunque esté rayado, el zinc se oxidará antes que el hierro. Otro método para proteger metales es la protección catódica. En este método, un metal fácilmente oxidado y económico, a menudo zinc o magnesio (el ánodo de sacrificio), se conecta eléctricamente al metal que debe protegerse. El metal más activo es el ánodo de sacrificio, y es el ánodo en una celda galvánica. El metal “protegido” es el cátodo, y permanece sin oxidar. Una ventaja de la protección catódica es que el ánodo de sacrificio puede ser monitoreado y reemplazado si es necesario.
Glosario
- protección catódica
- método de protección del metal mediante el uso de un ánodo de sacrificio y la fabricación efectiva del metal que necesita proteger el cátodo, evitando así su oxidación
- corrosión
- degradación del metal a través de un proceso electroquímico
- hierro galvanizado
- método para proteger el hierro cubriéndolo con zinc, que se oxidará antes que el hierro; hierro zincado
- ánodo de sacrificio
- metal más activo y económico utilizado como ánodo en la protección catódica; frecuentemente hecho de magnesio o zinc


