19.2: Coordinación Química de Metales de Transición
- Page ID
- 75658
- Enumerar los rasgos definitorios de los compuestos
- Describir las estructuras de complejos que contienen ligandos monodentados y polidentados
- Usar reglas de nomenclatura estándar para nombrar compuestos de coordinación
- Explicar y proporcionar ejemplos de isomería geométrica y óptica
- Identificar varias ocurrencias naturales y tecnológicas de compuestos de coordinación
La hemoglobina en la sangre, la clorofila en las plantas verdes, la vitamina\(B_{12}\) y el catalizador utilizado en la fabricación del polietileno contienen compuestos de coordinación. Es probable que los iones de los metales, especialmente los metales de transición, formen complejos. Muchos de estos compuestos son altamente coloreados (Figura\(\PageIndex{1}\)). En lo que resta de este capítulo, consideraremos la estructura y unión de estos notables compuestos.

Recuerde que en la mayoría de los compuestos de elementos del grupo principal, los electrones de valencia de los átomos aislados se combinan para formar enlaces químicos que satisfacen la regla del octeto. Por ejemplo, los cuatro electrones de valencia del carbono se superponen con electrones de cuatro átomos de hidrógeno para formar CH 4. El electrón de valencia deja sodio y se suma a los siete electrones de valencia del cloro para formar la unidad de fórmula iónica NaCl (Figura\(\PageIndex{2}\)). Los metales de transición normalmente no se unen de esta manera. Principalmente forman enlaces covalentes coordinados, una forma de la interacción ácido-base de Lewis en la que ambos electrones en el enlace son aportados por un donante (base de Lewis) a un aceptor de electrones (ácido de Lewis). El ácido de Lewis en los complejos de coordinación, a menudo llamado un ion metálico central (o átomo), es a menudo un metal de transición o metal de transición interno, aunque los elementos del grupo principal también pueden formar compuestos de coordinación. Los donantes de bases de Lewis, llamados ligandos, pueden ser una amplia variedad de sustancias químicas: átomos, moléculas o iones. El único requisito es que cuenten con uno o más pares de electrones, los cuales pueden ser donados al metal central. La mayoría de las veces, esto involucra un átomo donante con un par solitario de electrones que pueden formar un enlace coordinado con el metal.
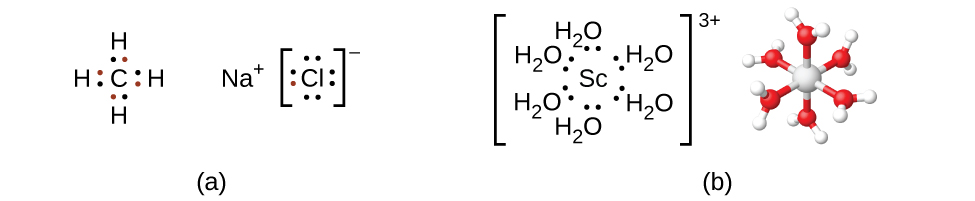
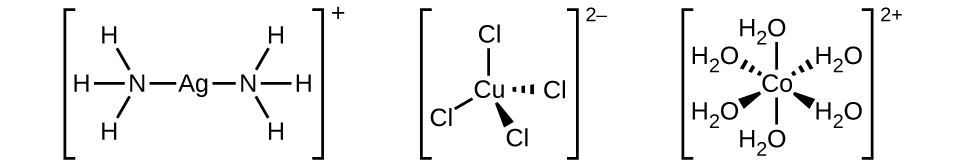
La esfera de coordinación consiste en el ion o átomo metálico central más sus ligandos unidos. Los corchetes en una fórmula encierran la esfera de coordinación; las especies fuera de los corchetes no forman parte de la esfera de coordinación. El número de coordinación del ion o átomo metálico central es el número de átomos donantes unidos a él. El número de coordinación para el ión plata en [Ag (NH 3) 2] + es dos (Figura\(\PageIndex{3}\)). Para el ion cobre (II) en [CuCl 4] 2−, el número de coordinación es cuatro, mientras que para el ion cobalto (II) en [Co (H 2 O) 6] 2+ el número de coordinación es seis. Cada uno de estos ligandos es monodentado, del griego para “un diente”, lo que significa que conectan con el metal central a través de un solo átomo. En este caso, el número de ligandos y el número de coordinación son iguales.
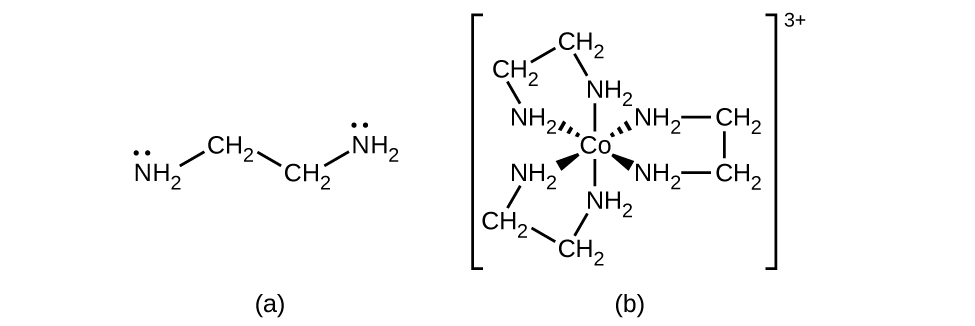
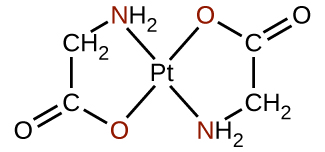
Muchos otros ligandos se coordinan con el metal de manera más compleja. Los ligandos bidentados son aquellos en los que dos átomos se coordinan con el centro metálico. Por ejemplo, la etilendiamina (en, H 2 NCH 2 CH 2 NH 2) contiene dos átomos de nitrógeno, cada uno de los cuales tiene un par solitario y puede servir como base de Lewis (Figura\(\PageIndex{4}\)). Ambos átomos pueden coordinarse con un solo centro metálico. En el complejo [Co (en) 3] 3+, hay tres ligandos bidentados y el número de coordinación del ion cobalto (III) es seis. Los números de coordinación más comunes son dos, cuatro y seis, pero se conocen ejemplos de todos los números de coordinación del 1 al 15.
Cualquier ligando que se une a un ion metálico central por más de un átomo donante es un ligando polidentado (o “muchos dientes”) porque puede morder en el centro metálico con más de un enlace. El término quelato (pronunciado “Key-late”) del griego para “garra” también se usa para describir este tipo de interacción. Muchos ligandos polidentados son ligandos quelantes, y un complejo que consiste en uno o más de estos ligandos y un metal central es un quelato. Un ligando quelante también se conoce como agente quelante. Un ligando quelante sostiene el ion metálico más bien como una garra de cangrejo sostendría una canica. La figura\(\PageIndex{4}\) mostró un ejemplo de un quelato y el complejo hemo en la hemoglobina es otro ejemplo importante (Figura\(\PageIndex{5}\)). Contiene un ligando polidentado con cuatro átomos donantes que se coordinan con el hierro.
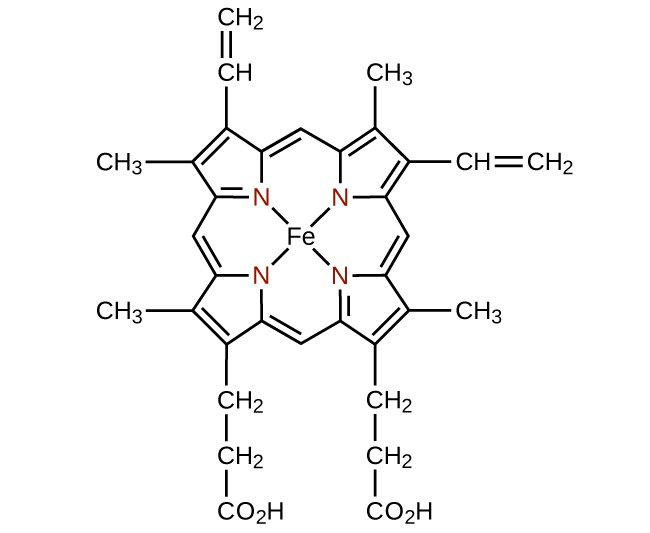
Los ligandos polidentados a veces se identifican con prefijos que indican el número de átomos donantes en el ligando. Como hemos visto, los ligandos con un átomo donante, como NH 3, Cl − y H 2 O, son ligandos monodentados. Los ligandos con dos grupos donantes son ligandos bidentados. La etilendiamina, H 2 NCH 2 CH 2 NH 2, y el anión de la glicina ácida,\(\ce{NH2CH2CO2-}\) (Figura\(\PageIndex{6}\)) son ejemplos de ligandos bidentados. Los ligandos tridentados, los ligandos tetradentados, los ligandos pentadentados y los ligandos hexadentados contienen tres, cuatro, cinco y seis átomos donantes, respectivamente. El ligando hemo (Figura\(\PageIndex{5}\)) es un ligando tetradentado.
El Nombramiento de Complejos
La nomenclatura de los complejos está modelada a partir de un sistema sugerido por Alfred Werner, químico suizo y premio Nobel, cuya destacada labor hace más de 100 años sentó las bases para una comprensión más clara de estos compuestos. Las siguientes cinco reglas se utilizan para nombrar complejos:
- Si un compuesto de coordinación es iónico, nombra el catión primero y el anión segundo, de acuerdo con la nomenclatura habitual.
- Nombrar primero los ligandos, seguido del metal central. Nombrar los ligandos alfabéticamente. Los ligandos negativos (aniones) tienen nombres formados al agregar - o al nombre del tallo del grupo (e.g., Tabla\(\PageIndex{1}\). Para la mayoría de los ligandos neutros, se usa el nombre de la molécula. Las cuatro excepciones comunes son aqua (H 2 O), amina (NH 3), carbonilo (CO) y nitrosil (NO). Por ejemplo, nombre [Pt (NH 3) 2 Cl 4] como diaminetetracloroplatino (IV).
- Si está presente más de un ligando de un tipo dado, el número se indica con los prefijos di - (para dos), tri - (para tres), tetra - (para cuatro), penta - (para cinco) y hexa - (para seis). En ocasiones, los prefijos bis - (para dos), tris - (para tres) y tetrakis - (para cuatro) se usan cuando el nombre del ligando ya incluye di -, tri -, o tetra -, o cuando el nombre del ligando comienza con una vocal. Por ejemplo, el ion bis (bipiridil) osmio (II) usa bis- para significar que hay dos ligandos unidos a Os, y cada ligando bipiridilo contiene dos grupos piridina (C 5 H 4 N).
| Ligando Aniónico | Nombre |
|---|---|
| F − | fluoro |
| Cl − | cloro |
| Br − | bromo |
| I - | iodo |
| CN − | ciano |
| \(\ce{NO3-}\) | Nitrato |
| OH − | hidroxo |
| O 2— | oxo |
| \(\ce{C2O4^2-}\) | oxalato |
| \(\ce{CO2^2-}\) | carbonato |
Cuando el complejo es un catión o una molécula neutra, el nombre del átomo metálico central se deletrea exactamente igual que el nombre del elemento y va seguido de un número romano entre paréntesis para indicar su estado de oxidación (Tablas\(\PageIndex{2}\),\(\PageIndex{3}\), y\(\PageIndex{3}\)). Cuando el complejo es un anión, el sufijo -ato se agrega al tallo del nombre del metal, seguido de la designación del número romano de su estado de oxidación.
| Ejemplos en los que el complejo es catión | |
| [Co (NH 3) 6] Cl 3 | cloruro de hexaaminecobalt (III) |
| [Pt (NH 3) 4 Cl 2] 2+ | ión tetraaminodicloroplatino (IV) |
| [Ag (NH 3) 2] + | ion diaminesilver (I) |
| [Cr (H 2 O) 4 Cl 2] Cl | cloruro de tetraaquadiclorocromo (III) |
| [Co (H 2 NCH 2 CH 2 NH 2) 3] 2 (SO 4) 3 | sulfato de tris (etilendiamina) cobalto (III) |
| Ejemplos en los que el complejo es neutro | |
| [Pt (NH 3) 2 Cl 4] | diaminetetracloroplatino (IV) |
| [Ni (H 2 NCH 2 CH 2 NH 2) 2 Cl 2] | diclorobis (etilendiamina) níquel (II) |
| Ejemplos en los que el complejo es un anión | |
| [PtcL 6] 2− | ión hexacloroplatinato (IV) |
| Na 2 [S NCl 6] | hexacloroestannato de sodio (IV) |
En ocasiones, se usa el nombre latino del metal cuando el nombre inglés es torpe. Por ejemplo, se usa ferrato en lugar de ironato, plomado en lugar de plomo y estannato en lugar de tinato. El estado de oxidación del metal se determina en base a las cargas de cada ligando y la carga global del compuesto de coordinación. Por ejemplo, en [Cr (H 2 O) 4 Cl 2] Br, la esfera de coordinación (entre paréntesis) tiene una carga de 1+ para equilibrar el ión bromuro. Los ligandos de agua son neutros, y los ligandos de cloruro son aniónicos con una carga de 1− cada uno. Para determinar el estado de oxidación del metal, establecemos la carga global igual a la suma de los ligandos y el metal: +1 = −2 + x, por lo que el estado de oxidación (x) es igual a 3+.
Determinar el nombre de los siguientes complejos y dar el número de coordinación del átomo metálico central.
- Na 2 [PtcL 6]
- K 3 [Fe (C 2 O 4) 3]
- [Co (NH 3) 5 Cl] Cl 2
Solución
- Hay dos iones Na +, por lo que la esfera de coordinación tiene dos cargas negativas: [PtCl 6] 2−. Hay seis ligandos de cloruro aniónicos, por lo que −2 = −6 + x, y el estado de oxidación del platino es 4+. El nombre del complejo es hexacloroplatinato de sodio (IV), y el número de coordinación es seis.
- La esfera de coordinación tiene una carga de 3− (basada en el potasio) y los ligandos de oxalato tienen cada uno una carga de 2−, por lo que el estado de oxidación del metal viene dado por −3 = −6 + x, y este es un complejo de hierro (III). El nombre es trisoxalatoferrato de potasio (III) (tenga en cuenta que se usa tris en lugar de tri porque el nombre del ligando comienza con una vocal). Debido a que el oxalato es un ligando bidentado, este complejo tiene un número de coordinación de seis.
- En este ejemplo, la esfera de coordinación tiene una carga catiónica de 2+. El ligando NH 3 es neutro, pero el ligando cloro tiene una carga de 1−. El estado de oxidación se encuentra en +2 = −1 + x y es 3+, por lo que el complejo es cloruro de pentaaminaclorocobalto (III) y el número de coordinación es seis.
El complejo dicianoargenato de potasio (I) se utiliza para elaborar compuestos antisépticos. Dar la fórmula y el número de coordinación.
- Contestar
-
K [Ag (CN) 2]; coordinación número dos
Las estructuras de los complejos
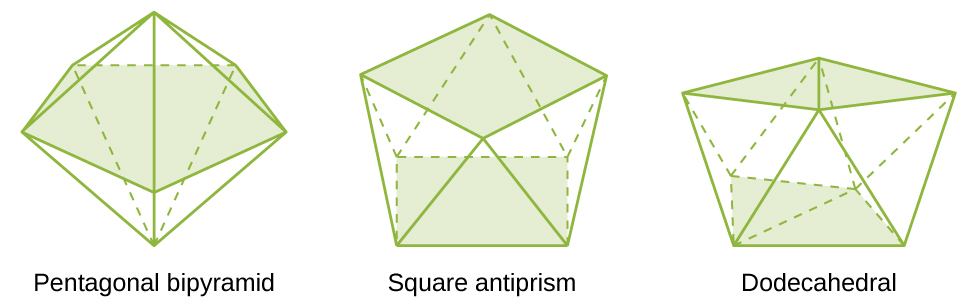
Las estructuras más comunes de los complejos en los compuestos de coordinación son octaédricas, tetraédricas y planas cuadradas (Figura\(\PageIndex{7}\)). Para los complejos de metales de transición, el número de coordinación determina la geometría alrededor del ion metálico central. La tabla\(\PageIndex{3}\) compara los números de coordinación con la geometría molecular:
| Número de Coordinación | Geometría Molecular | Ejemplo |
|---|---|---|
| 2 | lineal | [Ag (NH 3) 2] + |
| 3 | plano trigonal | [Cu (CN) 3] 2− |
| 4 | tetraédrico (d 0 o d 10), estados de baja oxidación para M | [Ni (CO) 4] |
| 4 | plano cuadrado (d 8) | [NiCl 4] 2− |
| 5 | bipiramidal trigonal | [CoCl 5] 2− |
| 5 | cuadrado piramidal | [VO (CN) 4] 2− |
| 6 | octaédrico | [CoCl 6] 3− |
| 7 | bipirámide pentagonal | [ZrF 7] 3− |
| 8 | antiprisma cuadrado | [ReF 8] 2− |
| 8 | dodecaedro | [Mo (CN) 8] 4− |
| 9 y superiores | estructuras más complicadas | [ReH 9] 2− |
A diferencia de los átomos del grupo principal en los que tanto los electrones enlazantes como los no enlazantes determinan la forma molecular, los electrones d no enlazantes no cambian la disposición de los ligandos. Los complejos octaédricos tienen un número de coordinación de seis, y los seis átomos donantes están dispuestos en las esquinas de un octaedro alrededor del ion metálico central. Los ejemplos se muestran en la Figura\(\PageIndex{8}\). Los aniones cloruro y nitrato en [Co (H 2 O) 6] Cl 2 y [Cr (en) 3] (NO 3) 3, y los cationes potasio en K 2 [PtcL 6], están fuera de los paréntesis y no están unidos al ión metálico.

Para los metales de transición con un número de coordinación de cuatro, son posibles dos geometrías diferentes: tetraédrica o plana cuadrada. A diferencia de los elementos del grupo principal, donde estas geometrías pueden predecirse a partir de la teoría de VSEPR, se requiere una discusión más detallada de los orbitales de metales de transición (discutida en la sección de Teoría del Campo de Cristal) para predecir qué complejos serán tetraédricos y cuáles serán planos cuadrados. En complejos tetraédricos como [Zn (CN) 4] 2− (Figura\(\PageIndex{9}\)), cada uno de los pares de ligandos forma un ángulo de 109.5°. En complejos planos cuadrados, tales como [Pt (NH 3) 2 Cl 2], cada ligando tiene otros dos ligandos en ángulos de 90° (llamados las posiciones cis) y un ligando adicional en un ángulo de 180°, en la posición trans.

Iomerismo en Complejos
Los isómeros son diferentes especies químicas que tienen la misma fórmula química. Los metales de transición a menudo forman isómeros geométricos, en los que los mismos átomos están conectados a través de los mismos tipos de enlaces pero con diferencias en su orientación en el espacio. Los complejos de coordinación con dos ligandos diferentes en las posiciones cis y trans de un ligando de interés forman isómeros. Por ejemplo, el ion octaédrico [Co (NH 3) 4 Cl 2] + tiene dos isómeros. En la configuración cis, los dos ligandos de cloruro son adyacentes entre sí (Figura\(\PageIndex{1}\)). El otro isómero, la configuración trans, tiene los dos ligandos de cloruro directamente uno frente al otro.
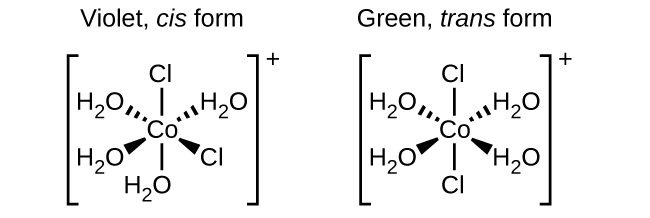
Los diferentes isómeros geométricos de una sustancia son diferentes compuestos químicos. Presentan diferentes propiedades, a pesar de que tienen la misma fórmula. Por ejemplo, los dos isómeros de [Co (NH 3) 4 Cl 2] NO 3 difieren en color; la forma cis es violeta y la forma trans es verde. Además, estos isómeros tienen diferentes momentos dipolares, solubilidades y reactividades. Como ejemplo de cómo la disposición en el espacio puede influir en las propiedades moleculares, considere la polaridad de los dos isómeros [Co (NH 3) 4 Cl 2] NO 3. Recuerde que la polaridad de una molécula o ion está determinada por los dipolos de enlace (que se deben a la diferencia en la electronegatividad de los átomos de enlace) y su disposición en el espacio. En un isómero, los ligandos de cloruro cis causan más densidad de electrones en un lado de la molécula que en el otro, haciéndola polar. Para el isómero trans, cada ligando está directamente frente a un ligando idéntico, por lo que los dipolos de enlace se cancelan y la molécula es no polar.
Identificar qué isómero geométrico de [Pt (NH 3) 2 Cl 2] se muestra en la Figura\(\PageIndex{9}\) b. Dibujar el otro isómero geométrico y dar su nombre completo.
Solución
En la Figura\(\PageIndex{9}\) b, los dos ligandos de cloro ocupan posiciones cis. La otra forma se muestra a continuación. Al nombrar isómeros específicos, el descriptor aparece delante del nombre. Por lo tanto, este complejo es trans-diaminodicloroplatino (II).
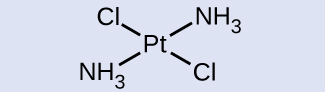
El isómero trans de [Pt (NH 3) 2 Cl 2] tiene cada ligando directamente frente a un ligando adyacente.
Dibujar el ion trans -diaqua- trans -dibromo- trans -diclorocobalto (II).
- Contestar
-
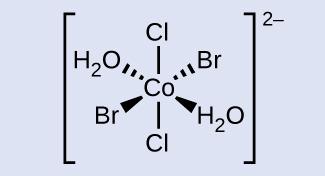
El cobalto se ubica en el centro con las cuñas izquierda y derecha conectadas al bromo y H 2 O respectivamente. Las líneas discontinuas izquierda y derecha están conectadas a H 2 O y bromo respectivamente. Apuntando directamente hacia arriba y hacia abajo opuestos uno del otro está el cloro. Toda la fórmula estructural está encerrada entre corchetes con un superíndice de 2 negativos.
Otro tipo importante de isómeros son los isómeros ópticos, o enantiómeros, en los que dos objetos son imágenes especulares exactas entre sí pero no pueden alinearse para que todas las partes coincidan. Esto significa que los isómeros ópticos son imágenes especulares no superponibles. Un ejemplo clásico de esto es un par de manos, en las que la mano derecha e izquierda son imágenes especulares entre sí pero no se pueden superponer. Los isómeros ópticos son muy importantes en la bioquímica y orgánica porque los sistemas vivos a menudo incorporan un isómero óptico específico y no el otro. A diferencia de los isómeros geométricos, los pares de isómeros ópticos tienen propiedades idénticas (punto de ebullición, polaridad, solubilidad, etc.). Los isómeros ópticos difieren solo en la forma en que afectan a la luz polarizada y cómo reaccionan con otros isómeros ópticos. Para los complejos de coordinación, muchos compuestos de coordinación tales como [M (en) 3] n+ [en los que Mn+ es un ion metálico central como el hierro (III) o el cobalto (II)] forman enantiómeros, como se muestra en la Figura\(\PageIndex{11}\). These two isomers will react differently with other optical isomers. For example, DNA helices are optical isomers, and the form that occurs in nature (right-handed DNA) will bind to only one isomer of [M(en)3]n+ and not the other.
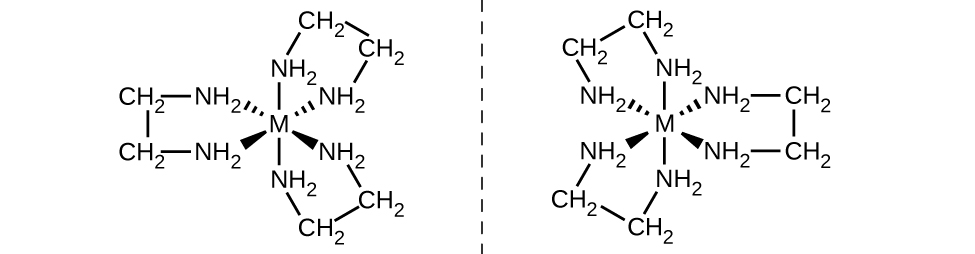
The [Co(en)2Cl2]+ ion exhibits geometric isomerism (cis/trans), and its cis isomer exists as a pair of optical isomers (Figure \(\PageIndex{12}\)).

Linkage isomers occur when the coordination compound contains a ligand that can bind to the transition metal center through two different atoms. For example, the CN ligand can bind through the carbon atom (cyano) or through the nitrogen atom (isocyano). Similarly, SCN− can be bound through the sulfur or nitrogen atom, affording two distinct compounds ([Co(NH3)5SCN]2+ or [Co(NH3)5NCS]2+).
Ionization isomers (or coordination isomers) occur when one anionic ligand in the inner coordination sphere is replaced with the counter ion from the outer coordination sphere. A simple example of two ionization isomers are [CoCl6][Br] and [CoCl5Br][Cl].
Coordination Complexes in Nature and Technology
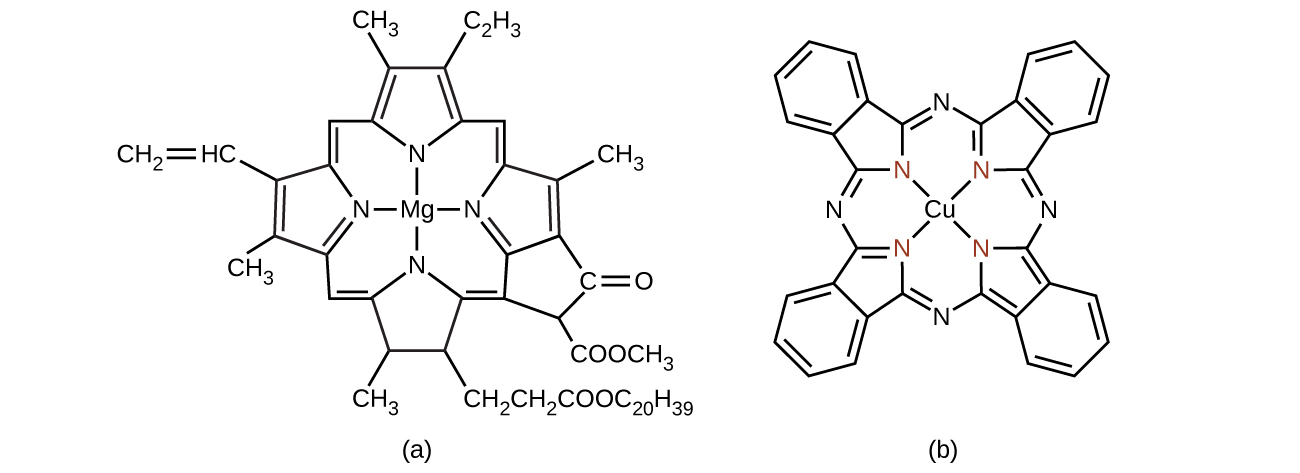
Chlorophyll, the green pigment in plants, is a complex that contains magnesium (Figure \(\PageIndex{13}\)). This is an example of a main group element in a coordination complex. Plants appear green because chlorophyll absorbs red and purple light; the reflected light consequently appears green. The energy resulting from the absorption of light is used in photosynthesis.
Transition Metal Catalysts
One of the most important applications of transition metals is as industrial catalysts. As you recall from the chapter on kinetics, a catalyst increases the rate of reaction by lowering the activation energy and is regenerated in the catalytic cycle. Over 90% of all manufactured products are made with the aid of one or more catalysts. The ability to bind ligands and change oxidation states makes transition metal catalysts well suited for catalytic applications. Vanadium oxide is used to produce 230,000,000 tons of sulfuric acid worldwide each year, which in turn is used to make everything from fertilizers to cans for food. Plastics are made with the aid of transition metal catalysts, along with detergents, fertilizers, paints, and more (Figure \(\PageIndex{14}\)). Very complicated pharmaceuticals are manufactured with catalysts that are selective, reacting with one specific bond out of a large number of possibilities. Catalysts allow processes to be more economical and more environmentally friendly. Developing new catalysts and better understanding of existing systems are important areas of current research.

Many other coordination complexes are also brightly colored. The square planar copper(II) complex phthalocyanine blue (from Figure \(\PageIndex{13}\)) is one of many complexes used as pigments or dyes. This complex is used in blue ink, blue jeans, and certain blue paints.
The structure of heme (Figure \(\PageIndex{15}\)), the iron-containing complex in hemoglobin, is very similar to that in chlorophyll. In hemoglobin, the red heme complex is bonded to a large protein molecule (globin) by the attachment of the protein to the heme ligand. Oxygen molecules are transported by hemoglobin in the blood by being bound to the iron center. When the hemoglobin loses its oxygen, the color changes to a bluish red. Hemoglobin will only transport oxygen if the iron is Fe2+; oxidation of the iron to Fe3+ prevents oxygen transport.
Complexing agents often are used for water softening because they tie up such ions as Ca2+, Mg2+, and Fe2+, which make water hard. Many metal ions are also undesirable in food products because these ions can catalyze reactions that change the color of food. Coordination complexes are useful as preservatives. For example, the ligand EDTA, (HO2CCH2)2NCH2CH2N(CH2CO2H)2, coordinates to metal ions through six donor atoms and prevents the metals from reacting (Figure \(\PageIndex{16}\)). This ligand also is used to sequester metal ions in paper production, textiles, and detergents, and has pharmaceutical uses.
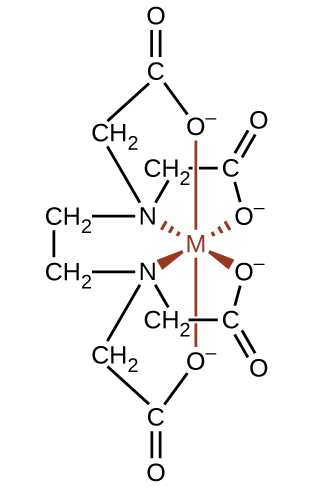
Complexing agents that tie up metal ions are also used as drugs. British Anti-Lewisite (BAL), HSCH2CH(SH)CH2OH, is a drug developed during World War I as an antidote for the arsenic-based war gas Lewisite. BAL is now used to treat poisoning by heavy metals, such as arsenic, mercury, thallium, and chromium. The drug is a ligand and functions by making a water-soluble chelate of the metal; the kidneys eliminate this metal chelate (Figure \(\PageIndex{17}\)). Another polydentate ligand, enterobactin, which is isolated from certain bacteria, is used to form complexes of iron and thereby to control the severe iron buildup found in patients suffering from blood diseases such as Cooley’s anemia, who require frequent transfusions. As the transfused blood breaks down, the usual metabolic processes that remove iron are overloaded, and excess iron can build up to fatal levels. Enterobactin forms a water-soluble complex with excess iron, and the body can safely eliminate this complex.

Ligands like BAL and enterobactin are important in medical treatments for heavy metal poisoning. However, chelation therapies can disrupt the normal concentration of ions in the body, leading to serious side effects, so researchers are searching for new chelation drugs. One drug that has been developed is dimercaptosuccinic acid (DMSA), shown in Figure \(\PageIndex{18}\). Identify which atoms in this molecule could act as donor atoms.
Solution
All of the oxygen and sulfur atoms have lone pairs of electrons that can be used to coordinate to a metal center, so there are six possible donor atoms. Geometrically, only two of these atoms can be coordinated to a metal at once. The most common binding mode involves the coordination of one sulfur atom and one oxygen atom, forming a five-member ring with the metal.
Some alternative medicine practitioners recommend chelation treatments for ailments that are not clearly related to heavy metals, such as cancer and autism, although the practice is discouraged by many scientific organizations.1 Identify at least two biologically important metals that could be disrupted by chelation therapy.
- Answer
-
Ca, Fe, Zn, and Cu
Ligands are also used in the electroplating industry. When metal ions are reduced to produce thin metal coatings, metals can clump together to form clusters and nanoparticles. When metal coordination complexes are used, the ligands keep the metal atoms isolated from each other. It has been found that many metals plate out as a smoother, more uniform, better-looking, and more adherent surface when plated from a bath containing the metal as a complex ion. Thus, complexes such as [Ag(CN)2]− and [Au(CN)2]− are used extensively in the electroplating industry.
In 1965, scientists at Michigan State University discovered that there was a platinum complex that inhibited cell division in certain microorganisms. Later work showed that the complex was cis-diaminedichloroplatinum(II), [Pt(NH3)2(Cl)2], and that the trans isomer was not effective. The inhibition of cell division indicated that this square planar compound could be an anticancer agent. In 1978, the US Food and Drug Administration approved this compound, known as cisplatin, for use in the treatment of certain forms of cancer. Since that time, many similar platinum compounds have been developed for the treatment of cancer. In all cases, these are the cis isomers and never the trans isomers. The diamine (NH3)2 portion is retained with other groups, replacing the dichloro [(Cl)2] portion. The newer drugs include carboplatin, oxaliplatin, and satraplatin.
Summary
The transition elements and main group elements can form coordination compounds, or complexes, in which a central metal atom or ion is bonded to one or more ligands by coordinate covalent bonds. Ligands with more than one donor atom are called polydentate ligands and form chelates. The common geometries found in complexes are tetrahedral and square planar (both with a coordination number of four) and octahedral (with a coordination number of six). Cis and trans configurations are possible in some octahedral and square planar complexes. In addition to these geometrical isomers, optical isomers (molecules or ions that are mirror images but not superimposable) are possible in certain octahedral complexes. Coordination complexes have a wide variety of uses including oxygen transport in blood, water purification, and pharmaceutical use.
Footnotes
- National Council against Health Fraud, NCAHF Policy Statement on Chelation Therapy, (Peabody, MA, 2002).
Glossary
- bidentate ligand
- ligand that coordinates to one central metal through coordinate bonds from two different atoms
- central metal
- ion or atom to which one or more ligands is attached through coordinate covalent bonds
- chelate
- complex formed from a polydentate ligand attached to a central metal
- chelating ligand
- ligand that attaches to a central metal ion by bonds from two or more donor atoms
- cis configuration
- configuration of a geometrical isomer in which two similar groups are on the same side of an imaginary reference line on the molecule
- coordination compound
- substance consisting of atoms, molecules, or ions attached to a central atom through Lewis acid-base interactions
- coordination number
- number of coordinate covalent bonds to the central metal atom in a complex or the number of closest contacts to an atom in a crystalline form
- coordination sphere
- central metal atom or ion plus the attached ligands of a complex
- donor atom
- atom in a ligand with a lone pair of electrons that forms a coordinate covalent bond to a central metal
- ionization isomer
- (or coordination isomer) isomer in which an anionic ligand is replaced by the counter ion in the inner coordination sphere
- ligand
- ion or neutral molecule attached to the central metal ion in a coordination compound
- linkage isomer
- coordination compound that possesses a ligand that can bind to the transition metal in two different ways (CN− vs. NC−)
- monodentate
- ligand that attaches to a central metal through just one coordinate covalent bond
- optical isomer
- (also, enantiomer) molecule that is a nonsuperimposable mirror image with identical chemical and physical properties, except when it reacts with other optical isomers
- polydentate ligand
- ligand that is attached to a central metal ion by bonds from two or more donor atoms, named with prefixes specifying how many donors are present (e.g., hexadentate = six coordinate bonds formed)
- trans configuration
- configuration of a geometrical isomer in which two similar groups are on opposite sides of an imaginary reference line on the molecule


