8.13.1.1: Propiedades Atómicas y Físicas de los Halógenos
- Page ID
- 81379
En esta página se analizan las tendencias en las propiedades atómicas y físicas de los elementos del Grupo 7 (los halógenos): flúor, cloro, bromo y yodo. Las secciones siguientes cubren las tendencias en radio atómico, electronegatividad, afinidad electrónica, puntos de fusión y ebullición, y solubilidad, incluyendo una discusión de las entalpías de enlace de los enlaces halógeno-halógeno e hidrógeno-halógeno.
Tendencias en Radio Atómico

La figura anterior muestra el incremento del radio atómico hacia abajo del grupo.
Explicando el incremento del radio atómico
El radio de un átomo está determinado por:
- el número de capas de electrones alrededor del núcleo
- el tirón que sienten los electrones externos del núcleo.
Compara los números de electrones en cada capa de flúor y cloro:
| F | 2,7 | |
| Cl | 2,8,7 |
En cada caso, los electrones externos sienten una carga neta +7 desde el núcleo. La carga positiva en el núcleo es neutralizada por los electrones internos negativos.

Esto es cierto para todos los átomos del Grupo 7: los electrones externos experimentan una carga neta de +7..
El único factor que afecta el tamaño del átomo es, por lo tanto, el número de capas de electrones internos que rodean al átomo. Más capas ocupan más espacio debido a la repulsión de electrones, por lo que los átomos aumentan de tamaño en el grupo.
Tendencias en Electronegatividad
La electronegatividad es una medida de la tendencia de un átomo a atraer un par de electrones de unión. Por lo general, se mide en la escala Pauling, en la que al elemento más electronegativo (flúor) se le asigna una electronegatividad de 4.0. La siguiente figura muestra electronegatividades para cada halógeno:

Observe que la electronegatividad disminuye a lo largo del grupo. Los átomos se vuelven menos efectivos para atraer pares de electrones. Este efecto se ilustra a continuación usando diagramas simples de puntos y cruces para fluoruro de hidrógeno y cloruro de hidrógeno:

El par de electrones de enlace entre el hidrógeno y el halógeno experimenta la misma atracción neta de +7 tanto del flúor como del cloro. Sin embargo, en el caso del cloro, el núcleo está más alejado de los electrones de unión, que por lo tanto no son tan fuertemente atraídos como en el caso del flúor.
La atracción más fuerte del núcleo de flúor más cercano hace que el flúor sea más electronegativo que el cloro.
Resumiendo la tendencia a la baja del Grupo
A medida que los átomos de halógeno aumentan de tamaño, cualquier par de enlaces se aleja más del núcleo halógeno, y por lo tanto se atrae menos fuertemente hacia él. De ahí que, en el fondo del grupo, los elementos se vuelven menos electronegativos.
Tendencias en la afinidad del primer electrón
La primera afinidad electrónica es la energía liberada cuando 1 mol de átomos gaseosos adquiere cada uno un electrón para formar 1 mol de 1-iones gaseosos. En otras palabras, es la energía liberada en el siguiente proceso:
\[ X(g) + e^- \rightarrow X^- (g)\]
Las afinidades de los primeros electrones tienen valores negativos por convención. Por ejemplo, la primera afinidad electrónica del cloro es de -349 kJ mol -1. El signo negativo indica una liberación de energía.
Las primeras afinidades de electrones de los elementos del Grupo 7
La afinidad electrónica es una medida de la atracción entre el electrón entrante y el núcleo. Existe una correlación positiva entre la atracción y la afinidad electrónica. La tendencia a la baja del grupo se ilustra a continuación:

Observe que la tendencia a la baja del grupo es inconsistente. Las afinidades electrónicas generalmente disminuyen (es decir, se emite menos calor), pero el valor de flúor se desvía de esta tendencia.

En el átomo más grande, la atracción del núcleo más positivo se compensa con los electrones de cribado adicionales, por lo que cada electrón entrante siente el efecto de una carga neta +7 desde el centro.
A medida que el átomo aumenta de tamaño, el electrón entrante está más lejos del núcleo y por lo tanto siente menos atracción. Por lo tanto, la afinidad electrónica disminuye en el grupo. Sin embargo, el flúor es un átomo muy pequeño, con el electrón entrante relativamente cerca del núcleo, y sin embargo la afinidad electrónica es menor de lo esperado.
Otro efecto debe ser considerado en el caso del flúor. A medida que el nuevo electrón viene se acerca al átomo, entra en una región del espacio ya muy negativamente cargada debido a los electrones existentes. La repulsión resultante de estos electrones compensa parte de la atracción del núcleo.
Debido a que el átomo de flúor es muy pequeño, su densidad electrónica existente es muy alta. Por lo tanto, la repulsión extra es particularmente grande y disminuye la atracción del núcleo lo suficiente como para disminuir la afinidad electrónica por debajo de la del cloro.
Tendencias en el punto de fusión y punto de ebullición
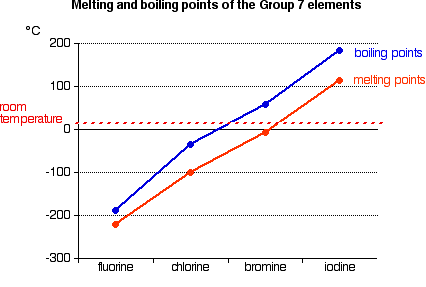
Los puntos de fusión y ebullición aumentan en el grupo. Como indica la gráfica anterior, el flúor y el cloro son gases a temperatura ambiente, el bromo es un líquido y el yodo un sólido.
Explicación de las tendencias en punto de fusión y punto de ebullición
Todos los halógenos existen como moléculas diatómicas—F 2, Cl 2, etc. Las fuerzas de dispersión de van der Waals son las principales atracciones intermoleculares entre una molécula y sus vecinos. Las moléculas más grandes más abajo del grupo tienen más electrones que pueden moverse y formar los dipolos temporales que crean estas fuerzas.
Las atracciones intermoleculares más fuertes del grupo requieren más energía térmica para fundir o vaporizar, aumentando sus puntos de fusión o ebullición.
Solubilidades
Solubilidad en agua
El flúor reacciona violentamente con el agua para producir fluoruro de hidrógeno acuoso o gaseoso y una mezcla de oxígeno y ozono; su solubilidad no tiene sentido. El cloro, el bromo y el yodo se disuelven en el agua hasta cierto punto, pero nuevamente no hay un patrón discernible. La siguiente tabla muestra la solubilidad de los tres elementos en agua a 25°C:
| solubilidad (mol dm -3) |
|
|---|---|
| cloro | 0.091 |
| bromo | 0.21 |
| yodo | 0.0013 |
El cloro disuelto en agua produce una solución verde pálido. La solución de bromo adopta una gama de colores desde el amarillo hasta el rojo anaranjado oscuro dependiendo de la concentración. La solución de yodo en agua es de color marrón muy pálido. El cloro reacciona con el agua hasta cierto punto, produciendo una mezcla de ácido clorhídrico y ácido clórico (I) (también conocido como ácido hipocloroso). La reacción es reversible, y en cualquier momento solo alrededor de un tercio de las moléculas de cloro han reaccionado.
\[ Cl_2 + H_2O \rightleftharpoons HCl + HClO\]
El ácido clórico (I) a veces se simboliza como HOCl, lo que indica el patrón de unión del patrón real. El bromo y el yodo forman compuestos similares, pero en menor medida. En ambos casos, alrededor del 99.5% del halógeno permanece sin reaccionar.
La solubilidad del yodo en solución de yoduro de potasio
Aunque el yodo es solo ligeramente soluble en agua, se disuelve libremente en solución de yoduro de potasio, formando una solución de color marrón rojizo oscuro. Una reacción reversible entre las moléculas de yodo y los iones yoduro da I 3 - iones. Estos son los responsables del color. En el laboratorio, el yodo a menudo se produce a través de la oxidación de iones yoduro. Siempre y cuando haya algún exceso de iones yoduro presente, el yodo reacciona para formar I 3 -. Una vez que todos los iones yoduro han reaccionado, el yodo se precipita como un sólido gris oscuro.
Solubilidad en hexano
Los halógenos son mucho más solubles en disolventes orgánicos como el hexano que en el agua. Tanto el hexano como los halógenos son moléculas no polares, por lo que las únicas fuerzas intermoleculares entre ellos son las fuerzas de dispersión de van der Waals. Debido a esto, los atractivos rotos (entre moléculas de hexano y entre moléculas halógenas) son similares a los nuevos atractivos que se hacen cuando las dos sustancias se mezclan. Las soluciones orgánicas de yodo son de color rosa-púrpura.
Entalpías de enlace (energías de enlace o fuerzas de unión)
La entalpía de enlace es el calor requerido para romper un mol de enlaces covalentes para producir átomos individuales, partiendo de la sustancia original en estado gaseoso, y terminando con átomos gaseosos. Para el cloro, Cl 2 (g), es la energía térmica requerida para la siguiente reacción, por mol:
\[ Cl-Cl (g) \rightarrow 2Cl(g)\]
Aunque el bromo es un líquido, la entalpía del enlace se define en términos de moléculas y átomos de bromo gaseoso, como se muestra a continuación:
Entalpía de enlace en los halógenos, X 2 (g)
La unión covalente es efectiva porque el par de enlaces es atraído a ambos núcleos a cada lado del mismo. Es esa atracción la que mantiene unida a la molécula. La extensión de la atracción depende en parte de las distancias entre el par de unión y los dos núcleos. La siguiente figura ilustra dicho enlace covalente:

En todos los halógenos, el par de unión experimenta una carga neta +7 desde cada extremo del enlace, debido a que la carga en el núcleo está compensada por los electrones internos. A medida que los átomos se hacen más grandes en el grupo, el par de enlaces está más lejos de los núcleos y la fuerza del enlace debería, en teoría, disminuir, como se indica en la siguiente figura. La pregunta es si los datos experimentales concuerdan con esta predicción.


Como se desprende de la figura anterior, las entalpías de enlace de los enlaces Cl-Cl, Br-Br e I-I disminuyen como se predijo, pero la entalpía del enlace F-F se desvía.
Debido a que los átomos de flúor son tan pequeños, se espera un enlace fuerte, de hecho, es notablemente débil. Debe haber otro factor a consideración.
Además del par de unión de electrones entre los dos átomos, cada átomo tiene 3 pares solitarios de electrones en la capa externa. Si el enlace es muy corto, como en F-F, los pares solitarios en los dos átomos están lo suficientemente cerca como para causar una repulsión significativa, que se ilustra a continuación:

En el caso del flúor, esta repulsión es lo suficientemente grande como para contrarrestar gran parte de la atracción entre el par de unión y los dos núcleos. Esto debilita el vínculo.
Entalpías de enlace en los haluros de hidrógeno, H X (g)
Si el átomo de halógeno está unido a un átomo de hidrógeno, esto no ocurre; no hay pares solitarios en un átomo de hidrógeno. Las entalpías de enlace para los enlaces halógeno-hidrógeno se dan a continuación:
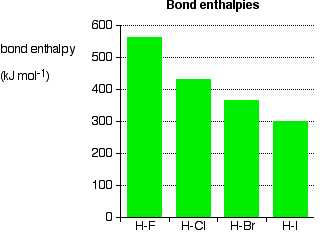
A medida que están involucrados halógenos más grandes, el par de unión está más distante del núcleo. Se disminuye la atracción, y el vínculo debe ser más débil; esto se sustenta en los datos, sin excepción. Este hecho tiene implicaciones significativas para la estabilidad térmica de los haluros de hidrógeno: se rompen fácilmente en hidrógeno y halógeno al calentarlos.
El fluoruro de hidrógeno y el cloruro de hidrógeno son térmicamente muy estables en condiciones típicas de laboratorio. El bromuro de hidrógeno se descompone hasta cierto punto en hidrógeno y bromo al calentarse, y el yoduro de hidrógeno es aún menos estable cuando se calienta. Los enlaces más débiles se rompen más fácilmente.
Colaboradores y Atribuciones
Jim Clark (Chemguide.co.uk)


