8.13.3: Química del Flúor (Z=9)
- Page ID
- 81414
El flúor (F) es el primer elemento en el grupo Halógeno (grupo 17) en la tabla periódica. Su número atómico es 9 y su peso atómico es 19, y es un gas a temperatura ambiente. Es el elemento más electronegativo, dado que es el elemento superior en el Grupo Halógeno, y por lo tanto es muy reactivo. Es un no metal, y es uno de los pocos elementos que pueden formar moléculas diatómicas (F 2). Tiene 5 electrones de valencia en el nivel 2p. Su configuración electrónica es 1s 2 2s 2 2p 5. Por lo general, formará el anión F - ya que es extremadamente electronegativo y un agente oxidante fuerte. El flúor es un ácido de Lewis en ácido débil, lo que significa que acepta electrones al reaccionar. El flúor tiene muchos isótopos, pero el único estable que se encuentra en la naturaleza es el F-19.
Tabla de referencia rápida
| Símbolo | F |
|---|---|
| Número atómico | 9 |
| Grupo | 17 (halógenos) |
| Configuración de electrones | 1s 2 2s 2 2p 5 |
| Peso atómico | 18.998 g |
| Densidad | 1.7 g/L |
| Punto de fusión | -219.62 o C |
| Punto de ebullición | -188.12 o C |
| Punto Crítico | 144.13K, 5.172 MPa |
| Estados de Oxidación | -1 |
| Electronegatividad | 3.98 |
| Isótopos estables | F-19 |
Breve historia
A finales del 1600 se utilizaron minerales que ahora sabemos que contienen flúor en el grabado de vidrio. El descubrimiento del elemento fue impulsado por la búsqueda de la sustancia química que pudo atacar al vidrio (es HF, un ácido débil). La historia temprana del aislamiento y trabajo con flúor y fluoruro de hidrógeno está llena de accidentes ya que ambos son extremadamente peligrosos. Finalmente, la electrólisis de una mezcla de KF y HF (asegurando cuidadosamente que el hidrógeno y el flúor resultantes no entrarían en contacto) en un aparato de platino produjo el elemento.

El flúor fue descubierto en 1530 por Georgius Agricola. Originalmente lo encontró en el compuesto Fluorspar, el cual fue utilizado para promover la fusión de metales. Fue bajo esta aplicación hasta 1670, cuando Schwanhard descubrió su utilidad en el grabado de vidrio. El flúor puro (del latín fluere, para “flujo”) no fue aislado hasta 1886 por Henri Moissan, quemando e incluso matando a muchos científicos en el camino. Tiene muchos usos hoy en día, uno en particular que se utiliza en el proyecto Manhattan para ayudar a crear la primera bomba nuclear.
Electronegatividad del Flúor
El flúor es el elemento más electronegativo de la tabla periódica, lo que significa que es un agente oxidante muy fuerte y acepta electrones de otros elementos. La configuración de electrones atómicos del flúor es 1s 2 2s 2 2p 5. (ver Figura 2)
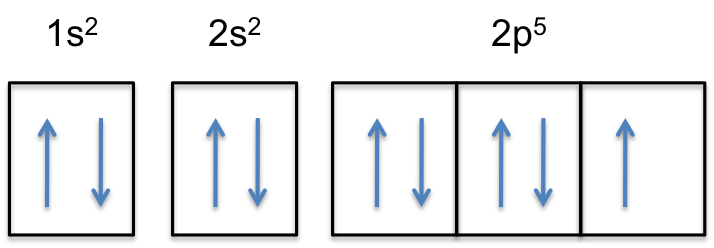
El flúor es el elemento más electronegativo porque tiene 5 electrones en su caparazón 2P. La configuración electrónica óptima del orbital 2P contiene 6 electrones, por lo que dado que el flúor está tan cerca de la configuración electrónica ideal, los electrones se mantienen muy apretados al núcleo. La alta electronegatividad del flúor explica su pequeño radio porque los protones positivos tienen una atracción muy fuerte hacia los electrones negativos, manteniéndolos más cerca del núcleo que los elementos más grandes y menos electronegativos.
Reacciones del Flúor
Debido a su reactividad, el flúor elemental nunca se encuentra en la naturaleza y ningún otro elemento químico puede desplazar al flúor de sus compuestos. El flúor se une con casi cualquier elemento, tanto metales como no metálicos, debido a que es un agente oxidante muy fuerte. Es muy inestable y reactivo ya que está muy cerca de su configuración electrónica ideal. Forma enlaces covalentes con los no metales, y como es el elemento más electronegativo, siempre va a ser el elemento que se reduzca. También puede formar un elemento diatómico con su elfo (\(F_2\)), o enlaces covalentes donde oxida otros halógenos s (\(ClF\),\(ClF_3\),\(ClF_5\)). Reaccionará explosivamente con muchos elementos y compuestos como el Hidrógeno y el agua. Elemental El Flúor es ligeramente básico, lo que significa que cuando reacciona con el agua se forma\(OH^-\).
\[3F_2+2H_2O \rightarrow O_2+4HF \tag{1}\]
Cuando se combina con hidrógeno, el flúor forma ácido fluorhídrico (\(HF\)), que es un ácido débil. Este ácido es muy peligroso y cuando se disocia puede causar daños graves al cuerpo ya que si bien puede no ser doloroso inicialmente, pasa por los tejidos rápidamente y puede provocar quemaduras profundas que interfieren con la función nerviosa.
\[HF+H_2O \rightarrow H_3O^++F^- \tag{2}\]
También hay algunos compuestos orgánicos hechos de Flúor, que van desde no tóxicos hasta altamente tóxicos. El flúor forma enlaces covalentes con el Carbono, que a veces se forman en anillos aromáticos estables. Cuando el Carbono reacciona con Flúor la reacción es compleja y forma una mezcla de\(CF_4\),\(C_2F_6\), un\(C_5F_{12}\).
\[C_{(s)} + F_{2(g)} \rightarrow CF_{4(g)} + C_2F_6 + C_5F_{12} \tag{3}\]
El flúor reacciona con el Oxígeno para formar\(OF_2\) ser causa El flúor es más electronegativo que el Oxígeno. La reacción va:
\[2F_2 + O_2 \rightarrow 2OF_2 \tag{4}\]
El flúor es tan electronegativo que a veces incluso formará moléculas con gases nobles como el Xenon, como la molécula Difluoruro de Xenon,\(XeF_2\).
\[Xe + F_2 \rightarrow XeF_2 \tag{5}\]
El flúor también forma compuestos iónicos fuertes con los metales. Algunas reacciones iónicas comunes del flúor son:
\[F_2 + 2NaOH \rightarrow O_2 + 2NaF +H_2 \tag{6}\]
\[4F_2 + HCl + H_2O \rightarrow 3HF + OF_2 + ClF_3 \tag{7}\]
\[F_2 + 2HNO_3 \rightarrow 2NO_3F + H_2 \tag{8}\]
Aplicaciones de Flúor
Los compuestos de flúor están presentes en la pasta dental fluorada y en muchos sistemas de agua municipales donde ayudan a prevenir la caries dental. Y, por supuesto, los fluorocarbonos como el Teflón han tenido un gran impacto en la vida en el siglo XX. Hay muchas aplicaciones del flúor:
- Combustibles para cohetes
- Producción de polímeros y plásticos
- producción de teflón y tefzel
- Cuando se combina con oxígeno, se usa como enfriador de refrigerador
- Ácido fluorhídrico utilizado para el grabado de vidrio
- Purificar suministros públicos de agua
- Producción de uranio
- Aire acondicionado
Fuentes
El flúor puede encontrarse en la naturaleza o producirse en un laboratorio. Para hacerlo en un laboratorio, compuestos como el Fluoruro de Potasio se ponen a través de electrólisis con ácido fluorhídrico para crear flúor puro y otros compuestos. Se puede llevar a cabo con una variedad de compuestos, generalmente iónicos que involucran Flúor y un metal. El flúor también se puede encontrar en la naturaleza en diversos minerales y compuestos. Los dos compuestos principales en los que se puede encontrar son Fluorspar (\(CaF_2\)) y Cryolite (\(Na_3AlF_6\)).
Referencias
- Newth, G. S. Química Inorgánica. Longmans, Green y Co. :Nueva York, 1903.
- Latimer, Wendell M., Hildebrand, Joel H. Libro de Referencia de Química Inorgánica. The Macmillan Company: Nueva York, 1938.
Problemas
(Resaltar para ver las respuestas)
1. P. ¿Cuál es la configuración electrónica del Flúor? de F -?
A. 1s 2 2s 2 2p 5
1s 2 2s 2 2p 6
2. P. ¿El flúor suele oxidarse o reducirse? explicar.
A. El flúor suele reducirse porque acepta un electrón de otros elementos ya que es tan electronegativo.
3. P. ¿Cuáles son algunos usos comunes del Flúor?
A. Pasta de dientes, plásticos, combustibles para cohetes, grabado de vidrio, etc.
4. P. ¿El flúor forma compuestos con no metales? en caso afirmativo, dar dos ejemplos, siendo uno de ellos de un óxido.
A. DE 2, CLF
5. P. ¿En qué grupo está el Flúor? (incluya el nombre del grupo y el número)
A. 17, Halogenos
Colaboradores y Atribuciones
- Rachel Feldman (Universidad de California, Davis)
Stephen R. Marsden (ChemTopics)

