8.13.2.7: La acidez de los haluros de hidrógeno
- Page ID
- 81369
Esta página analiza la acidez de los haluros de hidrógeno: fluoruro de hidrógeno, cloruro de hidrógeno, bromuro de hidrógeno y yoduro de hidrógeno. Comienza describiendo sus propiedades físicas y síntesis y luego explica qué sucede cuando reaccionan con el agua para elaborar ácidos como el ácido fluorhídrico y el ácido clorhídrico.
Propiedades físicas
Los haluros de hidrógeno son gases incoloros a temperatura ambiente, produciendo humos humeantes en aire húmedo. Los puntos de ebullición de estos compuestos se muestran en la siguiente figura:

El fluoruro de hidrógeno tiene un punto de ebullición anormalmente alto para una molécula de su tamaño (293 K o 20°C), y puede condensarse en condiciones frías. Esto se debe a que el fluoruro de hidrógeno puede formar enlaces de hidrógeno. Debido a que el flúor es el más electronegativo de todos los elementos, el enlace fluor-hidrógeno es altamente polarizado. El átomo de hidrógeno lleva una carga positiva parcial alta (δ+); el flúor está bastante cargado negativamente (δ-).
Además, cada átomo de flúor tiene 3 pares solitarios de electrones. Los electrones externos del flúor están en el nivel n=2, y los pares solitarios representan regiones pequeñas y altamente cargadas del espacio. Se forman enlaces de hidrógeno entre el hidrógeno δ+ en una molécula de HF y un par solitario en el flúor de otra. La figura a continuación ilustra esta asociación:
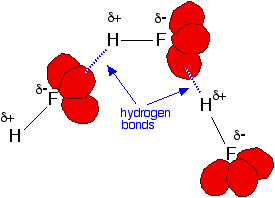
Los otros haluros de hidrógeno no forman enlaces de hidrógeno porque los halógenos más grandes no son tan electronegativos como el flúor; por lo tanto, los enlaces son menos polares. Además, sus pares solitarios están en niveles de energía más altos, por lo que el halógeno no porta una carga negativa tan intensamente concentrada; por lo tanto, otros átomos de hidrógeno no son atraídos con tanta fuerza.
Fabricación de haluros de hidrógeno
Existen varias formas de sintetizar haluros de hidrógeno; el método que se considera aquí es la reacción entre un haluro iónico, como el cloruro de sodio, y un ácido como el ácido fosfórico concentrado (V), H 3 PO 4, o ácido sulfúrico concentrado.
Fabricación de cloruro de hidrógeno
Cuando se agrega ácido sulfúrico concentrado al cloruro de sodio en condiciones frías, el ácido dona un protón a un ion cloruro, formando cloruro de hidrógeno. En fase gaseosa, se escapa inmediatamente del sistema.
\[ Cl^- + H_2SO_4 \rightarrow HCl + HSO_4^-\]
La ecuación completa para la reacción es:
\[ NaCl + H_2SO_4 \rightarrow HCl + NaHSO_4\]
También se forma bisulfato de sodio en la reacción. El ácido fosfórico concentrado (V) reacciona de manera similar, de acuerdo con la siguiente ecuación:
\[ Cl^- + H_3PO_4 \rightarrow HCl + H_2PO_4^-\]
La ecuación iónica completa que muestra la formación de la sal, bifosfato de sodio (V), se da a continuación:
\[ NaCl + H_3PO_4 \rightarrow HCl + NaH_2PO_4\]
Fabricación de otros haluros de hidrógeno
Todos los haluros de hidrógeno se pueden formar por el mismo método, utilizando ácido fosfórico concentrado (V).
El ácido sulfúrico concentrado, sin embargo, se comporta de manera diferente. El fluoruro de hidrógeno se puede hacer con ácido sulfúrico, pero el bromuro de hidrógeno y el yoduro de hidrógeno no.
El problema es que el ácido sulfúrico concentrado es un agente oxidante, y además de producir bromuro de hidrógeno o yoduro de hidrógeno, algunos de los iones haluro se oxidan a bromo o yodo. El ácido fosfórico no tiene esta capacidad porque no es un oxidante.
La acidez de los haluros de hidrógeno
Cloruro de hidrógeno como ácido
Según la definición de Bronsted-Lowry de un ácido como donante de protones, el cloruro de hidrógeno es un ácido porque transfiere protones a otras especies. Considera su reacción con el agua.
El gas cloruro de hidrógeno es soluble en agua; su forma solvatada es el ácido clorhídrico. Los humos de cloruro de hidrógeno en el aire húmedo son causados por el cloruro de hidrógeno que reacciona con el vapor de agua en el aire para producir una nube de ácido clorhídrico concentrado.
Un protón se dona del cloruro de hidrógeno a uno de los pares solitarios en una molécula de agua.
Se forma un enlace coordinado (covalente dativo) entre el oxígeno y el protón transferido.
La ecuación para la reacción es la siguiente:
\[ H_2O + HCl \rightarrow H_3O^+ + Cl^-\]
El ion H 3 O + es el ion hidroxonio (también conocido como el ion hidronio o el ion oxonio). Esta es la forma normal de protones en el agua; a veces se acorta a la forma protónica, H + (aq), por brevedad.
Cuando el cloruro de hidrógeno se disuelve en agua (para producir ácido clorhídrico), casi todas las moléculas de cloruro de hidrógeno reaccionan de esta manera. Por lo tanto, el ácido clorhídrico es un ácido fuerte. Un ácido es fuerte si está completamente ionizado en solución.
Ácido bromhídrico y ácido yodhídrico como ácidos fuertes
El bromuro de hidrógeno y el yoduro de hidrógeno se disuelven en (y reaccionan con) agua exactamente de la misma manera que el cloruro de hidrógeno. El bromuro de hidrógeno forma ácido bromhídrico; el yoduro de hidrógeno da ácido yodhídrico. Ambos son también ácidos fuertes.
El ácido fluorhídrico como excepción
Por el contrario, aunque el fluoruro de hidrógeno se disuelve libremente en el agua, el ácido fluorhídrico es solo un ácido débil; es similar en fuerza a los ácidos orgánicos como el ácido metanoico. La complicada razón de esto se discute a continuación.
La entalpía de enlace del enlace H-F
Debido a que el átomo de flúor es tan pequeño, la entalpía del enlace (energía de enlace) del enlace hidrógeno-flúor es muy alta. La siguiente tabla da valores para todas las entalpías de enlace hidrógeno-halógeno:
| entalpía de enlace (kJ mol -1) |
|
|---|---|
| H-F | +562 |
| H-Cl | +431 |
| H-Br | +366 |
| H-I | +299 |
Para que los iones se formen cuando el fluoruro de hidrógeno reacciona con el agua, se debe romper el enlace H-F. Parecería razonable decir que la relativa renuencia del fluoruro de hidrógeno a reaccionar con el agua se debe a la gran cantidad de energía necesaria para romper ese enlace, pero esta explicación no se sostiene.
La energética del proceso de HX (g) a X - (aq)
Los energéticos de esta secuencia son de interés:

Todos estos términos están involucrados en el cambio general de entalpía a medida que convierte HX (g) en sus iones en agua.
Sin embargo, los términos que involucran al hidrógeno son los mismos para cada haluro de hidrógeno. Solo se deben considerar los valores para los términos rojos en el diagrama. Los valores se tabulan a continuación:
| entalpía de enlace de HX (kJ mol -1) |
afinidad electrónica de X (kJ mol -1) |
entalpía de hidratación de X - (kJ mol -1) |
suma de estos (kJ mol -1) |
|
|---|---|---|---|---|
| HF | +562 | -328 | -506 | -272 |
| HCl | +431 | -349 | -364 | -282 |
| HBr | +366 | -324 | -335 | -293 |
| HI | +299 | -295 | -293 | -289 |
Prácticamente no hay diferencia en los valores totales de HF y HCl.
La entalpía de enlace grande del enlace H-F se compensa con la gran entalpía de hidratación del ion fluoruro. Hay una atracción muy fuerte entre el muy pequeño ion fluoruro y las moléculas de agua. Esto libera mucho calor (la entalpía de hidratación) cuando el ion fluoruro se envuelve en moléculas de agua.
Otras atracciones en el sistema
Los términos energéticos considerados anteriormente han preocupado a las moléculas HX en fase gaseosa. Para llegar a una explicación más correcta, las moléculas deben ser consideradas primero como moléculas HX acuosas sin reaccionar. La ecuación para esto se da a continuación:

La ecuación se incorpora a un ciclo energético mejorado de la siguiente manera:

Desafortunadamente, los valores para el primer paso de la reacción no están fácilmente disponibles. Sin embargo, en cada caso, la separación inicial del HX de las moléculas de agua es endotérmica. Se requiere energía para romper las atracciones intermoleculares entre las moléculas HX y el agua.
Esa energía es mucho mayor para el fluoruro de hidrógeno porque forma enlaces de hidrógeno con el agua. Los otros haluros de hidrógeno solo experimentan las fuerzas de dispersión más débiles de van der Waals o las atracciones dipolo-dipolo.
Los cambios globales de entalpía (incluyendo todas las etapas del ciclo energético) para las reacciones se dan en la siguiente tabla:
\[ HX(aq) + H_2O (l) \rightarrow H_3O^+ (aq) + X^- (aq)\]
| cambio de entalpía (kJ mol -1) |
|
|---|---|
| HF | -13 |
| HCl | -59 |
| HBr | -63 |
| H-I | -57 |
El cambio de entalpía para HF es mucho menor en magnitud que para los otros tres haluros de hidrógeno, pero sigue siendo un cambio exotérmico negativo. Por lo tanto, se necesita más información para explicar por qué el HF es un ácido débil.
Consideraciones de entropía y energía libre
El cambio de energía libre, no el cambio de entalpía, determina la extensión y dirección de una reacción.
El cambio de energía libre se calcula a partir del cambio de entalpía, la temperatura de la reacción y el cambio de entropía durante la reacción.
Por simplicidad, la entropía puede considerarse como una medida de la cantidad de trastorno en un sistema. A la entropía se le da el símbolo S. Si un sistema se vuelve más desordenado, entonces su entropía aumenta. Si se vuelve más ordenado, su entropía disminuye.
La ecuación clave se da a continuación:

En términos simples, para que ocurra una reacción, el cambio de energía libre debe ser negativo. Pero con mayor precisión, el cambio de energía libre puede usarse para calcular un valor para la constante de equilibrio para una reacción usando la siguiente expresión:

El término Ka es la constante de equilibrio para la reacción siguiente:
\[ HX(aq) + H_2O(l) \rightleftharpoons H_3O^+(aq) + X^-(aq)\]
Los valores para TΔS (necesarios para calcular ΔG) para las cuatro reacciones a una temperatura de 298 K se tabulan a continuación:
| T (kJ mol -1) |
|
|---|---|
| HF | -29 |
| HCl | -13 |
| HBr | -4 |
| H-I | +4 |
Observe que en la parte superior del grupo, los sistemas se vuelven más ordenados cuando el HX reacciona con el agua. La entropía del sistema (la cantidad de trastorno) disminuye, particularmente para el fluoruro de hidrógeno.
La razón de esto es que la atracción muy fuerte entre H 3 O + y F - (aq) impone mucho orden al sistema, al igual que la atracción entre las moléculas de agua y los diversos iones presentes. Estas atracciones son cada una de las mayores para los pequeños iones fluoruro.
Ahora se puede considerar el efecto total sobre el cambio de energía libre, y por lo tanto el valor de la constante de equilibrio. Estos valores se calculan en la siguiente tabla:
(kJ mol -1) |
T (kJ mol -1) |
(kJ mol -1) |
K a (mol dm -3) |
|
|---|---|---|---|---|
| HF | -13 | -29 | +16 | 1.6 x 10 -3 |
| HCl | -59 | -13 | -46 | 1.2 x 10 8 |
| HBr | -63 | -4 | -59 | 2.2 x 10 10 |
| HI | -57 | +4 | -61 | 5.0 x 10 10 |
Los valores para estas constantes de equilibrio estimadas para HCl, HBr e HI son tan altos que la reacción puede considerarse “unidireccional”. La ionización es prácticamente 100% completa. Todos estos son ácidos fuertes, aumentando su fuerza a lo largo del grupo.
Por el contrario, la K a estimada para el ácido fluorhídrico es pequeña. El ácido fluorhídrico solo se ioniza en un grado limitado en el agua. Por lo tanto, es un ácido débil.
El valor estimado para HF en la tabla se puede comparar con el valor experimental:
- Valor experimental: 5.6 x 10 -4 mol dm -3
- Valor estimado: 1.6 x 10 -3 mol dm -3
Estos valores difieren en un orden de magnitud, pero debido a la relación logarítmica entre la energía libre y la constante de equilibrio, un cambio muy pequeño en ΔG tiene un efecto muy grande en K a.
Para tener los valores en estrecha concordancia, ΔG deberá aumentar de +16 a +18.5 kJ mol -1. Dada la incertidumbre en los valores utilizados para calcular ΔG, la diferencia entre el valor calculado y el valor experimental podría caer fácilmente dentro de este rango.
Resumen: ¿Por qué el ácido fluorhídrico es un ácido débil?
Los dos factores principales son:
- La entropía disminuye drásticamente cuando el fluoruro de hidrógeno reacciona con el agua. Esto es particularmente notable con el fluoruro de hidrógeno porque la atracción de los pequeños iones fluoruro producidos impone un orden significativo a las moléculas de agua circundantes y a los iones hidronio cercanos. El efecto disminuye con iones haluro más grandes.
- Existe un enlace de hidrógeno muy fuerte entre las moléculas de fluoruro de hidrógeno y las moléculas de agua. Esto cuesta una gran cantidad de energía para romper. Este efecto no ocurre en los otros haluros de hidrógeno.
Colaboradores y Atribuciones
Jim Clark (Chemguide.co.uk)


