6.6: La ley de gas ideal y algunas aplicaciones
- Page ID
- 75102
- Aprende la ley de gas ideal.
- Aplicar la ley de gas ideal a cualquier conjunto de condiciones de un gas.
- Aplicar la ley de gas ideal a volúmenes molares, densidad y problemas estequiométricos.
Hasta el momento, todas las leyes de gas que hemos considerado han requerido que el gas cambie sus condiciones; entonces predecimos un cambio resultante en una de sus propiedades. ¿Hay alguna ley de gas que relacione las propiedades físicas de un gas en un momento dado? Considerar una extensión adicional de la ley de gas combinado para incluir n. Por analogía a la ley de Avogadro, n se posiciona en el denominador de la fracción, opuesto al volumen. Entonces,
\[\frac{PV}{nT}=constant\nonumber \]
Debido a que la presión, el volumen, la temperatura y la cantidad son las únicas cuatro propiedades físicas independientes de un gas, la constante en la ecuación anterior es verdaderamente una constante. En efecto, debido a que no necesitamos especificar la identidad de un gas para aplicar las leyes de gas, esta constante es la misma para todos los gases. Definimos esta constante con el símbolo R, por lo que la ecuación anterior se escribe como
\[\dfrac{PV}{nT}=R\nonumber \]
que generalmente se reordena como
\[PV = nRT\nonumber \]
Esta ecuación se llama la ley de gas ideal. Relaciona las cuatro propiedades independientes de un gas en cualquier momento. A la constante\(R\) se le llama la constante ideal de la ley del gas. Su valor depende de las unidades utilizadas para expresar presión y volumen.
| Valor Numérico | Unidades |
|---|---|
| 0.08205 | \(\dfrac{L.atm}{mol.K}\) |
| 62.36 | \(\dfrac{L.torr}{mol.K}=\dfrac{L.mmHg}{mol.K}\) |
| 8.314 | \(\dfrac{J}{mol.K}\) |
La ley de gas ideal se usa como cualquier otra ley de gas, con atención prestada a la unidad y expresión de la temperatura en kelvin. Sin embargo, la ley de gas ideal no requiere un cambio en las condiciones de una muestra de gas. La ley de gas ideal implica que si conoces tres de las propiedades físicas de un gas, puedes calcular la cuarta propiedad.
Una muestra de 4.22 moles de\(\ce{Ar}\) tiene una presión de 1.21 atm y una temperatura de 34°C. ¿Cuál es su volumen?
Solución
El primer paso es convertir la temperatura a kelvin:
\[34 + 273 = 307\, \ce{K} \nonumber\]
Ahora podemos sustituir las condiciones en la ley de gas ideal:
\[(1.21atm)(V)=(4.22\, mol)\left(0.08205\dfrac{L.atm}{mol.K}\right)(307\, K)\nonumber \]
La unidad atm está en el numerador de ambos lados, por lo que cancela. En el lado derecho de la ecuación, las unidades mol y K aparecen en el numerador y el denominador, por lo que también cancelan. La única unidad que queda es L, que es la unidad de volumen que estamos buscando. Aislamos la variable de volumen dividiendo ambos lados de la ecuación por 1.21:
\[V=\dfrac{(4.22)(0.08205)(307)}{1.21}L\nonumber \]
Luego resolviendo para volumen, obtenemos V = 87.9 L
Una muestra de 0.0997 mol de\(\ce{O2}\) tiene una presión de 0.692 atm y una temperatura de 333 K. ¿Cuál es su volumen?
- Contestar
-
3.94 L
A una temperatura dada, 0.00332 g de Hg en fase gaseosa tiene una presión de 0.00120 mmHg y un volumen de 435 L. ¿Cuál es su temperatura?
Solución
No se nos da el número de moles de Hg directamente, sino que se nos da una masa. Podemos utilizar la masa molar de Hg para convertir al número de moles.
\[0.00332\cancel{g\, Hg}\times \frac{1\, mol\, Hg}{200.59\cancel{g\, \, Hg}}=0.0000165\, mol=1.65\times 10^{-5}mol\nonumber \]
La presión se da en unidades de milímetros de mercurio. Podemos convertir esto a atmósferas o usar el valor de la constante de gas ideal que incluye la unidad mmHg. Tomaremos la segunda opción. Sustituyendo a la ley de gas ideal,
\[(0.00332\, mm\, Hg)(435\, L)=(1.65\times 10^{-5}mol)(62.36\frac{L.mmHg}{mol.K})T\nonumber \]
Las unidades mmHg, L y mol cancelan, dejando la unidad K, la unidad de temperatura. Aislando T en un lado, obtenemos
\[T=\frac{(0.00332)(435)}{(1.65\times 10^{-5})(62.36)}K\nonumber \]
Luego resolviendo para K, obtenemos T = 1,404 K.
Para una muestra de 0.00554 mol de H 2, P = 23.44 torr y T = 557 K. ¿Cuál es su volumen?
- Contestar
-
8.21 L
La ley de gas ideal también se puede utilizar en problemas de estequiometría.
¿Qué volumen de\(\ce{H2}\) se produce a 299 K y 1.07 atm cuando 55.8 g de\(\ce{Zn}\) metal reaccionan con exceso\(\ce{HCl}\)?
\[\ce{Zn(s) + 2HCl(aq) -> ZnCl2(aq) + H2(g)}\nonumber \]
Solución
Aquí tenemos un problema de estequiometría donde necesitamos encontrar el número de moles de H 2 producidos. Entonces podemos usar la ley de gas ideal, con la temperatura y presión dadas, para determinar el volumen de gas producido. Primero, se calcula el número de moles de H 2:
\[55.8\cancel{g\, Zn}\times \frac{1\cancel{mol\, Zn}}{65.41\cancel{g\, Zn}}\times \dfrac{1\, mol\, H_{2}}{1\cancel{mol\, Zn}}=0.853\, H_{2}\nonumber \]
Ahora que conocemos el número de moles de gas, podemos usar la ley de gas ideal para determinar el volumen, dadas las otras condiciones:
\[(1.07atm)V=(0.853\, mol)\left(0.08205\dfrac{L.atm}{mol.K}\right)(299\, K)\nonumber \]
Todas las unidades cancelan excepto L, para volumen, lo que significa V = 19.6 L
¿Qué presión de\(\ce{HCl}\) se genera si 3.44 g de\(\ce{Cl2}\) reaccionan en 4.55 L a 455 K?
\[\ce{H2(g) + Cl2(g) → 2HCl(g)}\nonumber \]
- Contestar
-
0.796 atm
Ya debería ser obvio que algunas propiedades físicas de los gases dependen fuertemente de las condiciones. Lo que necesitamos es un conjunto de condiciones estándar para que las propiedades de los gases puedan compararse adecuadamente entre sí. La temperatura y presión estándar (STP) se define como exactamente 100 kPa de presión (0.986 atm) y 273 K (0°C). Para simplificar, utilizaremos 1 atm como presión estándar. Definir STP nos permite comparar más directamente las propiedades de los gases que difieren entre sí.
Una propiedad compartida entre los gases es el volumen molar. El volumen molar es el volumen de 1 mol de un gas. En STP, el volumen molar de un gas se puede determinar fácilmente usando la ley de gas ideal:
\[(1\, atm)V=(1\, mol) \left(0.08205\dfrac{L.atm}{mol.K}\right)(273\, K)\nonumber \]
Todas las unidades cancelan excepto L, la unidad de volumen. Entonces V = 22.4 L
Obsérvese que no hemos especificado la identidad del gas; solo hemos especificado que la presión es de 1 atm y la temperatura es de 273 K. Esto hace que sea una aproximación muy útil: cualquier gas en STP tiene un volumen de 22.4 L por mol de gas; es decir, el volumen molar a STP es de 22.4 L/mol (Figura \(\PageIndex{1}\)). Este volumen molar hace un factor de conversión útil en problemas estequiométricos si las condiciones están en STP. Si las condiciones no están en STP, no es aplicable un volumen molar de 22.4 L/mol. Sin embargo, si las condiciones están en STP, se puede usar la ley de gas combinado para calcular cuál sería el volumen del gas si estuviera en STP; entonces se puede usar el volumen molar de 22.4 L/mol.
¿Cuántos moles de\(\ce{Ar}\) están presentes en 38.7 L en STP?
Solución
Podemos usar el volumen molar, 22.4 L/mol, como factor de conversión, pero necesitamos revertir la fracción para que las unidades L cancelen y se introduzcan unidades mol. Se trata de una conversión de un solo paso:
\[38.7\, \cancel{L}\times \frac{1\, mol}{22.4\cancel{L}}=1.73\, mol\nonumber \]
¿Qué volumen tiene 4.87 mol de\(\ce{Kr}\) a STP?
- Contestar
-
109 L
¿Qué volumen de\(\ce{H2}\) se produce en STP cuando 55.8 g de\(\ce{Zn}\) metal reaccionan con exceso\(\ce{HCl}\)?
\[\ce{Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)} \nonumber \]
Solución
Este es un problema estequiométrico con una torsión: necesitamos usar el volumen molar de un gas en STP para determinar la respuesta final. La primera parte del cálculo es la misma que en un ejemplo anterior:
\[55.8\cancel{g\, Zn}\times \frac{1\cancel{mol\, Zn}}{65.41\cancel{g\, Zn}}\times \frac{1\, mol\, H_{2}}{1\cancel{mol\, Zn}}=0.853\, H_{2}\nonumber \]
Ahora podemos usar el volumen molar, 22.4 L/mol, porque el gas está en STP:
\[0.853\cancel{mol\, H_{2}}\times \frac{22.4\, L}{1\cancel{mol\, H_{2}}}=19.1\, L\, H_{2}\nonumber \]
Alternativamente, podríamos haber aplicado el volumen molar como tercer factor de conversión en el cálculo de la estequiometría original.
¿Qué volumen de\(\ce{HCl}\) se genera si 3.44 g de\(\ce{Cl2}\) reaccionan a STP?
\[\ce{H2(g) + Cl2(g) → 2HCl(g)} \nonumber \]
- Contestar
-
2.17 L
La ley de gas ideal también se puede utilizar para determinar la densidad de gases. Densidad, recuerdo, se define como la masa de una sustancia dividida por su volumen:
\[d=\dfrac{m}{V} \label{density}\]
Supongamos que tienes exactamente 1 mol de un gas. Si conoces la identidad del gas, puedes determinar la masa molar de la sustancia. Usando la ley de gas ideal, también puede determinar el volumen de ese mol de gas, usando cualquiera que sean las condiciones de temperatura y presión. Luego puede calcular la densidad del gas usando
\[\text{density}=\dfrac{\text{molar mass}}{\text{molar volume}} \nonumber\]
¿Cuál es la densidad\(\ce{N2}\) a 25°C y 0.955 atm?
Solución
Primero, debemos convertir la temperatura en kelvin:
\[25 + 273 = 298\, \ce{K} \nonumber\]
Si asumimos exactamente 1 mol de\(\ce{N2}\), entonces conocemos su masa: 28.0 g Usando la ley de gas ideal, podemos calcular el volumen:
\[(0.955\, atm)V=(1\, mol)\left(0.08205\frac{L.atm}{mol.K}\right)(298\, K)\nonumber \]
Todas las unidades cancelan a excepción de\(L\), la unidad de volumen. Entonces\(V = 25.6\,\ce{L}\)
Conociendo la masa molar y el volumen molar, podemos determinar la densidad de\(\ce{N2}\) bajo estas condiciones usando la Ecuación\ ref {densidad}:
\[d=\frac{28.0\, g}{25.6\, L}=1.09\, g/L\nonumber \]
¿Cuál es la densidad de\(\ce{CO2}\) a una presión de 0.0079 atm y 227 K? (Estas son las condiciones atmosféricas aproximadas en Marte).
- Contestar
-
0.019 g/L
La respiración (más propiamente llamada respiración) es el proceso por el cual aspiramos aire a nuestros pulmones para que nuestros cuerpos puedan tomar oxígeno del aire. Apliquemos las leyes de gas a la respiración.
Comience por considerar la presión. Aspiramos aire a nuestros pulmones porque el diafragma, un músculo debajo de los pulmones, se mueve hacia abajo para reducir la presión en los pulmones, haciendo que el aire externo se apresure para llenar el volumen de menor presión. Expultimos aire por el diafragma empujando contra los pulmones, aumentando la presión dentro de los pulmones y forzando el aire de alta presión a salir. ¿Cuáles son los cambios de presión involucrados? ¿Un cuarto de ambiente? ¿Una décima de atmósfera? En realidad, en condiciones normales, es solo 1 o 2 torr de diferencia de presión lo que nos hace inhalar y exhalar.
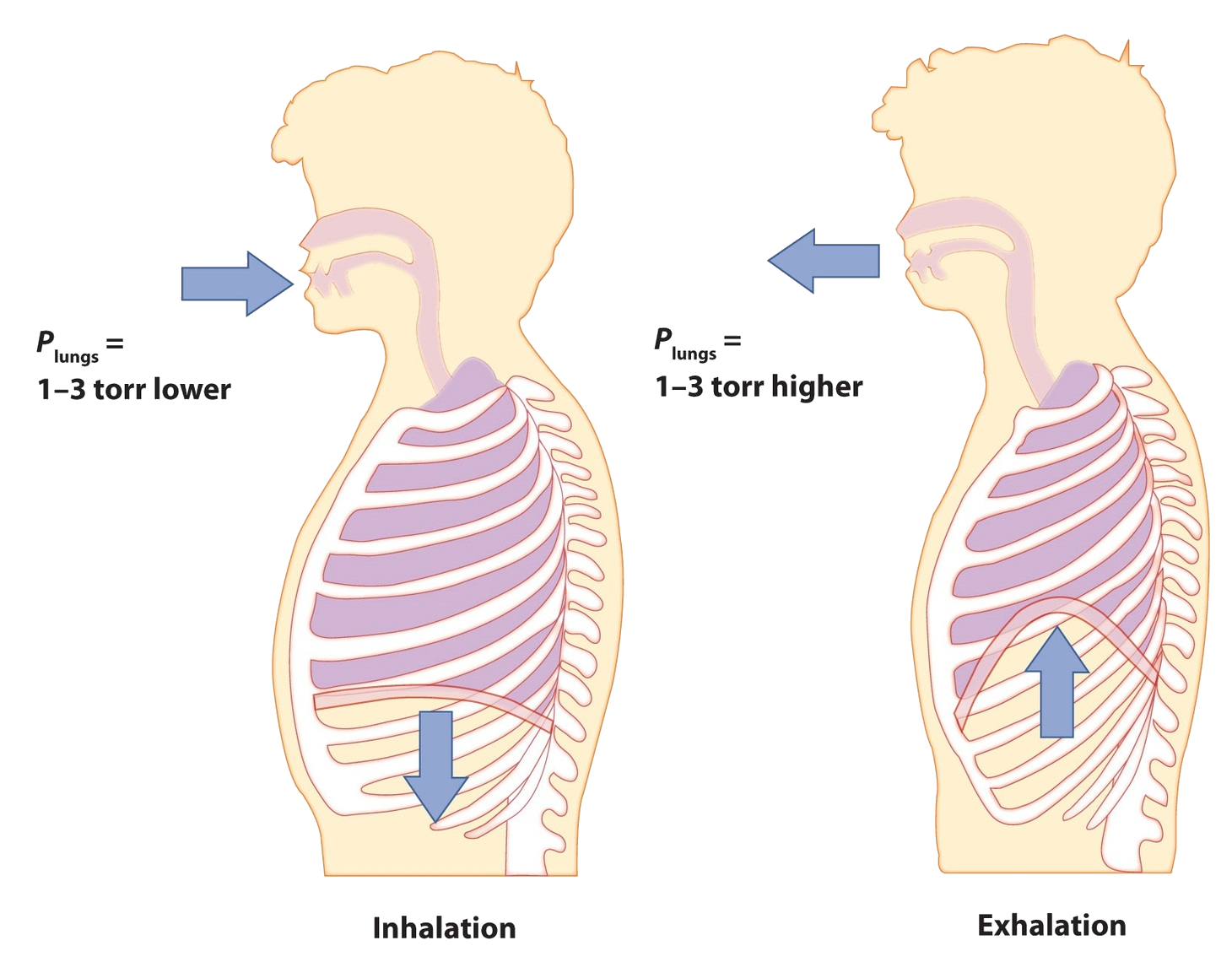
Una respiración normal es de aproximadamente 0.50 L. Si la temperatura ambiente es de aproximadamente 22°C, entonces el aire tiene una temperatura de aproximadamente 295 K. Con una presión normal de 1.0 atm, ¿cuántos moles de aire absorbimos por cada respiración? La ley de gas ideal nos da una respuesta:
\[(1.0\, atm)(0.50\, L)=n \left(0.08205\dfrac{L.atm}{mol.K}\right)(295\, K)\nonumber \]
Resolviendo por el número de lunares, obtenemos
\[n = 0.021\, \ce{mol\, air} \nonumber\]
Esto termina siendo alrededor de 0.6 g de aire por respiración—no mucho, sino suficiente para mantenernos vivos.
Resumen
- La ley de gas ideal relaciona las cuatro propiedades físicas independientes de un gas en cualquier momento.
- La ley de gas ideal puede ser utilizada en problemas estequiométricos con reacciones químicas que involucran gases.
- La temperatura y presión estándar (STP) son un conjunto útil de condiciones de referencia para comparar otras propiedades de los gases.
- En STP, los gases tienen un volumen de 22.4 L por mol.
- La ley de gas ideal se puede utilizar para determinar la densidad de gases.


