5.1: Oxidación de Alcoholes
( \newcommand{\kernel}{\mathrm{null}\,}\)
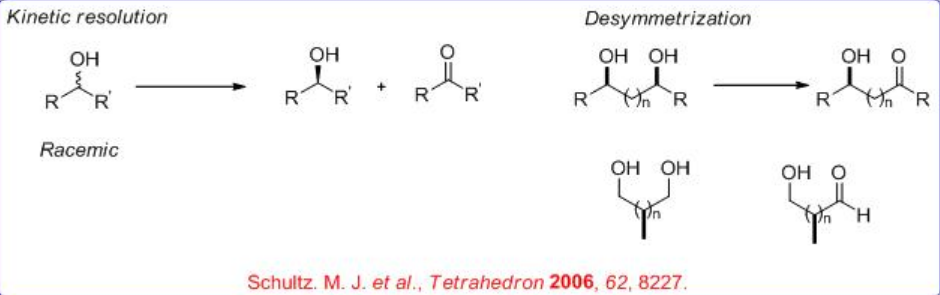
La oxidación de alcoholes a compuestos carbonílicos es un proceso fundamental en la química orgánica. En particular, las oxidaciones que utilizan oxígeno molecular fácilmente disponible, especialmente aire ambiente, como oxidante estequiométrico son las más preferibles. Durante los últimos años, se ha desarrollado una versión asimétrica del proceso mediante catálisis molecular, la cual puede dividirse en resolución cinética de alcoholes secundarios y desimmetrización de dioles meso o proquirales (Esquema5.1.1).
5.1.1 Catalizador de paladio
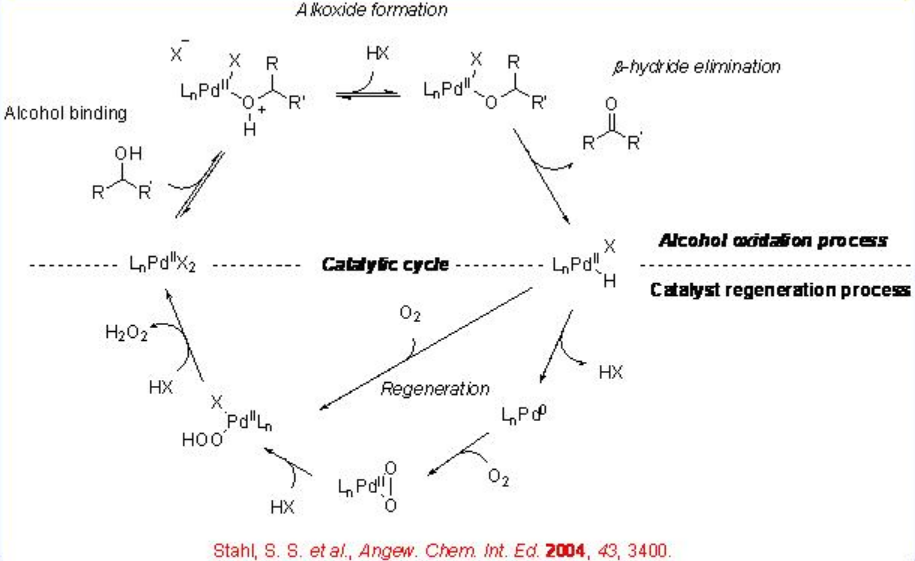
La oxidación aerobia catalizada por paladio de alcoholes a compuestos carbonílicos ha recibido mucha atención en los últimos años y el ciclo catalítico para este proceso se presenta en el Esquema5.1.2. El ciclo consiste en dos procesos separados: la oxidación de alcoholes y la regeneración del catalizador. En la oxidación de los alcoholes se genera alcóxido de paladio después de la coordinación del alcohol, y luego se produce la eliminación de β-hidruro para proporcionar los compuestos carbonílicos. El hidruro de paladio resultante reacciona con oxígeno molecular para generar complejo de paladio hidroperoxo y el posterior intercambio de ligando reproduce el catalizador.
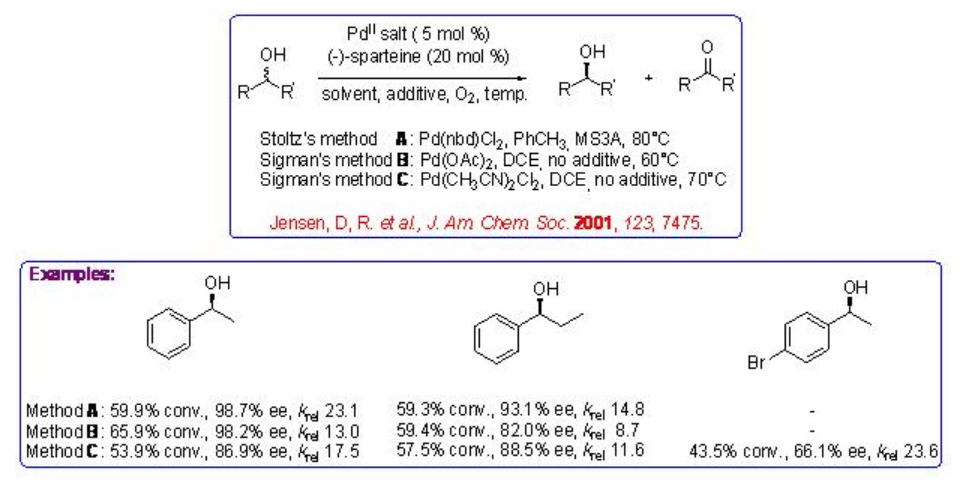
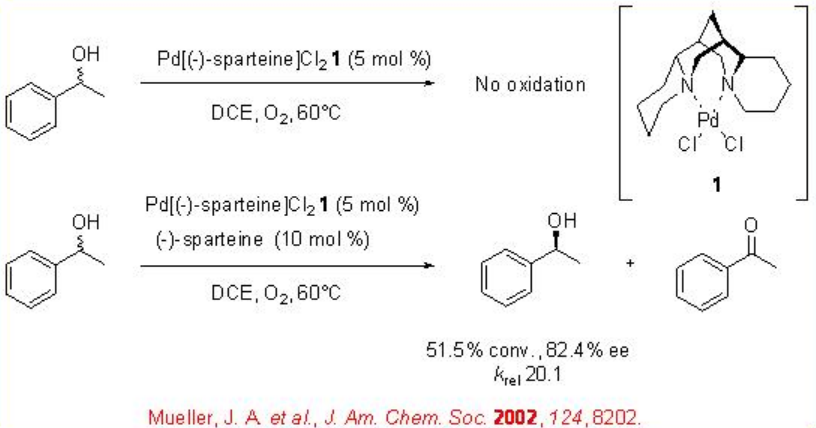
Se han llevado a cabo una serie de experimentos de tres grupos de investigación utilizando complejo de paladio con diamina natural, (-) -esparteína, para catalizar la oxidación de alcoholes alifáticos, bencílicos y alílicos con valores de k rel de moderados a buenos (Esquema5.1.3).
Sin embargo, el complejo aislado de paladio-esparteína no muestra actividad catalítica y la reacción es efectiva empleando (-) -esparteína adicional (Esquema5.1.4). Este resultado sugiere que la (-) -esparteína adicional sirve como base para abstraer un protón a un alcohol unido a paladio en el proceso de formación de alcóxido.
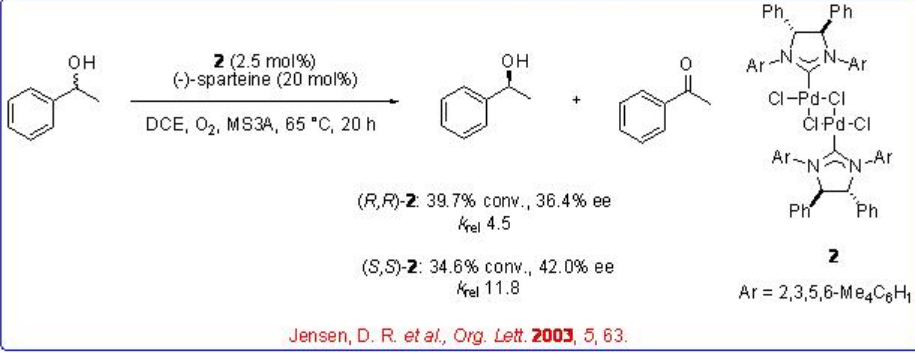
Posteriormente, se ha utilizado la combinación de complejos de paladio que portan lignadas N-heterocíclicas de carbeno quirales y aquirales con (-) -esparteína para la resolución cinética de alcoholes secundarios con alta selectividad (Esquema5.1.5).
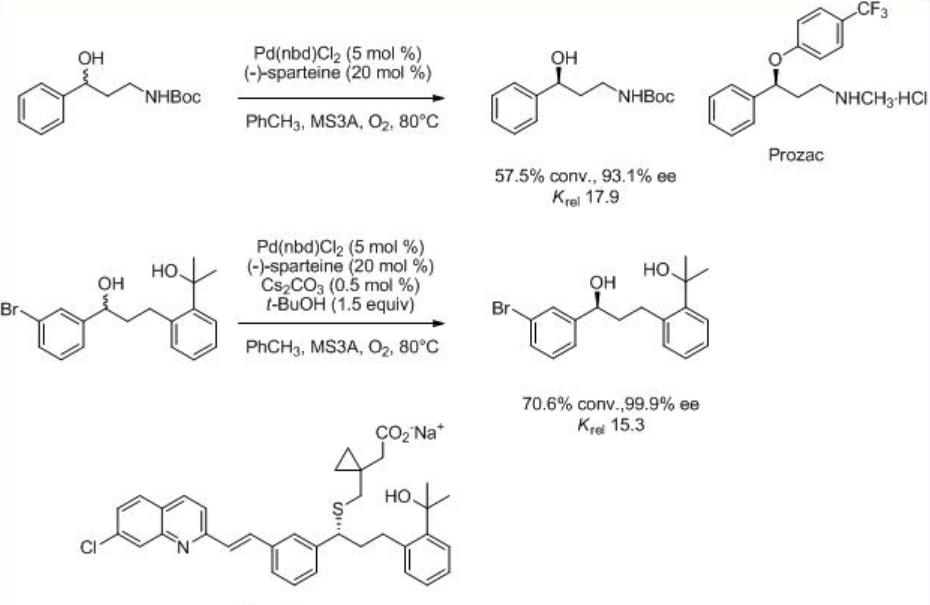
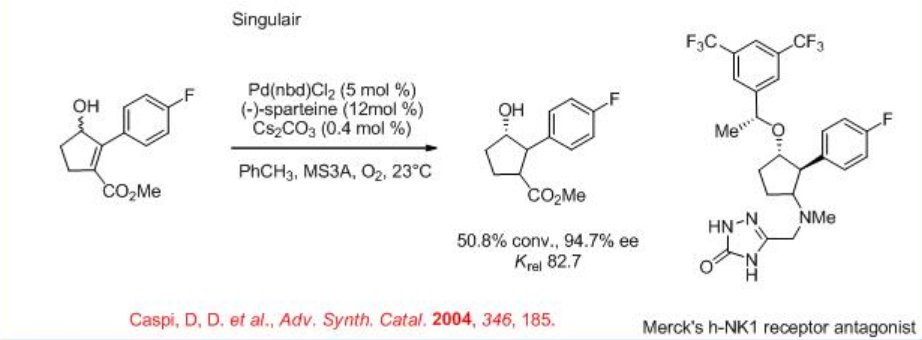
Se encontró que la reacción se aceleró en presencia de Cs 2 CO 3 bajo aire ambiente (Esquema5.1.6). Se encontró que el procedimiento es útil para la síntesis de varias sustancias importantes desde el punto de vista farmacéutico, incluyendo Prozac®, Singlair® y antagonista del receptor h-NK1 de Merck.
5.1.2 Catalizador de rutenio
Se ha encontrado que el complejo quiral Ru-Salen 3 que tiene ligando nitrosil es un catalizador efectivo para la resolución cinética oxidativa de alcoholes secundarios bajo aire ambiente como oxidante bajo luz visible (Esquema5.1.7). La irradiación de la luz visible promueve la disociación del ligando nitrosil y genera una especie de rutenio catalíticamente activa. Se ha observado resolución cinética de alcoholes arílicos, alquinílicos y alquílicos con k rel hasta 30.
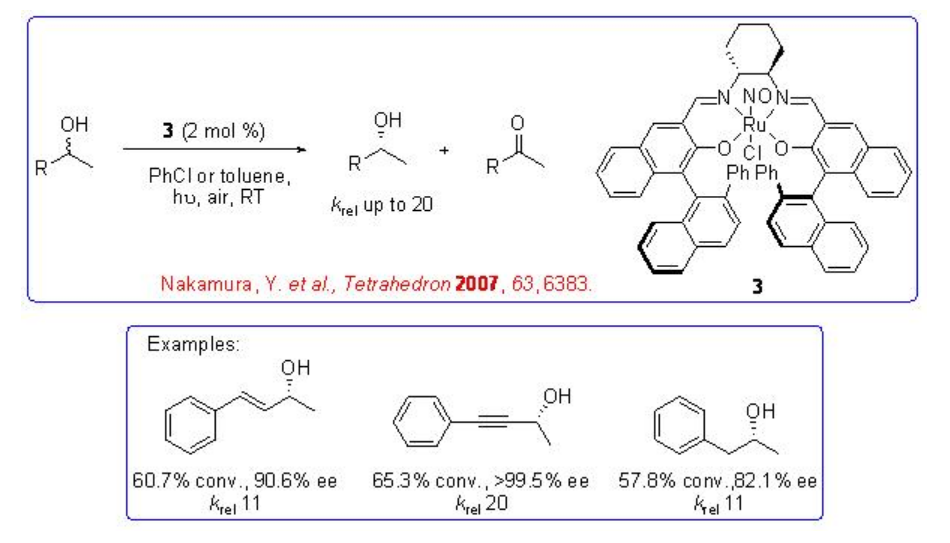
Esquema5.1.7
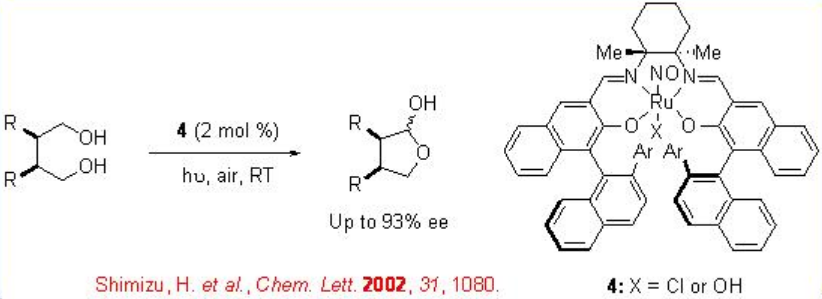
El complejo quiral basado en rutenio 4 también es efectivo para la desimetrización oxidativa de 1,4- meso-dioles (Esquema5.1.8).
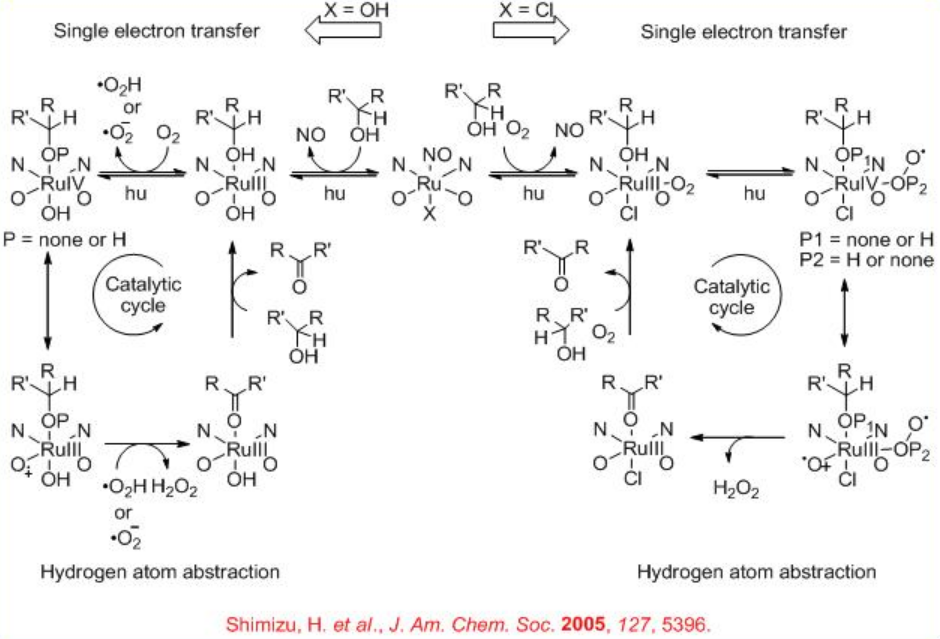
El esquema5.1.9 muestra el mecanismo propuesto para la oxidación aerobia catalizada por RU de alcoholes que es similar al sistema de galactosa oxidasa.
5. 1.3 Catalizador de vanadio
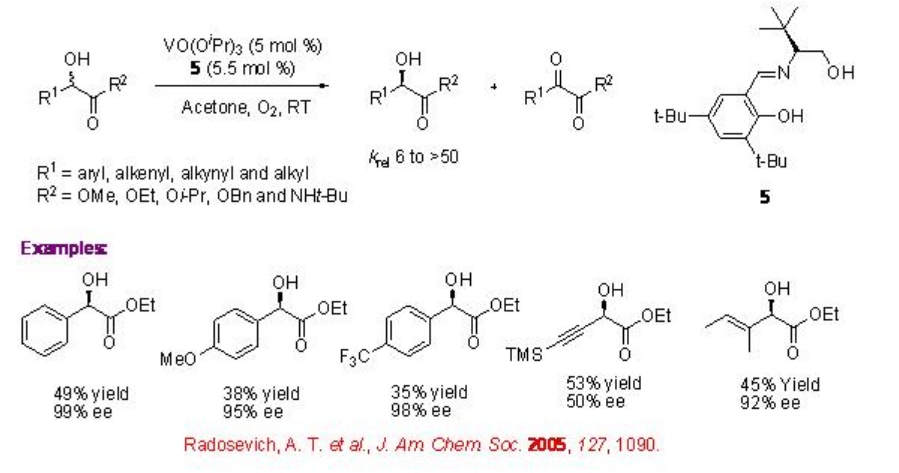
Los complejos de vanadio que tienen ligando 5 de base de Schiff tridentado quiral derivado de aminoalcohol ópticamente activo y derivado de benzaldehído catalizan de manera eficiente la resolución cinética de compuestos α -hidroxicarbonil (Esquema5.1.10). Las reacciones de los α-hidroxiésteres se pueden lograr con k rel que van de 6 a 50. Posteriormente, también se ha encontrado que el ligando de base de Schiff tridentado quiral 6 derivado de α -aminoácidos y aldehídos ópticamente activos es efectivo para la solución cinética aeróbica catalizada por vanadio de compuestos hidroxi (Esquema5.1.11). Por ejemplo, la reacción de ácidos α -hidroxifosfónicos se puede lograr con una excelente selectividad (k rel 99). Los resultados experimentales observados sugieren que estas reacciones de oxidación no implican proceso radical.
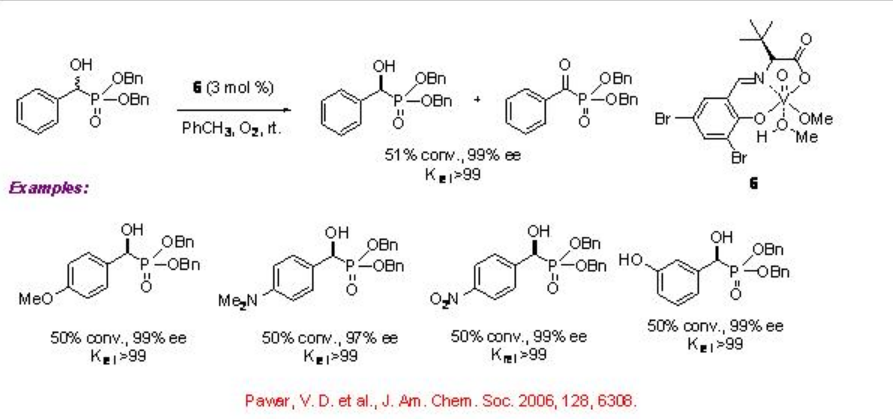
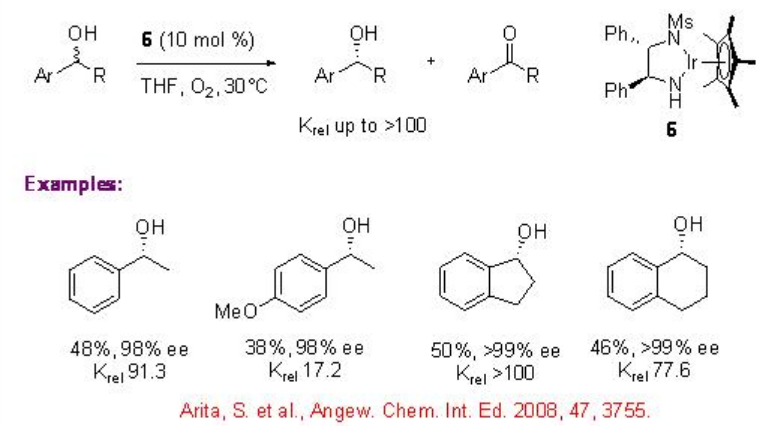
5.1.4 Catalizador de iridio
Pocos estudios se enfocan en el uso de complejos quirales de iridio para la resolución cinética oxidativa de alcoholes secundarios racémicos. Se ha demostrado que el complejo quiral de iridio 6 cataliza la oxidación de alcoholes bencílicos con alto k rel bajo el aire. Usando estas condiciones de reacción, se reporta la oxidación del 1-indanol con enantioselectividad de hasta 99% y rendimiento 50.
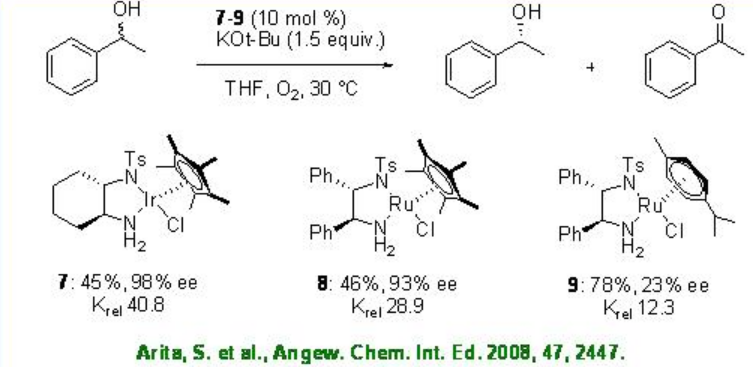
El complejo de cloruro de iridio 7 se ha utilizado para la oxidación de alcoholes secundarios racémicos con k rel tan alto como 48.8 (Esquema5.1.13). El análogo 8 de Rh presenta una alta actividad catalítica en presencia de base, mientras que el complejo 9 de Ru relacionado da resultado disminuido.