3.4: Cicloalcanos
- Page ID
- 76765
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)objetivos de aprendizaje
- nombre cicloalcanos usando IUPAC (sistemático) y nomenclatura de nombre común seleccionada
- dibujar la estructura de los cicloalcanos de la IUPAC (sistemática) y nombres comunes seleccionados
Los cicloalcanos son hidrocarburos cíclicos, lo que significa que los carbonos de la molécula están dispuestos en forma de anillo. Los cicloalcanos también están saturados, lo que significa que todos los átomos de carbono que componen el anillo están unidos de forma simple a otros átomos (sin dobles o triples enlaces). También hay alcanos policíclicos, que son moléculas que contienen dos o más cicloalcanos que se unen, formando múltiples anillos.
Introducción
Muchos compuestos orgánicos encontrados en la naturaleza o creados en un laboratorio contienen anillos de átomos de carbono con propiedades químicas distintivas; estos compuestos se conocen como cicloalcanos. Los cicloalcanos solo contienen enlaces carbono-hidrógeno y enlaces simples carbono-carbono, pero en los cicloalcanos, los átomos de carbono están unidos en un anillo. El cicloalcano más pequeño es el ciclopropano.

Si cuentas los carbonos e hidrógenos, verás que ya no se ajustan a la fórmula general\(C_nH_{2n+2}\). Al unir los átomos de carbono en un anillo, se han perdido dos átomos de hidrógeno. La fórmula general para un cicloalcano es\(C_nH_{2n}\). Los compuestos cíclicos no son todos moléculas planas. Todos los cicloalcanos, desde el ciclopentano hacia arriba, existen como “anillos frunciados”. El ciclohexano, por ejemplo, tiene una estructura de anillo que se ve así:

Además de ser hidrocarburos cíclicos saturados, los cicloalcanos pueden tener múltiples sustituyentes o grupos funcionales que determinan aún más sus propiedades químicas únicas. Los cicloalcanos más comunes y útiles en la química orgánica son el ciclopentano y el ciclohexano, aunque se pueden sintetizar otros cicloalcanos que varían en el número de carbonos. Comprender los cicloalcanos y sus propiedades son cruciales ya que muchos de los procesos biológicos que ocurren en la mayoría de los seres vivos tienen estructuras similares a los cicloalcanos.
 |
 |
|
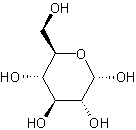
| Glucosa (azúcar de 6 carbonos) | Ribosa (azúcar de 5 carbonos) |
Colesterol (policíclico) |
Aunque los compuestos policíclicos son importantes, son altamente complejos y suelen tener nombres comunes aceptados por la IUPAC. Sin embargo, los nombres comunes generalmente no siguen las reglas básicas de nomenclatura de la IUPAC. La fórmula general de los cicloalcanos es\(C_nH_{2n}\) donde\(n\) está el número de carbonos. La denominación de los cicloalcanos sigue un simple conjunto de reglas que se construyen sobre los mismos pasos básicos para nombrar alcanos. Los hidrocarburos cíclicos tienen el prefijo “ciclo-”.
Contenidos
Por simplicidad, las moléculas de cicloalcano pueden dibujarse en forma de estructuras esqueléticas en las que se supone que cada intersección entre dos líneas tiene un átomo de carbono con su correspondiente número de hidrógenos.
.gif) igual que lo
igual que lo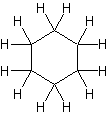 mismo que
mismo que
| Cicloalcano | Fórmula molecular | Estructura básica |
|---|---|---|
| Ciclopropano | C 3 H 6 |  |
| Ciclobutano | C 4 H 8 |  |
| Ciclopentano | C 5 H 10 |  |
| Ciclohexano | C 6 H 12 |  |
| Cicloheptano | C 7 H 14 | 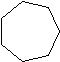 |
| Ciclooctano | C 8 H 16 | 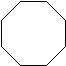 |
| Ciclononano | C 9 H 18 |  |
| Ciclodecano | C 10 H 20 | 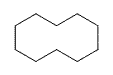 |
Reglas de Nomenclatura de la IUPAC
- Determinar el cicloalcano a usar como cadena parental. La cadena parental es la que tiene el mayor número de átomos de carbono. Si hay dos cicloalcanos, usa el cicloalcano con el mayor número de carbonos como la cadena parental.
- Si hay una cadena lineal alquílica que tiene un mayor número de carbonos que el cicloalcano, entonces la cadena alquílica debe usarse como la cadena parental primaria. El cicloalcano que actúa como sustituyente de una cadena alquílica tiene un extremo “-ilo” y, por lo tanto, debe nombrarse como un cicloalquilo.
| Cicloalcano | Cicloal |
|---|---|
| ciclopropano | ciclopropilo |
| ciclobutano | ciclobutilo |
| ciclopentano | ciclopentilo |
| ciclohexano | ciclohexilo |
| cicloheptano | cicloheptilo |
| ciclooctano | ciclooctilo |
| ciclononano | ciclononanilo |
| ciclodecano | ciclodecanilo |
Ejemplo\(\PageIndex{1}\):
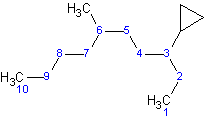
La cadena lineal más larga contiene 10 carbonos, en comparación con el ciclopropano, que solo contiene 3 carbonos. Debido a que el ciclopropano es un sustituyente, se llamaría alcano sustituido con ciclopropil-sustituido.
3) Determinar cualquier grupo funcional u otros grupos alquilo.
4) Numerar los carbonos del cicloalcano para que los carbonos con grupos funcionales o grupos alquilo tengan el menor número posible. Un carbono con múltiples sustituyentes debe tener un número menor que un carbono con solo un sustituyente o grupo funcional. Una forma de asegurarse de que se asigne el número más bajo posible es numerar los carbonos para que cuando se agreguen los números correspondientes a los sustituyentes, su suma sea la más baja posible.
.gif) (1+3=4) NO
(1+3=4) NO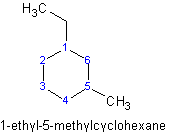.gif) (1+5=6)
(1+5=6)
5) Al nombrar el cicloalcano, los sustituyentes y grupos funcionales deben colocarse en orden alfabético.
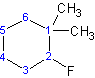
(por ejemplo: 2-b romo-1- c hloro-3-m etilciclopentano)
6) Indicar el número de carbono con el grupo funcional de mayor prioridad según orden alfabético. Se debe colocar un guión” -” entre los números y el nombre del sustituyente. Después del número de carbonos y el guión, puede seguir el nombre del sustituyente. Cuando solo hay un sustituyente en la cadena parental, no es necesario indicar el número de átomos de carbono con el sustituyente.
(ej.: 1-clorociclohexano o colorociclohexano es aceptable)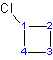
7) Si hay más de uno del mismo grupo funcional en un carbono, escriba el número del carbono dos, tres o cuatro veces, dependiendo de cuántos del mismo grupo funcional esté presente en ese carbono. Los números deben estar separados por comas, y el nombre del grupo funcional que sigue debe estar separado por un guión. Cuando hay dos del mismo grupo funcional, el nombre debe tener el prefijo “di”. Cuando hay tres del mismo grupo funcional, el nombre debe tener el prefijo “tri”. Cuando hay cuatro del mismo grupo funcional, el nombre debe tener el prefijo “tetra”. Sin embargo, estos prefijos no pueden ser utilizados a la hora de determinar las prioridades alfabéticas.
Siempre debe haber comas entre los números y los guiones que están entre los números y los nombres.
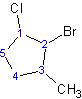
Ejemplo\(\PageIndex{2}\)
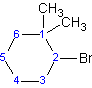
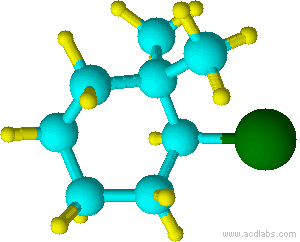
(2-b romo-1, 1-di m etilciclohexano)
Observe que “f” de fluoro precede alfabéticamente a la “m” de metilo. Si bien “di” precede alfabéticamente a “f”, no se utiliza para determinar el orden alfabético.
| Ejemplo 3 |
|---|
|
(2-f luoro-1,1, -di m etilciclohexano NO 1,1-dimetil-2-fluorociclohexano) |
8) Si los sustituyentes del cicloalcano están relacionados por la configuración cis o trans, entonces indique la configuración colocando “cis-” o “trans-” frente al nombre de la estructura.
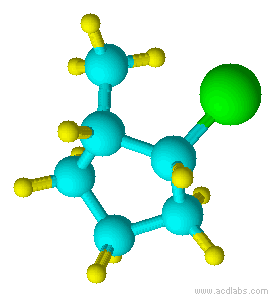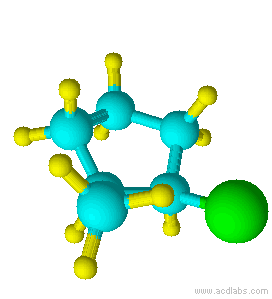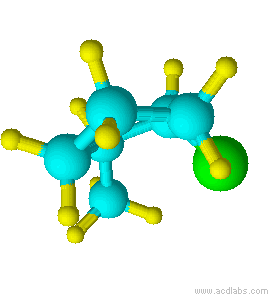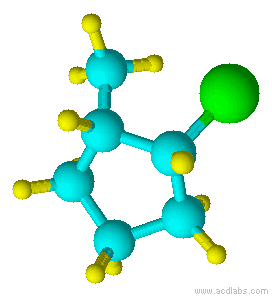
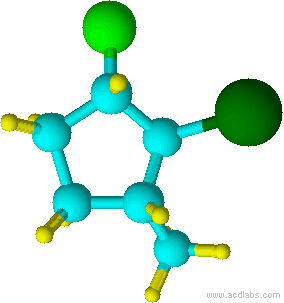
Azul =Amarillo Carbono =Verde Hidrógeno =Cloro
Observe que el cloro y el grupo metilo están ambos apuntando en la misma dirección sobre el eje de la molécula; por lo tanto, son cis.
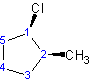 cis-1-cloro-2-metilciclopentano
cis-1-cloro-2-metilciclopentano
9) Después de que todos los grupos funcionales y sustituyentes hayan sido mencionados con sus números correspondientes, puede seguir el nombre del cicloalcano.
Resumen
- Determinar la cadena parental: la cadena parental contiene la mayor cantidad de átomos de carbono.
- Numerar los sustituyentes de la cadena para que la suma de los números sea la más baja posible.
- Nombrar los sustituyentes y colocarlos en orden alfabético.
- Si se muestra la estereoquímica del compuesto, indicar la orientación como parte de la nomenclatura.
- “Los hidrocarburos cíclicos tienen el prefijo “" ciclo- "” y tienen una terminación “" -alcano "” a menos que haya un sustituyente alcohol presente.” Cuando está presente un sustituyente alcohol, la molécula tiene un final “-ol”.
Glosario
- alquilo: Una estructura que se forma cuando se elimina un átomo de hidrógeno de un alcano.
- cíclico: Compuestos químicos dispuestos en forma de anillo o cadena cerrada.
- cicloalcanos: Hidrocarburos cíclicos saturados con una fórmula general de CnH (2n). Los cicloalcanos son alcanos con átomos de carbono unidos en forma de anillo cerrado.
- grupos funcionales: Un átomo o grupos de átomos que sustituyen a un átomo de hidrógeno en un compuesto orgánico, dando al compuesto propiedades químicas únicas y determinando su reactividad.
- hidrocarburo: Un compuesto químico que contiene solo átomos de carbono e hidrógeno.
- saturado: Todos los átomos que componen un compuesto están unidos de manera simple a los demás átomos, sin dobles o triples enlaces.
- estructura esquelética: Estructura simplificada en la que se supone que cada intersección entre dos líneas tiene un átomo de carbono con su correspondiente número de hidrógenos.
Ejercicios
1. Nombra las siguientes estructuras. (Nota: Las estructuras son complejas para fines prácticos y pueden no encontrarse en la naturaleza.)
a) b)
b) c)
c)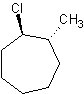 d)
d)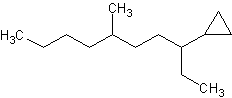 e)
e)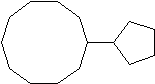 f)
f)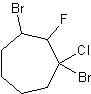
g)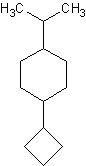
2. Dibuja las siguientes estructuras.
a) 1,1-dibromo-5-fluoro-3-butil-7-metilciclooctano
b) trans-1-bromo-2-clorociclopentano
c) 1,1-dibromo-2,3-dicloro-4-propilciclobutano
d) 2-metil-1-etil-1,3-dipropilciclopentano
e) cicloheptano-1,3,5-triol
3. Nombra las siguientes estructuras.
Azul =Amarillo Carbono =Rojo Hidrógeno =Verde Oxígeno =Cloro
a).gif) b)
b)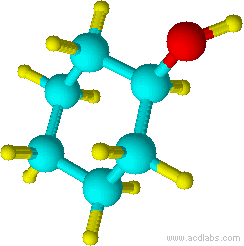 c)
c)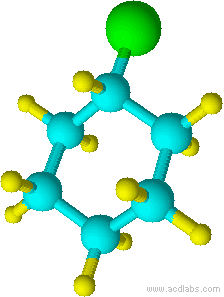 d)
d)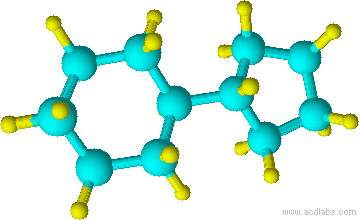 e)
e)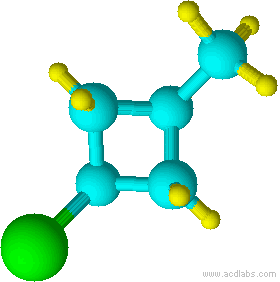
f)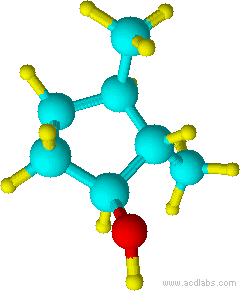 g)
g)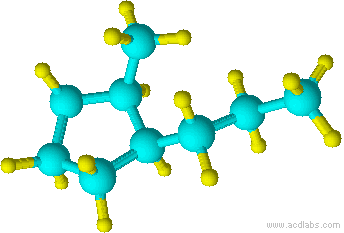
Soluciones
1. a) ciclodecano
b) clorociclopentano o 1-clorociclopentano
c) trans-1-cloro-2-metilcicloheptano
d) 3-ciclopropil-6-metildecano
e) ciclopentilciclodecano o 1-ciclopentilciclodecano
f) 1,3-dibromo-1-cloro-2-fluorocicloheptano
g) 1-ciclobutil-4-isopropilciclohexano
2.
a)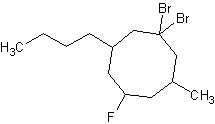 b)
b)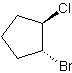 c)
c)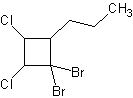 d)
d)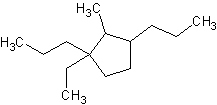 e)
e)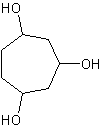
3. a) ciclohexano
b) ciclohexanol
c) clorociclohexano
d) ciclopentilciclohexano
e) 1-cloro-3-metilciclobutano
f) 2,3-dimetilciclohexanol
g) cis-1-propil-2-metilciclopentano
Referencias
- ACD/ChemSketch Freeware, versión 11.0, Advanced Chemistry Development, Inc., Toronto, ON, Canadá, www.acdlabs.com, 2008.
- Bruice, Paula Yurkanis. Química Orágnica. 5to. CA. Prentice Hall, 2006.
- Fryhle, C.B. y G. Salomón. Química Orgánica. 9ª ed. Danvers, MA: Wiley, 2008.
- McMurry, John. Química Orgánica. 7ª ed. Belmont, California: Thomson Higher Education, 2008.
- Sadava, Heller, Orianos, Purves, Hillis. La vida La ciencia de la biología. 8a ed. Sunderland, MA: W.H. Freeman, 2008.
- Vollhardt, K. Peter C., y Neil E. Schore. Química Orgánica. 5ta ed. Nueva York: W.H. Freeman, 2007.
Colaboradores y Atribuciones
- Pwint Zin
- Jim Clark (ChemGuide)