10.1: Estructura y Propiedades Físicas
- Page ID
- 76010
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivo de aprendizaje
- aplicar teorías de unión a la estructura de alquinos y distinguir entre triples enlaces internos y terminales
Alquinos: Terminal vs Interno
Los alquinos son moléculas orgánicas con enlaces triples carbono-carbono. Son hidrocarburos insaturados con la fórmula empírica de CnH 2n-2. El alquino más simple es el etino que tiene el nombre común acetileno. El acetileno es un nombre común para memorizar.
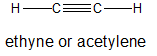
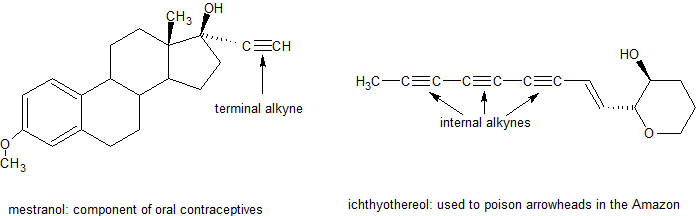
Es importante distinguir entre alquinos terminales e internos porque pueden experimentar diferentes patrones de reactividad.
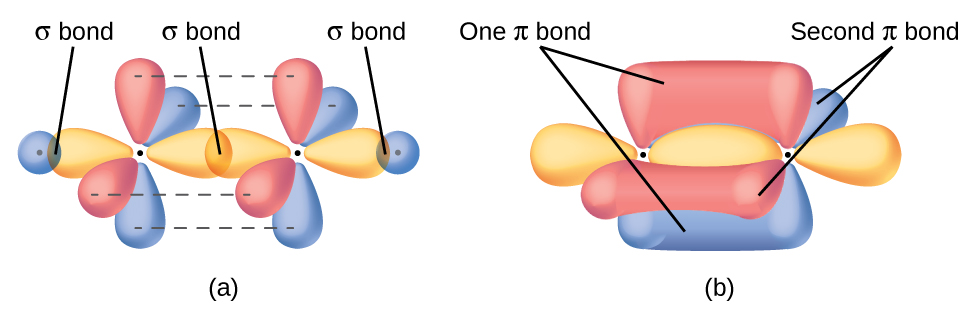
Estructura Electrónica
La hibridación sp del triple enlace carbono-carbono da como resultado la orientación perpendicular del enlace sigma y dos enlaces pi. La proximidad de los electrones en esta orientación geométrica crea moléculas con menos estabilidad. La estructura del triple enlace carbono-carbono influye fuertemente en la reactividad química de los alquinos y la acidez de los alquinos terminales. Debido a su configuración lineal (el ángulo de unión de un carbono hibridado sp es de 180º), un anillo de carbono de diez eslabones es el más pequeño que puede acomodar esta función sin deformación excesiva.
Propiedades Físicas
Los alquinos son hidrocarburos insaturados no polares con propiedades físicas similares a los alcanos y alquenos. Los alquinos se disuelven en disolventes orgánicos, tienen una ligera solubilidad en disolventes polares y son insolubles en agua. En comparación con los alcanos y alquenos, los alquinos tienen puntos de ebullición ligeramente más altos. Por ejemplo, el etano tiene un punto de ebullición de -88.6 C, mientras que e thene es -103.7 C y e thyne tiene un punto de ebullición más alto de -84.0? C.
Ejercicio
- Organizar etano, eteno y acetileno en orden decreciente de longitud carbono-carbono.
- ¿Cuántos enlaces pi y sigma están involucrados en la estructura del etino?
- ¿Qué contribuye a la debilidad de los enlaces pi en un alquino?
- Organizar los siguientes hidrocarburos en orden decreciente del punto de ebullición: 1-heptino, 1-hexino, 2-metil-1-hexino.
- Predecir el disolvente con mayor solubilidad en 2-butino. a) agua o 1-octanol? b) ¿agua o acetona? c) etanol o hexano?
- Contestar
-
1. longitud relativa del enlace carbono-carbono: etano < eteno < acetileno
2. Hay tres enlaces sigma y dos enlaces pi.
3. El enlace sigma y dos enlaces pi son todos perpendiculares entre sí en el triple enlace creando repulsión de electrones entre los tres pares de electrones de unión en el triple enlace.
4. 1-heptino (99.7C) > 2-metil-1-hexino (91C) > 1-hexino (71C)
5. a) 1-octanol b) acetona c) hexano
Enlaces externos
- www.ucc.ie/academic/chem/dolc... t/alkynes.html
- www.CliffsNotes.com/wileycda/... eId-22631.html
Referencias
- Bloch, D.R. Química orgánica desmitificada, Nueva York: McGraw-Hill, 2006.
- Vollhardt. Schore, Química Orgánica Estructura y Función Quinta Edición, Nueva York: W.H. Freeman and Company, 2007.
Colaboradores y Atribuciones
- Bao Kha Nguyen, Garrett M. Chin

