1.4.1: Introducción a Aminoácidos y Proteínas
- Page ID
- 72388
Las proteínas son polímeros de aminoácidos, unidos por grupos amida conocidos como enlaces peptídicos. Se puede pensar que un aminoácido tiene dos componentes: una 'cadena principal', o 'cadena principal', compuesta por un grupo amonio, un 'alfa-carbono' y un carboxilato, y una 'cadena lateral' variable (en verde abajo ) unido al carbono alfa.
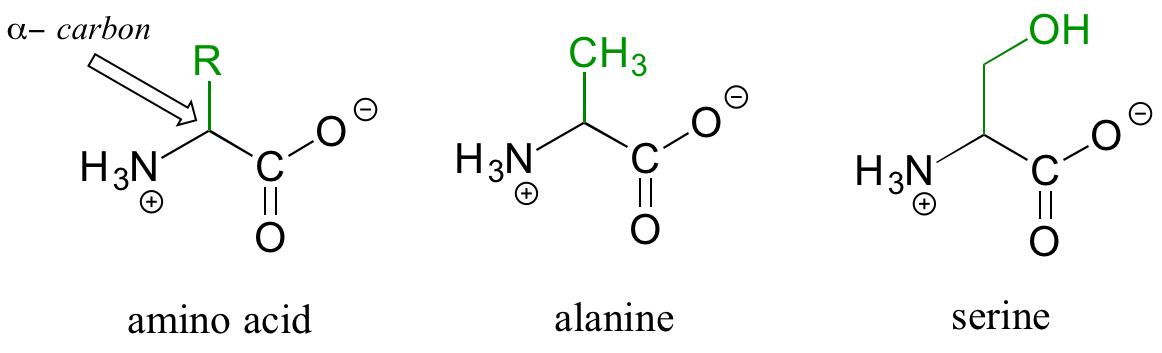
Hay veinte cadenas laterales diferentes en los aminoácidos naturales, y es la identidad de la cadena lateral la que determina la identidad del aminoácido: por ejemplo, si la cadena lateral es un grupo -CH 3, el aminoácido es alanina, y si la cadena lateral es un grupo -CH 2 OH, el aminoácido es serina. Muchas cadenas laterales de aminoácidos contienen un grupo funcional (la cadena lateral de la serina, por ejemplo, contiene un alcohol primario), mientras que otras, como la alanina, carecen de un grupo funcional, y contienen solo un alcano simple.
Los dos 'ganchos' en un monómero de aminoácido son los grupos amina y carboxilato. Las proteínas (polímeros de ~50 aminoácidos o más) y los péptidos (polímeros más cortos) se forman cuando el grupo amino de un monómero de aminoácido reacciona con el carbono carboxilato de otro aminoácido para formar un enlace amida, que en terminología proteica es un enlace peptídico. Qué aminoácidos están unidos, y en qué orden -la secuencia proteica- es lo que distingue a una proteína de otra, y está codificada por el ADN de un organismo. Las secuencias de proteínas se escriben en la dirección amino terminal (N-terminal) a carboxilato terminal (C-terminal), con abreviaturas de tres letras o de una sola letra para los aminoácidos (ver tabla de aminoácidos). A continuación se muestra un péptido de cuatro aminoácidos con la secuencia “cisteína - histidina - glutamato - metionina”. Usando el código de una sola letra, la secuencia se abrevia CHEM.

Cuando un aminoácido se incorpora a una proteína pierde una molécula de agua y lo que queda se denomina residuo del aminoácido original. Por lo tanto, podríamos referirnos al 'residuo de glutamato' en la posición 3 del péptido CHEM anterior.
Una vez que se construye un polímero proteico, en muchos casos se pliega muy específicamente en una estructura tridimensional, que a menudo incluye uno o más 'bolsillos de unión' en los que se pueden unir otras moléculas. Es esta forma de esta estructura plegada, y la disposición precisa de los grupos funcionales dentro de la estructura (especialmente en el área del bolsillo de unión) lo que determina la función de la proteína.
Las enzimas son proteínas que catalizan reacciones bioquímicas. Una o más moléculas reaccionantes, a menudo llamadas sustratos, se unen en el bolsillo del sitio activo de una enzima, donde tiene lugar la reacción real. Los receptores son proteínas que se unen específicamente a una o más moléculas -denominadas ligandos - para iniciar un proceso bioquímico. Por ejemplo, vimos en la introducción de este capítulo que el receptor TrpVI en tejidos de mamíferos se une a la capsaicina (de los chiles picantes) en su bolsillo de unión e inicia una señal de calor/dolor que se envía al cerebro.
A continuación se muestra una imagen de la enzima glucolítica fructosa-1,6-bisfosfato aldolasa (en gris), con la molécula sustrato unida dentro del bolsillo del sitio activo.
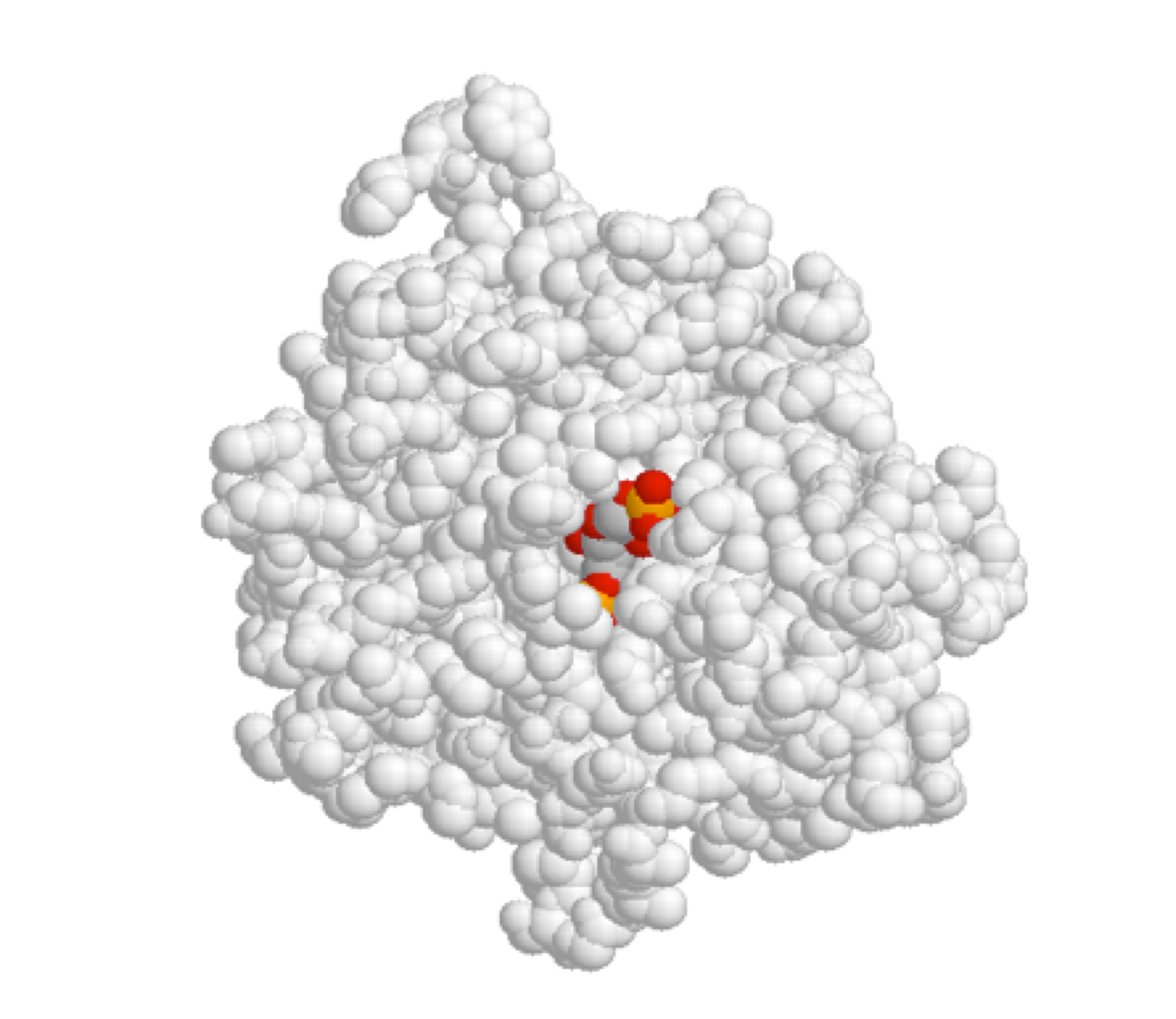
(Los datos cristalográficos de rayos X son de Protein Science 1999, 8, 291; pdb code 4ALD. Imagen producida con JMol First Glance)
Introducción a los ácidos nucleicos ⇒


