12.2: Revisión de Acidez en el α-Carbono
- Page ID
- 72803
Revisemos lo que aprendimos en la sección 7.6 sobre la acidez de un protón sobre un carbono a y la estructura de la base conjugada relevante, el ion enolato. Recuerde que esta acidez puede explicarse por el hecho de que la carga negativa sobre la base conjugada enolato se deslocaliza por resonancia tanto al\(\alpha\) -carbono como al oxígeno carbonilo.
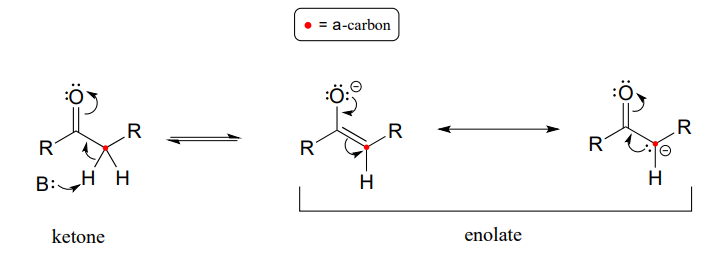
El\(\alpha\) -carbono en el enolato se\(sp^2\) hibrida con geometría plana trigonal, al igual que los átomos de carbono carbonilo y oxígeno (ahora sería un buen momento para volver a la sección 2.1, sección 2.2, y sección 2.3 para revisar, si es necesario, la geometría del enlace p en sistemas conjugados). \(pK_a\)de un protón a típico en solución acuosa es aproximadamente 18-20: ácido, pero solo débilmente así. Recordemos de la sección 7.8, sin embargo, que la efectividad\(pK_a\) de un grupo funcional en una molécula unida a enzima puede ser alterada dramáticamente por el 'microambiente' del sitio activo. Para disminuir el\(pK_a\) de un\(\alpha\) -protón, una enzima que cataliza una reacción que comienza con una etapa de abstracción de protones a debe estabilizar aún más la carga negativa que se desarrolla en el átomo de oxígeno de la base conjugada (enolato). Diferentes enzimas han desarrollado diferentes estrategias para llevar a cabo esta tarea: en algunos casos, un catión metálico (a menudo\(Zn^{+2}\)) se une en el sitio activo para proporcionar una interacción ión-ion estabilizante. En otros casos, la estabilización es proporcionada por un grupo donador de protones posicionado cerca del oxígeno. Como tercera posibilidad, la arquitectura del sitio activo a veces proporciona uno o más grupos donantes de enlaces de hidrógeno estabilizantes.
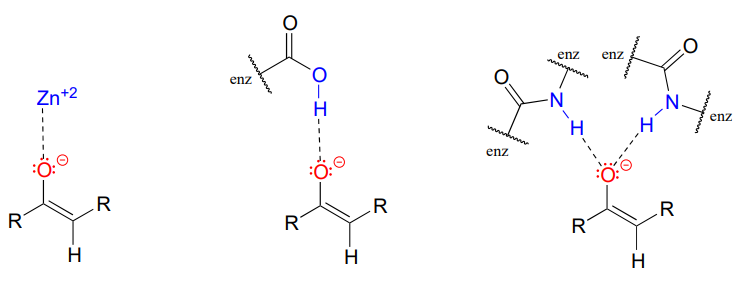
En la mayoría de las ilustraciones de mecanismo de este capítulo donde se representa un intermedio enolato, no se dibujarán explícitamente interacciones estabilizadoras de iones metálicos o enlaces de hidrógeno, en aras de la claridad. Sin embargo, siempre que veas un enolato intermedio en una reacción catalizada por enzimas, debes recordar que hay interacciones estabilizantes en juego dentro del sitio activo.


