12.3: Isomerización en el α-carbono
- Page ID
- 72816
Los iones enolato, así como los enoles y enaminas (sección 7.6) son los intermedios reactivos clave en muchas reacciones de isomerización bioquímica. Las isomerizaciones pueden implicar la interconversión de isómeros constitucionales, en los que se altera la conectividad de los enlaces, o bien de estereoisómeros, donde se cambia la configuración estereoquímica. Las enzimas que interconvierten los isómeros constitucionales generalmente se denominan isomerasas, mientras que las que interconvierten la configuración de un carbono quiral suelen denominarse racemasas o epimerasas.
Isomerización de carbonilo
Una familia muy importante de enzimas isomerasas cataliza el desplazamiento de un grupo carbonilo en las moléculas de azúcar, a menudo convirtiéndose entre una cetosa y una aldosa (recordemos que los términos cetosa y aldolsa se refieren a moléculas de azúcar que contienen grupos cetona y aldehído, respectivamente).
Isomerización de carbonilo:
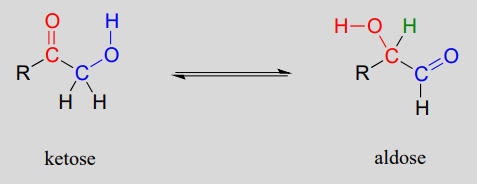
Mecanismo:
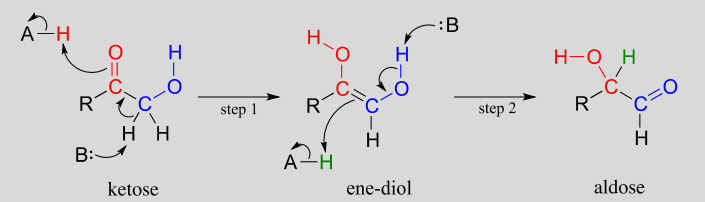
La especie de cetosa se convierte primero en su tautomero enol en la etapa 1 (en realidad, este intermedio en particular se conoce como un 'eno-diol' en lugar de un enol, porque hay grupos hidroxilo en ambos lados del doble enlace carbono-carbono). El paso 2 lleva a la aldosa, y es simplemente otro paso de tautomerización. Sin embargo, debido a que hay un grupo hidroxilo en el carbono adyacente (azul), se puede formar un carbonilo allí, así como en el carbono rojo.
Un ejemplo es la reacción de la vía de glucólisis catalizada por la enzima triosa fosfato isomerasa (EC 5.3.1.1). Aquí, el fosfato de dihidroxiacetona (DHAP) se convierte reversiblemente en fosfato de gliceraldehído (GAP).
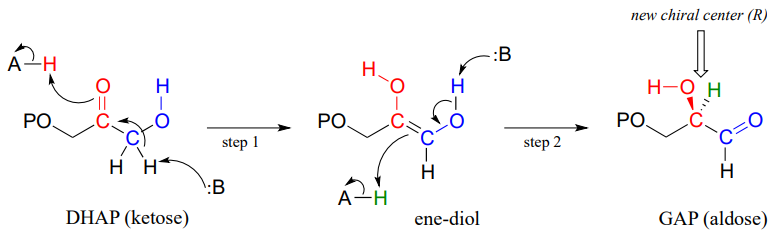
Observe que el DHAP es aquiral mientras que el GAP es quiral, y que se introduce un nuevo centro quiral en el carbono medio (rojo) del GAP. Como es de esperar, la enzima es estereoselectiva: en el paso 2 se entrega un protón al carbono rojo, desde detrás del plano de la página, para producir el enantiómero R.
También en la vía de la glucólisis, glucosa-6-fosfato (una aldosa) y fructosa-6-fosfato (una cetosa) son interconvertidos a través de un intermedio eno-diol (EC 5.3.1.9) por una enzima que está estrechamente relacionada con la triosa-fosfato isomerasa.
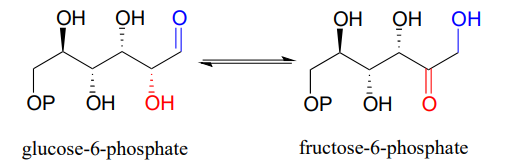
D crudo el intermedio eno-diol en la reacción de fosfoglucosa isomerasa.
Estereoisomerización en el\(\alpha\)-carbon
Enolates are a common intermediate in reactions where the stereochemical configuration of a chiral \(\alpha\)-carbon is interconverted. These are commonly referred to as racemization or epimerization reactions, depending on whether the interconverted isomers are enantiomers or epimers (recall that the term 'epimer' refers to a pair of diastereomers that differ by a single chiral center).
Racemization/ epimerization:
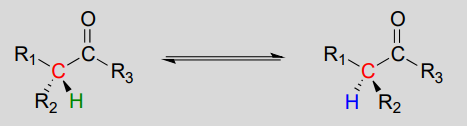
Mechanism:
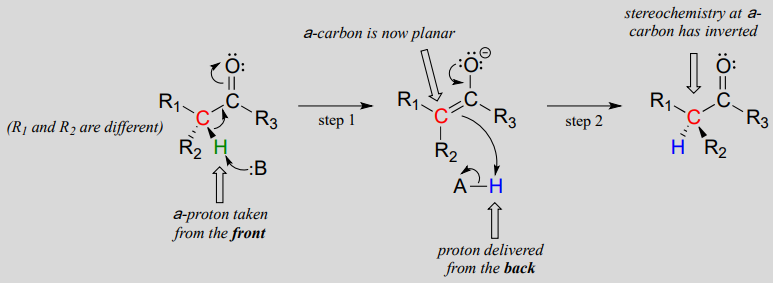
These reactions proceed though a deprotonation-reprotonation mechanism, illustrated above. In step 1, the chiral a-carbon is deprotonated, leading to a planar, achiral enolate. In step 2, a proton is delivered back to the a-carbon, but from the opposite side from which the proton was taken in step 1, resulting in the opposite stereochemistry at this carbon. Two acid-base groups, positioned at opposing sides of the enzyme's active site, work in tandem to accomplish this feat.
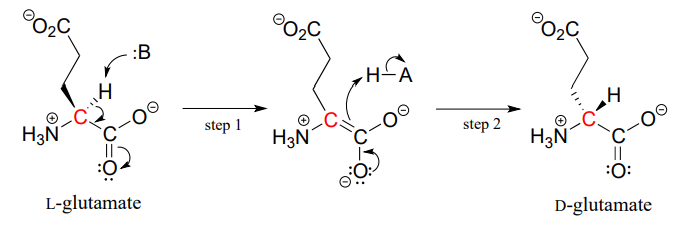
The proteins and peptides in all known living things are constructed almost exclusively of L-amino acids, but in rare cases scientists have identified peptides which incorporate D-amino acids, which have the opposite stereochemistry at the a-carbon. Amino acid racemase enzymes catalyze the interconversion of L and D amino acids. As you may recall from the introductory section to this chapter, the venom of the male platypus contains a neurotoxic peptide in which an L-leucine amino acid has been converted by a racemase enzyme to D-leucine. In another example, the cell walls of bacteria are constructed in part of peptides containing D-glutamate, converted from L-glutamate by the enzyme glutamate racemase. (EC 5.1.1.3) (Biochemistry 2001, 40, 6199).
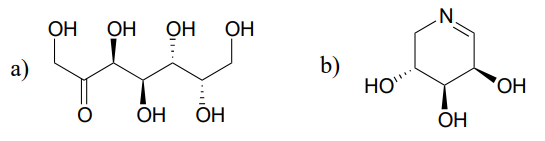
Una reacción (EC 5.1.3.1) en el metabolismo del azúcar implica la interconversión de los epímeros ribulosa-5-fosfato y xilulosa-5-fosfato. La enzima que cataliza esta reacción se llama 'epimerase'. (J. Mol. Biol. 2003, 326, 127).

Dibujar un mecanismo razonable para la reacción de epimerización de ribulosa-5-fosfato anterior. Su mecanismo debe mostrar un intermedio enolado y especificar la estereoquímica en todo momento.
Predecir los productos de las reacciones de epimerización comenzando con cada uno de los sustratos mostrados.
- Pista
-
Los carbonos próximos a los grupos imina también pueden considerarse\(\alpha\) ¡carbonos!
Recordemos del capítulo 3 que un problema importante con el fármaco talidomida es el hecho de que el enantiómero R, que es un sedante efectivo, isomeriza rápidamente en el cuerpo al enantiómero S terotogénico (causante de mutaciones). Tenga en cuenta que el centro quiral en la talidomida es un\(\alpha\) -carbono!
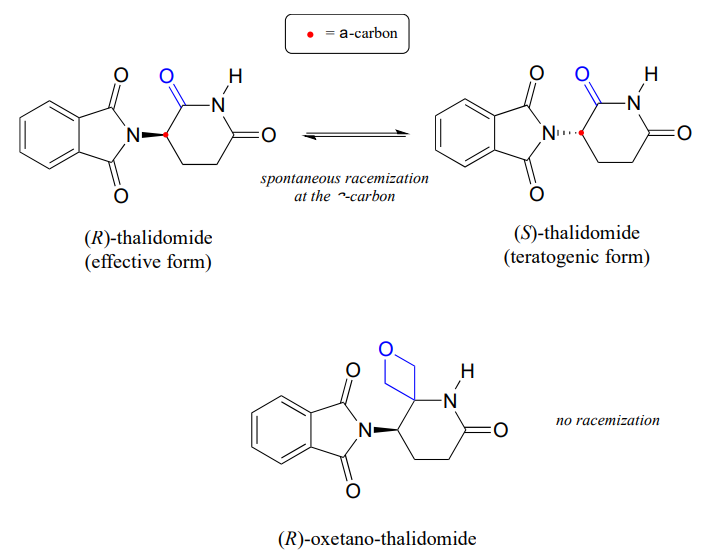
Recientemente los químicos reportaron la síntesis de un derivado de talidomida en el que el grupo carbonilo es reemplazado por un anillo 'oxetano', con el objetivo de hacer una forma isotópicamente estable del fármaco (debido a que se ha eliminado el grupo carbonilo, la racemización ya no es posible - ¡no hay a-carbono!) (Org. Let. 2013, 15, 4312.)
Regioisomerización de alquenos
La posición de un grupo alqueno también se puede cambiar a través de una reacción en la que el primer paso es la abstracción de un\(\alpha\)-proton and formation of an enolate intermediate. degradation pathway for unsaturated fatty acids (fatty acids whose hydrocarbon chains contain one or more double bonds) involves the 'shuffling' of the position of a carbon-carbon double bond, from a cis bond between carbon #3 and carbon #4 to a trans bond between carbon #2 and carbon #3. This is accomplished by the enzyme enoyl \(CoA\) isomerase (EC 5.3.3.8). (J. Biol Chem 2001, 276, 13622).
Alkene isomerization:

Mechanism:
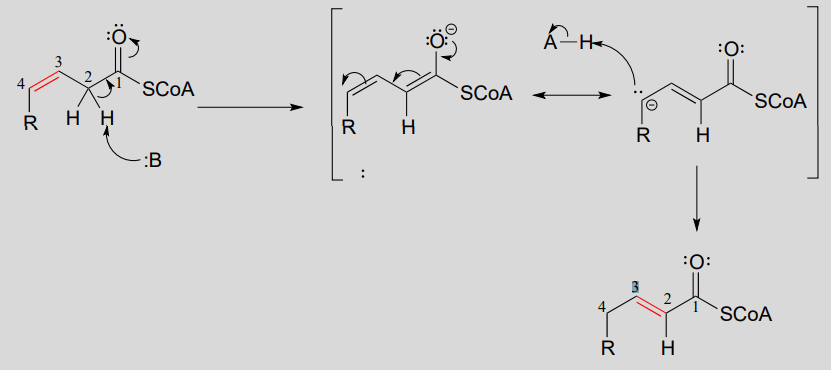
Consider the structures of the substrate and product of the isomerization reaction above. What two factors contribute to the thermodynamic 'driving force' for the transformation?
The reaction below is part of the biosynthetic pathway for menthol. Suggest a mechanism that includes an enolate intermediate.


