14.2: Adición Electrofílica a Alquenos
- Page ID
- 72098
Adición\(HBr\) de alquenos
El tipo más simple de reacción electrófila para visualizar es la adición de un haloácido tal como\(HBr\) a un alqueno aislado. No es una reacción biológica, pero sin embargo puede servir como un modelo conveniente para introducir algunas de las ideas más importantes sobre las reacciones electrofílicas.
Adición electrófila de\(HBr\) a un alqueno:
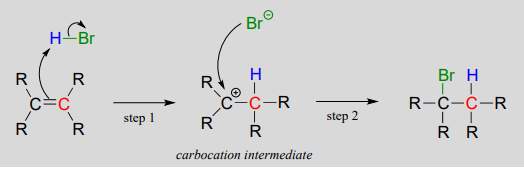
El paso 1 es una reacción ácido-base:\(\pi \) los electrones del alqueno actúan como base y extraen el protón ácido de\(HBr\). Esto deja a uno de los carbonos con un nuevo enlace al hidrógeno, y al otro con un octeto incompleto y una carga formal positiva. En la etapa 2, el anión bromuro nucleófilo ataca el carbocatión electrófilo para formar un nuevo enlace carbono-bromo. En general, la\(HBr\) molécula -en forma de protón y anión bromuro- se ha añadido al doble enlace.
Para entender cómo los electrones\(\pi \) unidos en un alqueno podrían ser básicos, primero revisemos la imagen de unión para alquenos. Recordemos (sección 2.1) que ambos carbonos en un grupo alqueno están\(sp^2\) hibridados, lo que significa que cada carbono tiene tres orbitales\(sp^2\) híbridos que se extienden en el mismo plano en\(180^{\circ}\) ángulos (geometría plana trigonal), y un solo\(p\) orbital no hibridado orientado perpendicular a ese plano - un lóbulo por encima del plano, un lóbulo debajo.
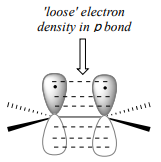
El no hibridado\(p\) orbitals on the two alkene carbons overlap, in a side-by-side fashion, to form the \(pi \) bond, which extends above and below the plane formed by the \(s\) bonds. two electrons shared in this π bond are farther away from the carbon nuclei than the electrons in the carbon-carbon \(s\) bond, and thus are more accessible to the acidic proton. In addition, recall that molecular orbital (MO) theory tells us that \(p\) orbitals are higher in energy than s orbitals (section 2.2). As a consequence, it is easier to break the \(p\) bond of an alkene than it is to break the \(s\) bond: the \(p\) bond is more reactive.
As the \(HBr\) molecule approaches the alkene, a new \(s\) bond is formed between one of the alkene carbons and the electron-poor proton from \(HBr\). The carbon, which was \(sp^2\) hybridized when it was part of the alkene, is now \(sp^3\) hybridized. The other alkene carbon is still \(sp^2\) hybridized, but it now bears a positive formal charge because it has only three bonds, and its \(p\) orbital is empty. But it won't stay empty for long: a carbocation is a very reactive, unstable intermediate. The bromide ion will rapidly act as a nucleophile, filling the orbital with a pair of electrons, and now with four \(s\) bonds the carbon is \(sp^3\)-hybridized.
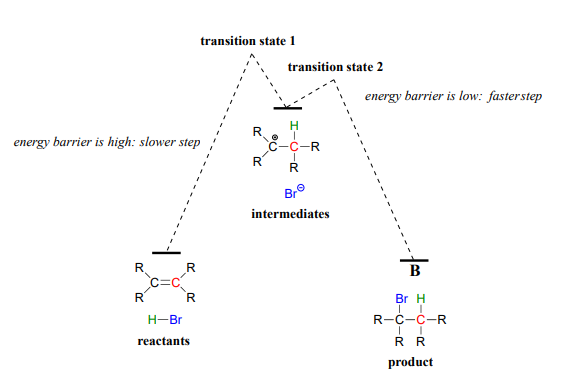
The first step in the electrophilic addition reaction is much slower than the second step, because the intermediate carbocation species is higher in energy than either the reactants or the products, and as a result the energy barrier for the first step is also higher than for the second step. The slower first step is the rate-determining step: a change in the rate of the slow step will effect the rate of the overall reaction, while a change in the rate of the fast step will not.
It is important to recognize the inherent difference between an electrophilic addition to an alkene and a conjugate addition to an alkene in the \(\square \square \square\) position, the latter of which we studied earlier in section 13.4. In both reactions, a proton and a nucleophile add to the double bond of an alkene. In a conjugate addition, the nucleophilic attack takes place first, resulting in a negatively charged intermediate (an enolate). Protonation is the second step. Also, of course, the alkene must be conjugated to a carbonyl or imine.
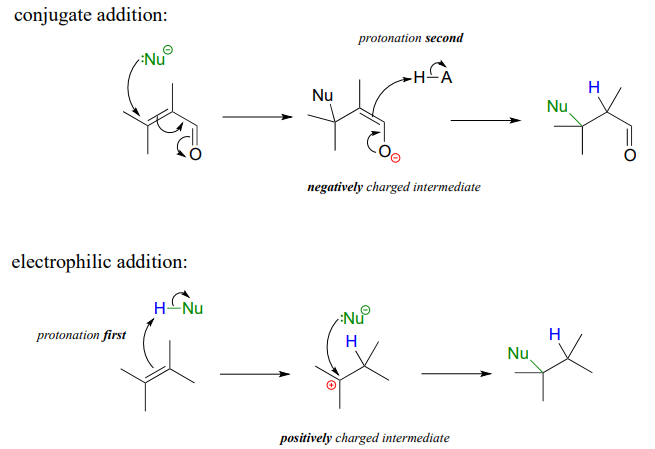
En una adición electrófila, la abstracción de protones ocurre primero, generando un intermedio cargado positivamente. El ataque nucleofílico es el segundo paso. No se requiere ningún grupo carbonilo o imina conjugados: de hecho, un grupo carbonilo cercano en realidad ralentizaría una reacción de adición electrófila hipotética porque un carbonilo es un grupo atrayente de electrones, desestabilizado por carbocationes.
La estereoquímica de la adición electrófila
Dependiendo de la estructura del alqueno inicial, la adición electrófila tiene el potencial de crear dos nuevos centros quirales. La adición\(HBr\) a un alqueno no es estereoselectiva: la reacción da como resultado la racemización en ambos carbonos del alqueno. Considera la adición\(HBr\) de cis-3,4-dimetil-3-hexeno. El paso inicial de abstracción de protones crea un nuevo centro quiral, y debido a que el protón ácido podría agregarse a ambos lados del carbono alqueno plano con igual probabilidad, el centro podría tener cualquiera\(S\) o\(R\) configuración.
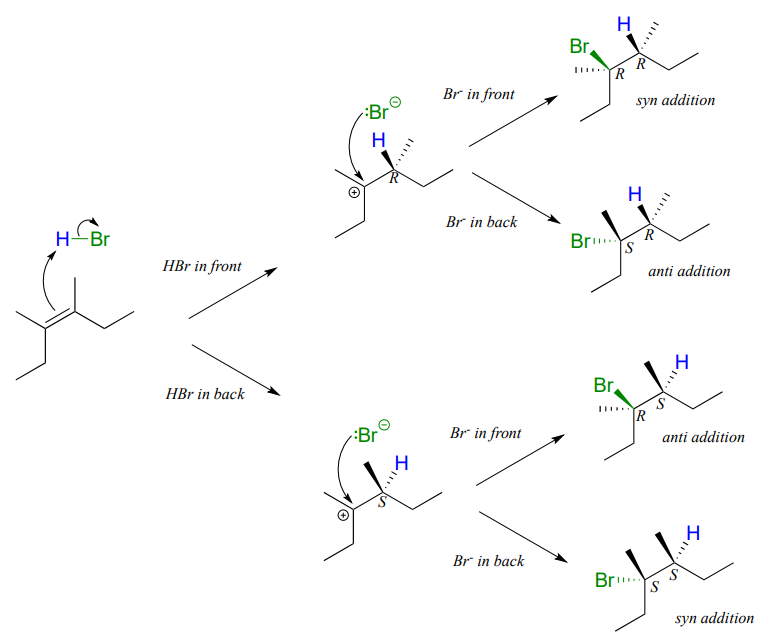
Asimismo, en la segunda etapa el ion bromuro nucleofílico podría atacar desde cualquier lado del carbocatión plano, conduciendo a una mezcla igual de\(S\) and \(R\) configuration at that carbon as well. Therefore, we expect the product mixture to consist of equal amounts of four different stereoisomers.
Predict the product(s) of electrophilic addition of \(HBr\) to the following alkenes. Draw all possible stereoisomers that could form, and take care not to draw identical structures twice.
- trans-2-butene
- cis-3-hexene
- cyclopentene
The regiochemistry of electrophilic addition
In many cases of electrophilic addition to an alkene, regiochemistry comes into play: the reaction can result in the formation of two different constitutional isomers. Consider the electrophilic addition of \(HBr\) to 2-methylpropene:
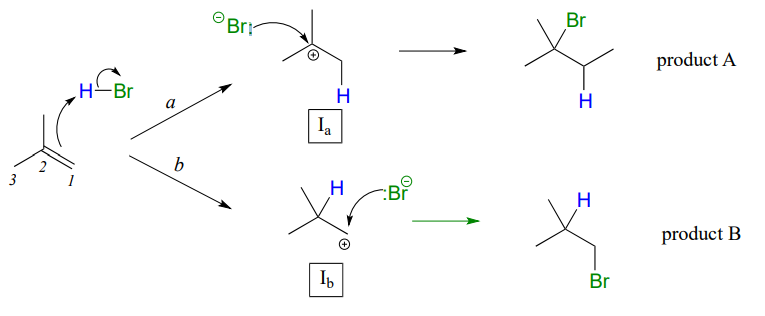
Tenga en cuenta que el carbono #1 y el carbono #2 en el alqueno de partida no son lo mismo: el carbono #2 está unido a dos grupos metilo, y el carbono #1 a dos átomos de hidrógeno. La etapa inicial de protonación podría, por lo tanto, ir de dos maneras diferentes, dando como resultado dos intermedios de carbocatión diferentes. Observe cómo la vía 'a' da un intermedio de carbocatión terciario (\(I_a\)), mientras que la ruta 'b' da un intermedio de carbocatión primario (\(I_b\)) Sabemos por la sección 8.5 que el carbocatión terciario\(I_a\) es menor en energía. En consecuencia, el estado de transición al que\(TS(a)\) conduce\(I_a\) es menor en energía que\(TS(b)\), es decir, que se\(I_a\) forma más rápido que\(I_b\).
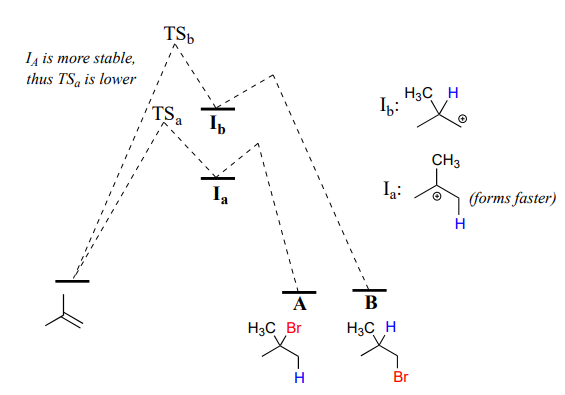
Debido a que la etapa de protonación es la etapa determinante de la velocidad para la reacción, el bromuro de alquilo terciario A se formará más rápido que el bromuro de alquilo primario B, y así A será el producto predominante de la reacción. La adición electrofílica de\(HBr\) to 2-methylpropene is regioselective: more than one constitutional isomer can potentially form, but one isomer is favored over the other. It is generally observed that in electrophilic addition of haloacids to alkenes, the more substituted carbon is the one that ends up bonded to the heteroatom of the acid, while the less substituted carbon is protonated. This 'rule of thumb' is known as Markovnikov's rule, after the Russian chemist Vladimir Markovnikov who proposed it in 1869.
While it is useful in many cases, Markovikov's rule does not apply to all electrophilic addition reactions. It is better to use a more general principle:
When an asymmetrical alkene undergoes electrophilic addition, the product that predominates is the one that results from the more stable of the two possible carbocation intermediates.
How is this different from Markovnikov's original rule? Consider the following hypothetical reaction, in which the starting alkene incorporates two trifluoromethyl substituents:
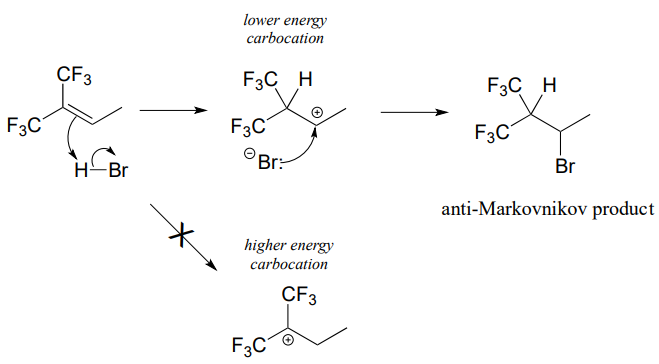
Ahora cuando\(HBr\) se agrega, es el carbocatión menos sustituido el que se forma más rápido en la etapa de protonación determinante de la velocidad, porque en este intermedio el carbono que porta la carga positiva se localiza más lejos de los fluoros que retiran electrones y desestabilizan cationes. Como resultado, el producto predominante es el bromoalcano secundario más que el terciario. Esto se conoce como un producto de adición anti-Markovnikov, porque 'rompe' la regla de Markovnikov.
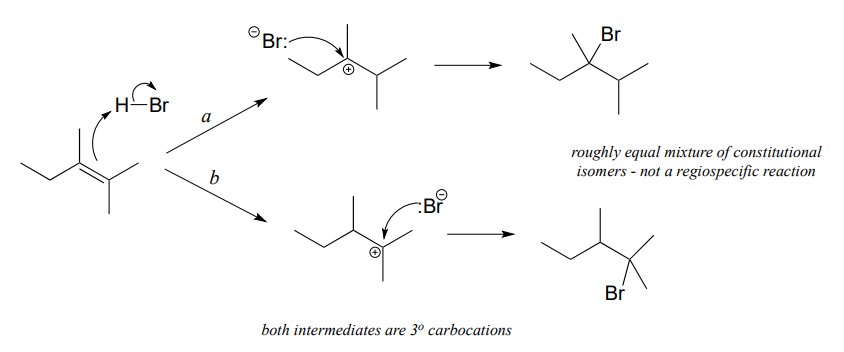
Si los dos posibles intermedios de carbocatión en una reacción de adición electrófila son de estabilidad similar, el producto será una mezcla de isómeros constitucionales.
Adición electrofílica de agua y alcohol
La adición (no bioquímica) de agua a un alqueno es muy similar mecanísticamente a la adición de un haloácido como\(HBr\) or \(HCl\), and the same stereochemical and regiochemical principles apply. A catalytic amount of a strong acid such as phosphoric or sulfuric acid is required, so that the acidic species in solution is actually \(H_3O^+\). Note that \(H_3O^+\) is regenerated in the course of the reaction.

Figura 14.2.10
Si un alqueno se trata con metanol y una cantidad catalítica de ácido fuerte, el resultado es un éter:

Figura 14.2.11
Dibuje un mecanismo para la reacción de formación de éter anterior.
Adición a alquenos conjugados
La adición electrofílica a alquenos conjugados presenta posibilidades regioquímicas adicionales, debido a la deslocalización por resonancia del intermedio de carbocatión alílico. Adición de un equivalente molar de\(HBr\) to 1,3-butadiene, for example, leads to a mixture of three products, two of which are a pair of enantiomers due to the creation of a chiral center at carbon #2.

Figura 14.2.12
Explique por qué el 4-bromo-1-buteno no es un producto significativo de la reacción anterior.
Predecir el producto o productos principales de las siguientes reacciones. Dibuje todos los estereoisómeros posibles, y tenga cuidado de no dibujar la misma estructura dos veces.



- Pista: ¿es probable que los dobles enlaces en un anillo aromático sufran adición electrófila?

Reacciones de adición electrofílica bioquímica
El mirceno es un compuesto isoprenoide sintetizado por muchos tipos diferentes de plantas y utilizado en la preparación de perfumes. Recientemente se ha identificado una vía enzimática para la degradación del mirceno en bacterias (J. Biol. Chem 2010, 285, 30436). El primer paso de esta vía es la adición electrófila de agua a un sistema alqueno conjugado.

Figura 14.2.13
Dibujar un mecanismo para la reacción anterior, mostrando dos contribuyentes de resonancia del intermedio de carbocatión. ¿Cómo caracterizarías al intermedio?
Aunque la hidratación del mirceno anterior parece muy familiar, muchas reacciones de adición electrófila catalizadas por enzimas difieren de lo que hemos visto hasta ahora, en que las especies pobres en electrones atacadas por los electrones unidos por p en la etapa inicial son un carbocatión más que un protón ácido:

Figura 14.2.14
\(\square\)-terpineol, a major component in the sap of pine trees, is formed in an electrophilic addition reaction. The first thing that happens (which we will refer to below as 'step a', in order to keep the step numbering consistent what the addition mechanisms we have seen so far) is departure of a pyrophosphate leaving group, forming an allylic carbocation electrophile.

Figura 14.2.15
La etapa de adición electrófila real de la reacción comienza con la etapa 1, ya que los electrones π y alqueno se dibujan hacia uno de los dos carbonos que comparten la carga positiva, cerrando efectivamente un anillo de seis miembros. Luego, una molécula de agua ataca al segundo intermedio de carbocatión (etapa 2), lo que completa el proceso de adición.
Observe algo importante sobre el curso regioquímico de la reacción: el paso 1 da como resultado la formación de un anillo de seis miembros y un carbocatión terciario. Como hemos subrayado antes, las reacciones bioquímicas tienden a seguir vías mecanicistas energéticamente favorables.
Un curso regioquímico alternativo al paso 1 mostrado anteriormente podría dar como resultado un anillo de siete miembros y un carbocatión secundario, un intermedio mucho menos energéticamente favorable en términos de estabilidad de carbocationes y tamaño del anillo. Dibujar un mecanismo para esta hipotética reacción alternativa, y mostrar el producto que resultaría después de la adición de agua en un hipotético 'paso 2'.



