6: Aminoácidos y Alcaloides
- Page ID
- 70198
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
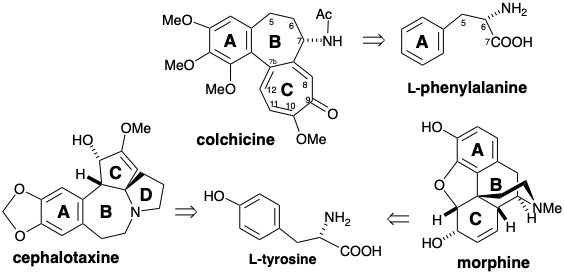
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Los alcaloides son una familia diversa de productos naturales que contienen nitrógeno que generalmente se producen a partir de aminoácidos en las plantas. Los anillos de fenilo derivados de aminoácidos aromáticos a menudo se pueden discernir incrustados en los esqueletos de algunos alcaloides. Por ejemplo, el anillo A de la colchicina se deriva de L-fenilalanina y los anillos A de cefalotaxina y morfina se derivan de L-tirosina. Curiosamente, los carbonos restantes de los alcaloides mencionados anteriormente también se derivan exclusivamente de L-fenilalanina o L-tirosina. La pérdida de aromaticidad que es común durante dicha biosíntesis es un ejemplo de las estrategias sintéticas inusuales que deben adoptarse en Nature debido a una selección limitada de materiales de partida disponibles.
Los anillos aromáticos de policétidos (ver capítulo 5) surgen del acetil-CoA por una vía lineal que culmina en la deshidrociclación de ácidos poli-β-cetoalcanoicos intermedios. En la biosintetsis de los aminoácidos aromáticos L-fenil-alanina, L-tirosina y L-triptófano, los anillos aromáticos se ensamblan por una ruta más convergente comenzando con una condensación aldólica de fosfoenol piruvato (PEP) y eritrosa 4-fosfato (E4P). Estos materiales de partida están disponibles a partir del metabolismo de la glucosa (ver capítulo 2).
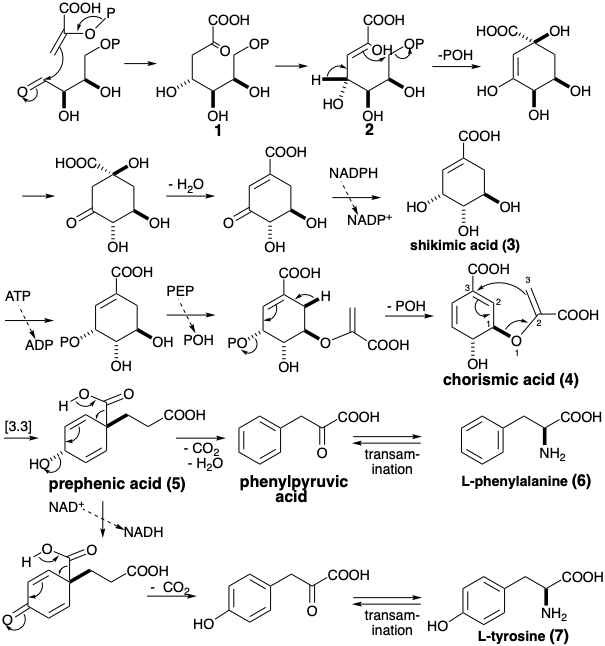
La ciclación del tautomero enólico 2 del ácido 3-desoxi-D-arabinoheptulosónico resultante 7-fosfato (1) recuerda a las ciclaciones de polieno iniciadas por pirofosfatos alílicos que se encuentran en la biosíntesis de terpenos (ver capítulo 4). La deshidratación y la reducción proporcionan entonces ácido shikímico (3), el intermedio por el que se nombra esta vía biosintética. La fosforilación de 3 y la transeterificación con una segunda molécula de PEP conducen a un intermedio pivotal, el ácido corismico (4). El apéndice de los tres carbonos finales de tirosina y fenilalanina se logra mediante un reordenamiento de Claisen, es decir [3.3] sigmatropico de 4 que produce ácido prefénico (5). La eliminación descarboxilativa genera ácido fenilpirúvico a partir de 5, mientras que la oxidación y descarboxilación del b-ceto-ácido vinilógico resultante proporciona ácido p-hidroxifenilpirúvico. La transaminación de los ácidos arilpirúvicos (ver 40 → 43 en la sección 5.3) entrega los correspondientes α-aminoácidos L-fenilalanina (6) y L-tirosina (7).
Los aminoácidos no son los únicos bloques de construcción incorporados a los alcaloides. Así, por ejemplo, algunos alcaloides incorporan materiales de partida de origen terpenoide. La quinina se ensambla en la naturaleza mediante la unión de L-triptófano con secologanina, un monoterpeno. Curiosamente, ni el origen triptófano de la porción aromática de la quinina ni la biogenisis terpenoide de la secologanina son en absoluto obvios.
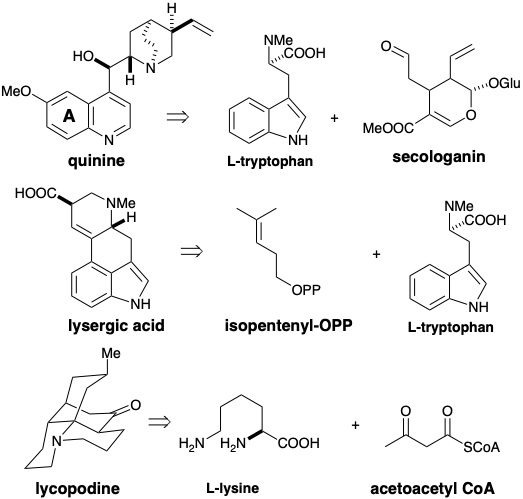
Mucho más evidente es la presencia de L-triptófano y un grupo isopentenilo embebido en el esqueleto del ácido lisérgico. Los fragmentos de policétidos y los aminoácidos no aromáticos también pueden servir como bloques de construcción para los alcaloides. Por ejemplo, la licopodina se deriva en la naturaleza de dos moléculas de L-lisina y una de acetoacetil CoA.


