8.2: Dos modelos mecanicistas para la sustitución nucleofílica
( \newcommand{\kernel}{\mathrm{null}\,}\)
Al comenzar nuestro estudio de las reacciones de sustitución nucleofílica, primero nos centraremos en los compuestos simples de haluro de alquilo. Si bien las reacciones específicas que consideraremos inicialmente no ocurren en los seres vivos, no obstante es útil comenzar con haluros de alquilo como modelo para ilustrar algunas ideas fundamentales que debemos cubrir. Posteriormente, pasaremos a aplicar lo que nos hemos ganado sobre los haluros de alquilo a las biomoléculas más grandes y complejas que ahora mismo están experimentando sustitución nucleofílica en sus propias células.
ElS_N2 mecanismo
Puede recordar de nuestra breve introducción al tema en el capítulo 6 que existen dos modelos mecanicistas de cómo puede proceder una reacción de sustitución nucleofílica. En un mecanismo, la reacción es concertada: se lleva a cabo en una sola etapa, y la formación de uniones y la ruptura del enlace ocurren simultáneamente. Esto se ilustra por la reacción entre clorometano e ión hidróxido:
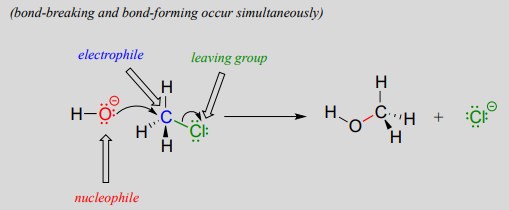
Recordemos que el ion hidróxido en esta reacción está actuando como un nucleófilo (una especie rica en electrones, amante de los núcleos), el átomo de carbono del clorometano está actuando como electrófilo (una especie pobre en electrones que es atraída por los electrones), y el ion cloruro es el grupo saliente (donde el nombre es evidente por sí mismo) .
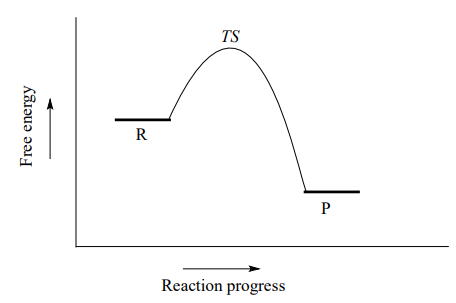
Los químicos orgánicos se refieren a este mecanismo por el términoS_N2 '', donde S significa 'sustitución', el subíndice N significa 'nucleófilo', y el número 2 se refiere al hecho de que se trata de una reacción bimolecular: la velocidad global depende de un paso en el que chocan dos especies separadas. Un diagrama de energía potencial para esta reacción muestra el estado de transición (TS) como el punto más alto en la ruta de los reactivos a los productos.
La geometría de unaS_N2 reacción es específica: la reacción solo puede ocurrir cuando el nucleófilo colisiona con el carbono electrófilo del lado opuesto en relación con el grupo saliente. Esto se conoce como ataque trasero. Acercarse desde el lado frontal simplemente no funciona: el grupo saliente -que, al igual que el nucleófilo es un grupo rico en electrones- bloquea el camino.
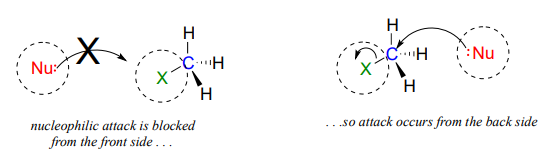 2
2
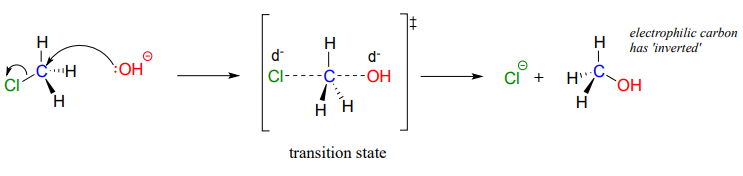
El resultado del ataque posterior es que la geometría de unión en el carbono electrófilo se invierte (se vuelve de adentro hacia afuera) a medida que avanza la reacción.
 3
3
El estado de transición de la reacción se ilustra dibujando líneas punteadas para representar los enlaces covalentes que están en proceso de ruptura o formación. Debido a que la carga formal en el nucleófilo de oxígeno cambia de uno negativo a cero a medida que avanza la reacción, y a la inversa la carga en el grupo saliente de cloro cambia de cero a uno negativo, en el estado de transición ambos átomos se muestran con una carga negativa parcial (el símbolo\delta -). Otra convención de dibujo para estados de transición es usar corchetes, con el símbolo de doble daga en subíndice.
Observe que el estado de transición para unaS_N2 reacción tiene geometría bipiramidal trigonal: el nucleófilo, el electrófilo y el grupo saliente forman una línea recta, y los tres sustituyentes en el carbono (todos los átomos de hidrógeno en este caso) están dispuestos en el mismo plano en120^{\circ} ángulos.
¿Cuál es la medida en grados) delH-C-O angle in the S_N2 estado de transición ilustrado anteriormente?
Consideremos qué pasaría si reemplazáramos uno de los átomos de hidrógeno en el clorometano por deuterio (el^2H isótopo), y uno con tritio (el^3H isótopo radiactivo). Ahora, debido a que tiene cuatro sustituyentes diferentes, nuestro electrófilo de carbono es un centro quiral. Asumiremos arbitrariamente que comenzamos con elS enantiómero.
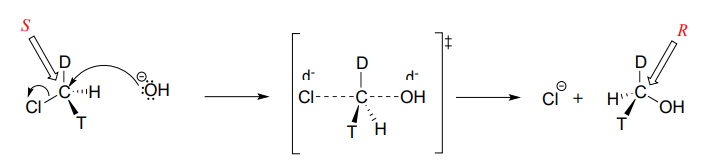
A medida que el nucleófilo del hidróxido ataca desde la parte posterior y la geometría de unión en el carbono se invierte, vemos que la estereoquímica del producto refleja esta inversión: terminamos con elR enantiómero del producto quiral.
S_N2las reacciones proceden con inversión de la configuración estereoquímica en el carbono electrófilo.
video tutorial/animación: inversión de la configuración durante reacciones SN2
ElS_N1 mecanismo
Un segundo modelo para la reacción de sustitución nucleofílica se llama elS_N1 mecanismo. El '1' inS_N1 indica que la etapa determinante de la velocidad de la reacción es unimolecular: en otras palabras, la etapa determinante de la velocidad implica la ruptura de una sola molécula (en lugar de que dos moléculas colisionen como fue el caso en elS_N2 mecanismo).
En unS_N1 mecanismo, el enlace del grupo carbono-saliente se rompe primero, antes de que el nucleófilo se aproxime, dando como resultado la formación de un intermedio carbocatión (etapa 1):
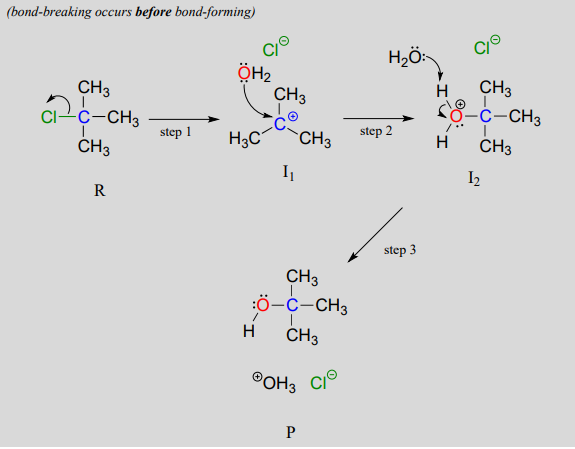
Un carbocatión es un electrófilo poderoso: debido a que el carbono carece de un octeto completo de electrones de valencia, es 'electrón-hambre'. En el paso 2, un par solitario de electrones en el nucleófilo de agua llena el orbital p vacío del carbocatión para formar un nuevo enlace.
Observe que este es en realidad un mecanismo de tres pasos, con un paso final y rápido ácido-base que conduce al producto alcohólico.
Un diagrama de energía potencial para estaS_N1 reacción muestra que cada una de las dos etapas intermedias cargadas positivamente (I_1yI_2 en el diagrama) se puede visualizar como un valle en la trayectoria de la reacción, mayor en energía que tanto el reactivo como el producto pero menor en energía que el estados de transición.
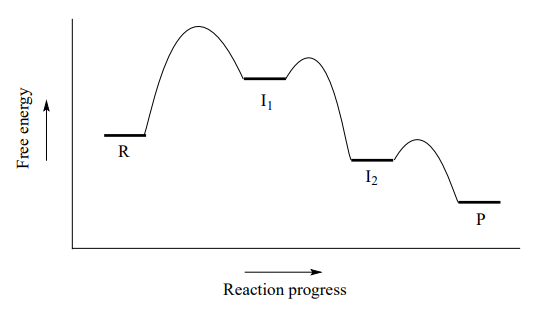
El primer paso de ruptura de enlaces es el paso más lento y determinante de la velocidad; observe que tiene la mayor energía de activación y conduce a las especies de mayor energía (I_1, the carbocatión intermedio). El paso 2 es rápido: se forma un nuevo enlace covalente entre un carbocatión y un nucleófilo de agua, y no se rompen enlaces covalentes. Recordemos del capítulo 7 que los pasos de transferencia de protones de Bronsted-Lowry como el paso 3 son rápidos, con bajas energías de activación.
Las reacciones de sustitución nucleofílica que hemos visto hasta ahora son ejemplos de hidrólisis. Este término es uno que encontrarás frecuentemente en química orgánica y biológica. Hidrólisis significa 'romper con agua': en una reacción de hidrólisis, una molécula de agua (o ion hidróxido) participa en la ruptura de un enlace covalente. Existen muchos tipos de reacciones además de la sustitución nucleofílica que pueden describirse con precisión como hidrólisis, y veremos varios ejemplos a lo largo de los capítulos restantes de este libro.
La solvolisis es un término más general, utilizado cuando un enlace en un reactivo es roto por una molécula de disolvente: generalmente, el disolvente en cuestión es agua o un alcohol como el metanol o el etanol.
Dibujar un mecanismo para la\(S_N1\) solvolisis de cloruro de terc-butilo en metanol. ¿Qué nuevo grupo funcional se ha formado?
Vimos queS_N2 las reacciones resultan en la inversión de la configuración estereoquímica en el centro del carbono. ¿Qué pasa con el resultado estereoquímico deS_N1 las reacciones? Recordemos que unsp^2 carbocatión se hibrida, con un orbital p vacío perpendicular al plano formado por los tres enlaces sigma:
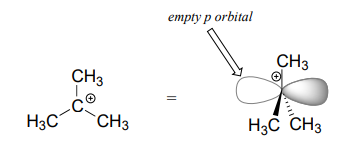
En el segundo paso de unaS_N1 reacción, el nucleófilo puede atacar desde cualquier lado del carbocatión (el grupo saliente ya se ha ido, y así no puede bloquear el ataque de un lado como en unaS_N2 reacción).

Considerar unaS_N1 reacción con un cloruro de alquilo terciario quiral:
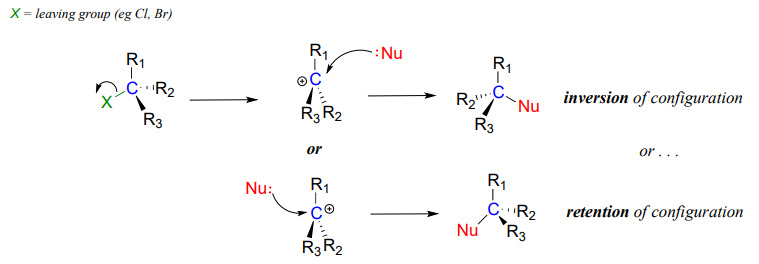
Debido a que el nucleófilo es libre de atacar desde cualquier lado del electrófilo de carbocatión, la reacción conduce a una mezcla 50:50 de dos productos estereoisoméricos. En otras palabras: En general, la reacción SN1 no enzimática puede ocurrir con retención o inversión de configuración en el carbono electrófilo, conduciendo a racemización si el carbono es quiral.
Para un ejemplo, considere la hidrólisis de (S) -3-cloro-3-metilhexano.
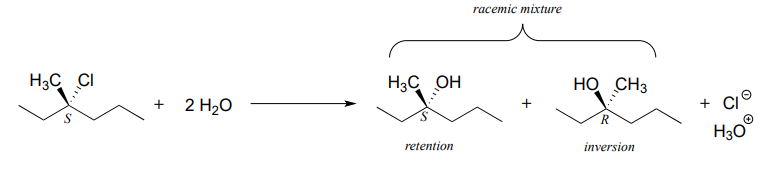
El resultado de esta reacción (no enzimática) es una mezcla racémica de alcoholes quirales.
Es importante recordar, sin embargo, que las reacciones enzimáticas son en casi todos los casos muy específicas con respecto al resultado estereoquímico. UnaS_N1 reacción bioquímica, como veremos más adelante, puede dar como resultado inversión o retención de configuración en el carbono electrófilo, pero generalmente no una mezcla de ambos: los dos reactivos están unidos con geometría específica en el sitio activo de la enzima, de manera que el nucleófilo puede acercarse a partir de uno solo lateral.
(Los siguientes ejercicios se refieren a reacciones no biológicas)
- Dibujar un mecanismo completo para la reacción de hidrólisis en la figura anterior, mostrando todas las etapas de ruptura y formación de enlaces, y todas las especies intermedias.
- Dibujar estructuras que representen TS1 y TS2 en la reacción. Utilice la convención de cuña sólida/tablero para mostrar tres dimensiones.
- ¿Cuál es la rotación óptica esperada de la mezcla de productos?
- ¿Podrían separarse los dos productos orgánicos en una cromatografía en columna de sílice?
- Extraer el (los) producto (s) de la hidrólisis de (R) -3-cloro-3-metil heptano.
- ¿Qué se puede predecir, en todo caso, sobre la rotación óptica del (de los) producto (s)?
- Extraer el (los) producto (s) de la hidrólisis de (3R,5R) -3-cloro-3,5-dimetilheptano.
- ¿Qué se puede predecir, en todo caso, sobre la rotación óptica del (de los) producto (s)?
Antes de continuar analizando algunas reacciones bioquímicas de sustitución nucleofílica reales, primero debemos sentar las bases intelectuales centrándonos más de cerca en las características de los tres socios principales en la reacción de sustitución nucleofílica: el nucleófilo, el electrófilo y el saliente grupo. Además, debemos considerar el carbocatión intermedio que juega un papel tan clave en elS_N1 mecanismo. En aras de la simplicidad, seguiremos utilizando moléculas orgánicas simples, no biológicas y ejemplos de reacción a medida que trabajemos a través de los conceptos básicos.


