8.3: Nucleófilos
( \newcommand{\kernel}{\mathrm{null}\,}\)
¿Qué es un nucleófilo?
Un nucleófilo es un átomo o grupo funcional con un par de electrones (generalmente un par sin enlace, o solitario) que pueden ser compartidos. Lo mismo, sin embargo, puede decirse de una base: de hecho, las bases pueden actuar como nucleófilos, y los nucleófilos pueden actuar como bases. ¿Cuál es entonces la diferencia entre una base y un nucleófilo?
Un Brønsted-Lowry, como recordarán del capítulo 7, utiliza un par solitario de electrones para formar un nuevo enlace con un protón ácido. Pasamos gran parte del capítulo 7 discutiendo cómo evaluar qué tan básica es una especie. Recuerda que cuando evaluamos la basicidad -la fuerza de una base- hablamos en términos de termodinámica: ¿dónde radica el equilibrio en una reacción ácido-base de referencia?
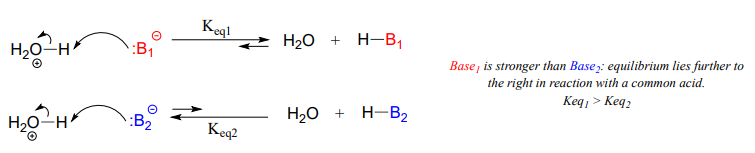
Pasaremos gran parte de esta sección discutiendo cómo evaluar qué tan nucleofílica es una especie, es decir, su nucleofilia. Un nucleófilo comparte su par solitario de electrones con un electrófilo, un átomo pobre en electrones distinto de un hidrógeno, generalmente un carbono. Cuando evaluamos la nucleofilia, estamos pensando en términos de cinética: ¿qué tan rápido reacciona el nucleófilo con un electrófilo de referencia?
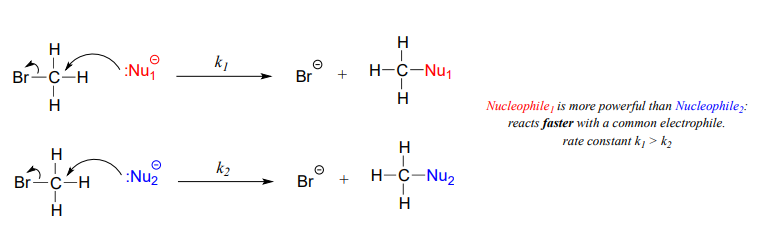
Tanto en la química orgánica de laboratorio como biológica, los átomos nucleofílicos más comunes son el oxígeno, el nitrógeno y el azufre, y los compuestos nucleofílicos y grupos funcionales más comunes son el ion agua/hidróxido, alcoholes, fenoles, aminas, tioles y, a veces, carboxilatos.
En las reacciones de laboratorio (no biológicas), los aniones haluro (I−Cl−,,,F−N3−) y azida () también se ven comúnmente actuando como nucleófilos además de los grupos mencionados anteriormente.Br−
Los átomos de carbono también pueden ser nucleófilos: los iones enolato (sección 7.6) son nucleófilos de carbono comunes en las reacciones bioquímicas, mientras que el ion cianuro (CN−) es solo un ejemplo de un nucleófilo de carbono comúnmente utilizado en el laboratorio.
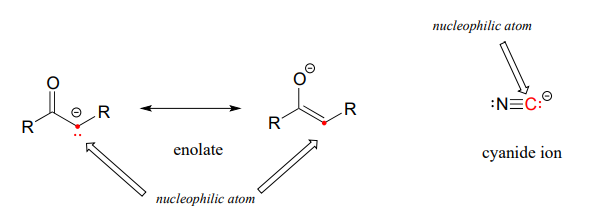
Comprender los nucleófilos de carbono será crítico cuando estudiemos, en los capítulos 12 y 13, las reacciones catalizadas por enzimas en las que se forman nuevos enlaces carbono-carbono en la síntesis de biomoléculas como el ADN y los ácidos grasos. En el presente capítulo, sin embargo, nos centraremos en los nucleófilos heteroatómicos (no carbonados).
Ahora, consideremos una serie de factores que influyen en lo nucleofílico que es un átomo o grupo funcional. Empezaremos con el estado de protonación.
Estado de protonación
El estado de protonación de un grupo tiene un efecto muy grande sobre su nucleofilia. Un ion hidróxido de carga negativa es mucho más nucleófilo (y básico) que una molécula de agua. En términos prácticos, esto significa que un nucleófilo de hidróxido reaccionará en unaSN2 reacción con clorometano varios órdenes de magnitud más rápido que lo hará un nucleófilo de agua.
Asimismo, un anión tiolato es más nucleófilo que un tiol neutro, y una amina neutra es nucleófila, mientras que un catión amonio no lo es.
En un contexto no biológico,SN2 las reacciones tienden a ocurrir con nucleófilos aniónicos más potentes, donde se puede pensar que el nucleófilo desplaza activamente ('empujando') al grupo que sale del carbono. SN1reacciones, por el contrario, tienden a ser reacciones de solvolisis, con un nucleófilo débil y neutro como el agua o un alcohol.
Tendencias periódicas de la nucleofilia
Al igual que con la basicidad, existen tendencias periódicas predecibles asociadas a la nucleofilia. Moviéndose horizontalmente a través de la segunda fila de la tabla periódica, la tendencia en la nucleofilia es paralela a la tendencia en basicidad:
más nucleófiloNH2 - >OH - >F - menos nucleófilo
más nucleófiloR -NH2 >R -OH menos nucleófilo
Recordemos de la sección 7.3 que la basicidad de los átomos disminuye a medida que bajamos verticalmente una columna en la tabla periódica: los iones tiolato son menos básicos que los iones alcóxido, por ejemplo, y el ion bromuro es menos básico que el ion cloruro, que a su vez es menos básico que el ion fluoruro. Recordemos también que esta tendencia puede explicarse considerando el tamaño creciente de la 'nube electrónica' alrededor de los iones más grandes: la densidad electrónica inherente a la carga negativa se extiende alrededor de un volumen mayor, lo que tiende a aumentar la estabilidad (y así reducir la basicidad).
La tendencia periódica vertical para la nucleofilia es algo más complicada que la de basicidad, y depende del disolvente en el que se esté produciendo la reacción. Tomemos el ejemplo general de laSN2 reacción a continuación:
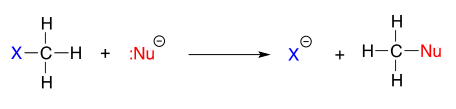
dondeNu− es uno de los iones haluro: fluoruro, cloruro, bromuro o yoduro, yX es un grupo lábil común. Si esta reacción ocurre en un disolvente prótico (es decir, un disolvente que tiene un átomo de hidrógeno unido a un oxígeno o nitrógeno - agua, metanol y etanol son disolventes próticos), entonces la reacción irá más rápida cuando el yoduro es el nucleófilo, y más lenta cuando el fluoruro es el nucleófilo, reflejando el relativo fuerza del nucleófilo.
(¡opuesto a la tendencia en basicidad!)
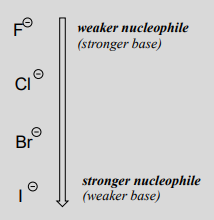
Esto es lo opuesto a la tendencia periódica vertical en basicidad (sección 7.3), donde el yoduro es el menos básico. ¿Qué está pasando aquí? ¿No debería ser también la base más fuerte, con sus electrones de valencia no enlazados más reactivos, el nucleófilo más fuerte?
Como se mencionó anteriormente, todo tiene que ver con el solvente. Recuerden, ahora estamos hablando de la reacción que corre en un solvente prótico como el agua. Las moléculas de disolvente prótico forman fuertes interacciones no covalentes con el nucleófilo rico en electrones, creando esencialmente una 'jaula disolvente' de enlaces de hidrógeno:
Se necesitan obras de arte
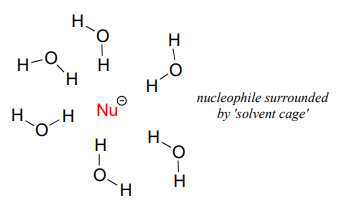
Para que el nucleófilo ataque en unaSN2 reacción, deben interrumpirse los enlaces de hidrógeno nucleófilo-disolvente, es decir, los electrones nucleofílicos deben 'escapar a través de las barras' de la jaula de solventes. Una base débil como el ión yoduro interactúa débilmente con los protones del disolvente, por lo que estas interacciones se alteran más fácilmente. Además, debido a que los electrones de valencia sobre el ión yoduro están lejos del núcleo, la nube de electrones es polarizable; la densidad de electrones se puede separar fácilmente del núcleo, a través de la jaula de solventes y hacia el electrófilo.
Un anión más pequeño y básico, como el fluoruro, está más protegido por interacciones más fuertes con las moléculas de disolvente. La nube de electrones del ion fluoruro es más pequeña y mucho menos polarizable que la de un ion yoduro: en disolvente de agua, el ion yoduro más grande es un nucleófilo más potente que el ion fluoruro más pequeño.
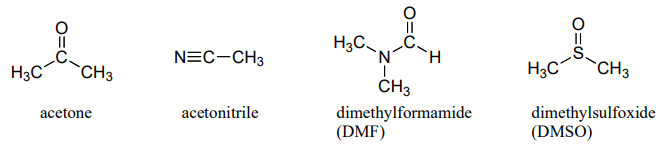
La discusión anterior de la tendencia periódica vertical en la nucleofilia se aplica a las reacciones bioquímicas, debido a que el disolvente biológico es el agua. El panorama cambia para las reacciones de laboratorio si cambiamos a un disolvente aprótico polar, como la acetona, que es lo suficientemente polar como para solvatar los compuestos polares e iónicos en la reacción pero no es un donante de enlaces de hidrógeno, y no forma una 'jaula disolvente' fuerte como lo hace el agua. En acetona y otros disolventes apróticos polares, la tendencia en la nucleofilia es la misma que la tendencia en basicidad: el fluoruro es la base más fuerte y el nucleófilo más fuerte.
A continuación se muestran las estructuras de algunos de los disolventes apróticos polares más comunes. Estos disolventes se utilizan comúnmente en reacciones de sustitución nucleofílica de laboratorio.
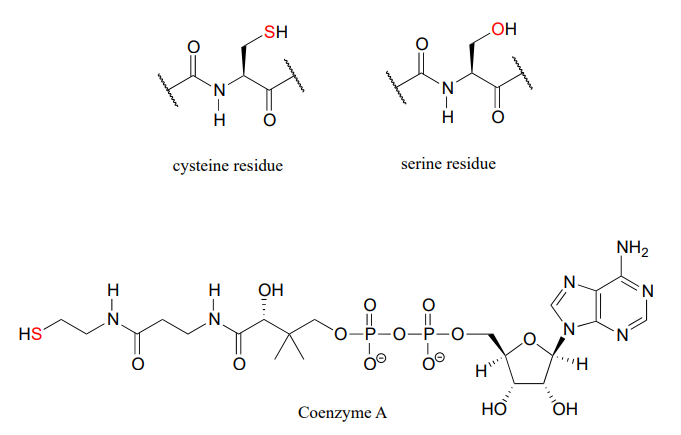
En química biológica, la implicación más importante de la tendencia periódica vertical en la nucleofilia es que los tioles son más nucleofílicos que los alcoholes. El grupo tiol en un residuo de aminoácido de cisteína, por ejemplo, es más nucleófilo que el grupo alcohol en una serina, y la cisteína a menudo actúa como nucleófilo en reacciones enzimáticas. El grupo tiol en la coenzima A es otro ejemplo de un nucleófilo que veremos a menudo en reacciones enzimáticas más adelante. Por supuesto, las reacciones con nucleófilos de oxígeno y nitrógeno también están muy extendidas en bioquímica.
Efectos de resonancia sobre la nucleofilia
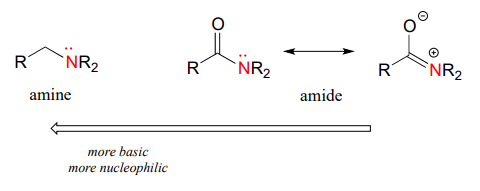
Los efectos de resonancia también entran en juego al comparar la nucleofilia inherente de diferentes moléculas. El razonamiento involucrado es el mismo que el que usamos para entender los efectos de resonancia sobre la basicidad (ver sección 7.3). Si el par solitario de electrones en un heteroátomo se deslocaliza por resonancia, es inherentemente menos reactivo, lo que significa menos nucleófilo y también menos básico. Un ion alcóxido, por ejemplo, es más nucleófilo y más básico que un grupo carboxilato, aunque en ambos casos el átomo nucleófilo es un oxígeno cargado negativamente. En un alcóxido, la carga negativa se localiza en un solo oxígeno, mientras que en el carboxilato la carga se deslocaliza sobre dos átomos de oxígeno por resonancia.
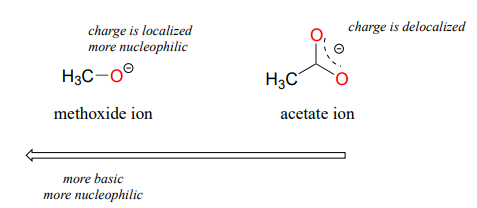
El átomo de nitrógeno en una amida es menos nucleófilo que el nitrógeno de una amina, debido a la estabilización por resonancia del par solitario de nitrógeno proporcionado por el grupo amida carbonilo.
¿Qué aminoácido tiene la cadena lateral más nucleófila, serina o tirosina? Explique.
Efectos estéricos sobre la nucleofilia
El impedimento estérico es una consideración importante a la hora de evaluar la nucleofilidad. Por ejemplo, el terc-butanol es menos potente como nucleófilo que el metanol. Los grupos metilo comparativamente voluminosos en el alcohol terciario bloquean efectivamente la ruta de ataque del oxígeno nucleofílico, ralentizando considerablemente la reacción (¡imagínese tratando de caminar por una puerta estrecha mientras lleva tres maletas grandes!).
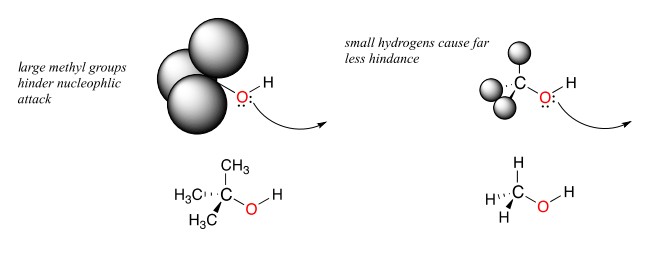
Una nota final: cuando se trata de comparar la tasa de reacciones de sustitución nucleofílica, la fuerza del nucleófilo solo importa paraSN2 las reacciones. Es irrelevante paraSN1 las reacciones, porque la etapa determinante de la velocidad (cuando el grupo de salida se aparta y se forma un intermedio de carbocatión) no involucra al nucleófilo.
¿Cuál es el mejor nucleófilo, una cadena lateral de cisteína o una cadena lateral de metionina? ¿Una serina o una treonina? Explique.
En cada uno de los siguientes pares de moléculas/iones, ¿cuál se espera que reaccione más rápidamente con CH3Cl en acetona solvente? Explica tu elección.
- fenolato (fenol desprotonado) o benzoato (ácido benzoico desprotonado)?
- agua o ion hidronio?
- trimetilamina o trietilamina?
- anión cloruro o anión yoduro?
- ¿CH3NH- o CH3CH2NH2?
- acetato o tricloroacetato?
- anilina o 4-metoxianilina?
- fenolato o 2,6-dimetilfenolato?


